据统计,我国已有约为1×108 hm2盐渍土,且随着人类不合理的开发利用和生态环境的恶化,盐渍土面积仍在进一步扩大,严重制约农业的发展[1]。以pH 8.0为界,可将盐渍土分为中性盐土和碱性盐土,其中,中性盐土是以积累NaCl、Na2SO4和NaNO3为主的混合盐土[2]。研究表明,盐胁迫不仅会诱导植物某些器官的形态、结构发生变化[3-4], 抑制光合作用[5-6],导致植物代谢紊乱进而影响植物的生长发育[7-9];对于观赏植物来说,盐胁迫不仅影响生长发育还影响其观赏价值[10-11]。前人关于盐胁迫对植物的影响和植物耐盐机制的研究大多集中于单盐胁迫,而对混合盐胁迫的研究报道较少。因此,探究混合中性盐胁迫对植物的影响更加贴近实际生产,更加符合我国盐渍土面积逐年扩大的国情, 还可为耐盐植物的合理应用和推广奠定理论基础。
金盏菊(Calendula officinalis)又名金盏花、太阳菊、长春花、灯盏花等,系菊科(Asteraceae)金盏菊属的2年生草本植物,其喜阳光充足与湿润环境, 怕涝[12],适应性强,可耐-9℃低温,花色较丰富, 花期较长,常用作早春园林栽培的花坛花卉与花境花卉,还可用作鲜切花及盆栽观赏[13]。目前,关于金盏菊的研究主要集中在配方施肥[14-15]、耐旱性[16]、重金属胁迫[17-18]和单盐(即NaCl)胁迫[19]等方面,而在混合盐土情况下,金盏菊的耐盐浓度、生长和光合生理指标的变化尚不清楚。为此,本研究以金盏菊幼苗为材料,利用不同浓度的混合中性盐(NaCl和Na2SO4的摩尔比为9:1)模拟中性盐土,研究其对金盏菊幼苗生长发育、光合作用和抗氧化酶活性的影响,以探讨金盏菊幼苗的耐盐机制及筛选耐盐阈值,也为金盏菊耐盐品种的选育及其在盐渍土区域的合理应用与推广提供理论依据,还为盐渍土地区生态系统的改善提供科学支持。
1 材料和方法 1.1 材料和处理供试金盏菊(Calendula officinalis)种子由大连海明园艺有限公司提供。种子经消毒、浸种、催芽后, 播于32孔装有40目石英砂的穴盘中,播后置日光温室内培养,温室的昼/夜温度约为30℃/(18±1)℃, 日间晴天午间光照强度约1 200~1 500 μmol m–2s–1,期间浇灌霍格兰营养液。待幼苗长至四叶一心后,定植于12 cm×15 cm盛有40目石英砂的营养钵中, 每钵1株,共栽植225盆。
待营养钵中金盏菊幼苗长至六叶一心时,用NaCl和Na2SO4摩尔比为9:1的混合中性盐溶液处理。每15盆为1小区,其中3个小区为对照,正常浇灌营养液,另12个小区分别浇灌含有50 (pH 6.64)、100 (pH 6.46)、200 (pH 6.12)、300 mmol L–1 (pH 6.01)的混合中性盐的霍格兰营养液,每处理3次重复, 分别在处理后第7、14、21和28天测定金盏菊幼苗的生长指标,同时取中部功能叶片,带回实验室进行相关生理指标的测定。
1.2 方法生长指标 用直尺和游标卡尺测定幼苗的株高、茎粗。将根、茎、叶分别清洗干净,擦干表面水分后称重即为各器官的鲜质量。均为5次重复。根冠比(%)=根系鲜质量/(茎鲜质量+叶片鲜质量)×100%。
光合指标测定 选取幼苗中部功能叶片,采用CIRAS-3便携式光合/荧光测定系统进行净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)的测定,测定时间为晴天上午的9:30- 10:30,5次重复。
生理指标测定 超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法[20]于560 nm下比色测定;过氧化物酶(POD)活性采用愈创木酚法[20]于470 nm下比色测定;过氧化氢酶(CAT)活性参照赵世杰等[20]的方法测定;丙二醛(MDA)含量采用硫代巴比妥酸法[20]在600、532、450 nm下比色测定。均3次重复。
1.3 数据分析采用Microsoft Excel 2003进行平均值和标准偏差的计算并制图,采用SPSS 17.0软件Duncan法进行差异性显著分析, 以P < 0.05表示差异显著。
2 结果和分析 2.1 对幼苗生长的影响从图 1可以看出,50~100 mmol L–1混合盐处理对金盏菊幼苗的生长影响不明显;而200~300 mmol L–1混合盐处理的生长显著受抑制。随盐浓度的升高, 幼苗的株高、茎粗、根鲜重、茎鲜重与叶片鲜重等均呈先缓慢升高后降低的趋势。50 mmol L–1盐处理28 d的株高、茎粗、根系鲜重、茎鲜重与叶片鲜重分别比对照高2.53%、3.33%、5.93%、16.40%和1.61%,但差异不显著(P > 0.05);而100 mmol L–1盐处理的分别比对照低3.88% (P > 0.05)、3.33% (P > 0.05)、3.58% (P > 0.05)、15.62% (P < 0.05)和13.33% (P < 0.05);而200~300 mmol L–1盐处理的则比对照显著低了14.55%~23.03%、15.56%~16.67%、17.81%~ 17.92%、31.50%~37.27%和28.5%~34.29% (P < 0.05), 这说明50 mmol L–1混合中性盐对金盏菊幼苗的生长略有促进作用,而盐浓度高于100 mmol L–1时则显著抑制其生长。
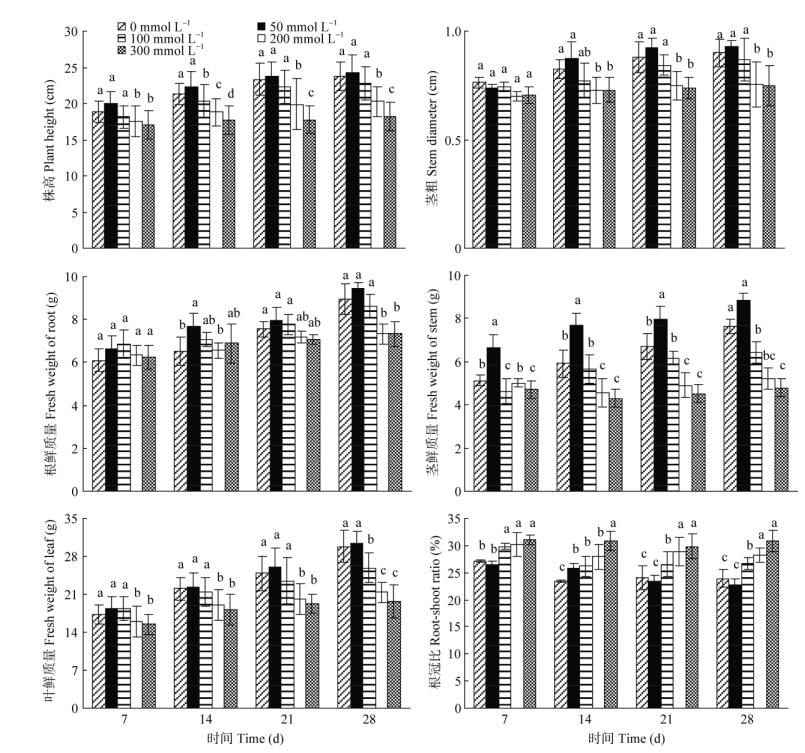
|
图 1 混合中性盐胁迫对金盏菊幼苗生长的影响。同一处理时间柱上不同小写字母表示差异显著(P < 0.05)。 Fig. 1 Effects of mixed neutral salt stress on growth of marigold seedlings. Different letters within treatment time indicate significant difference at 0.05 level. |
混合中性盐胁迫下,金盏菊幼苗根冠比随盐浓度的增加而逐渐增大。处理28 d时,50 mmol L–1盐处理的根冠比略低于对照4.98% (P > 0.05),100、200和300 mmol L–1盐处理的则显著高于对照11.93%、18.55%和29.23% (P < 0.05)。
2.2 对幼苗光合参数的影响不同浓度混合中性盐处理,金盏菊的Pn均随处理时间的延长呈逐渐升高的趋势(图 2);相同处理时间,随着盐浓度的升高,Pn逐渐降低。50 mmol L–1盐处理的Pn略高于对照(P > 0.05),100 mmol L–1盐处理的与对照差异不大(P > 0.05),200与300 mmol L–1盐处理的均比对照低10.79%~24.30%和35.69%~ 41.79% (P < 0.05)。

|
图 2 混合中性盐胁迫对金盏菊叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间二氧化碳浓度(Ci)的影响 Fig. 2 Effect of mixed neutral salt-stress on the photosynthetic rate (Pn), transpiration rate (Tr), stomatal conductance (Gs) and intracellular CO2 concentration (Ci) of Calendula officinalis leaves |
不同浓度混合中性盐胁迫对金盏菊幼苗Tr的影响与Pn基本一致(图 2)。除50 mmol L–1盐处理的Tr与对照的差异不大外(P > 0.05),100、200和300 mmol L–1盐处理的Tr均显著低于对照的11.01%~17.19%、26.85%~35.50%和36.54%~51.17% (P < 0.05)。
混合中性盐胁迫下Gs与Tr的变化趋势相似(图 2)。除50 mmol L–1盐处理7~28 d和100 mmol L–1盐处理7 d的Gs与对照差异不大外(P > 0.05),100、200、300 mmol L–1盐处理的Gs显著低于对照的10.61%~ 20.22%、26.45%~33.40%和32.06%~40.00% (P < 0.05)。
不同浓度盐处理的Ci变化趋势不同(图 2)。50~ 100 mmol L–1盐处理的Ci随处理时间的延长呈先降低后升高的变化趋势,处理14 d时降至最低,此时Ci分别略低于对照7.00%和7.78%,且差异不显著,至处理28 d则略高于对照(P > 0.05);而200与300 mmol L–1盐处理的Ci则随处理时间的延长呈迅速升高的变化趋势,除处理7 d时分别显著低于对照8.50%和11.15% (P < 0.05)外,处理14~21 d高于对照,至处理28 d,分别显著高于对照19.44%和29.18% (P < 0.05)。
2.3 对幼苗叶片保护酶活性与MDA含量的影响不同浓度盐处理的叶片SOD活性均随处理时间的延长呈先升高后降低的变化趋势(图 3)。相同盐处理时期,SOD活性以100 mmol L–1 > 50 mmol L–1 > 对照 > 200 mmol L–1 > 300 mmol L–1。50与100 mmol L–1盐处理的SOD活性均显著高于对照(P < 0.05),至处理21 d达到峰值,分别显著高于对照15.12%和33.87% (P < 0.05),随后下降,至处理28 d仍分别显著高于对照9.02%和24.37% (P < 0.05)。200 mmol L–1盐处理的SOD活性略高于对照(P > 0.05),至处理14 d达到峰值,之后迅速降低;300 mmol L–1盐处理的SOD活性均显著低于对照,至处理28 d,200与300 mmol L–1盐处理的SOD活性分别显著低于对照55.09%和67.84% (P < 0.05)。
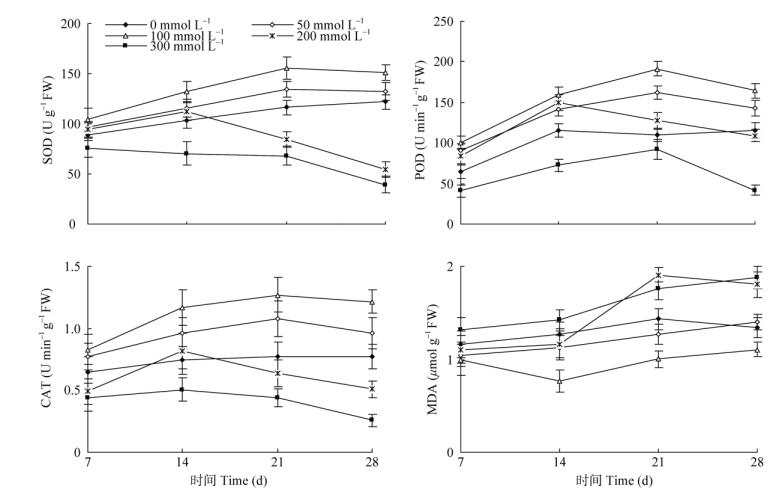
|
图 3 混合中性盐胁迫对金盏菊叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛含量(MDA)的影响 Fig. 3 Effect of mixed neutral salt stress on activities of superoxide dismutase (SOD), peroxidase (POD), catalase (CAT) and MDA content in Calendula officinalis leaves |
不同混合中性盐处理的叶片POD活性变化与SOD基本一致(图 3)。50与100 mmol L–1盐处理的POD活性均显著高于对照,以处理21 d达峰值, 之后降低,处理28 d依然显著高于对照23.55%和42.43% (P < 0.05)。200 mmol L–1盐处理的POD活性在处理14 d达到峰值,之后迅速降低, 处理28 d的略低于对照,但差异不显著(P > 0.05)。而300 mmol L–1盐处理的POD活性始终显著低于对照(P < 0.05)。
混合中性盐胁迫下叶片CAT活性与SOD有相似的变化趋势(图 3)。50与100 mmol L–1盐处理的CAT活性均显著高于对照,以处理21 d达到峰值,之后降低,处理28 d依然显著高于对照27.69%和57.77% (P < 0.05)。200 mmol L–1盐处理14 d的CAT活性达到峰值,略高于对照(P > 0.05),其他处理时间均显著低于对照(P < 0.05),而300 mmol L–1盐处理的CAT活性均显著低于对照(P < 0.05)。
混合中性盐处理的叶片MDA含量总体呈逐渐升高的变化趋势(图 3)。50 mmol L–1盐处理的前21 d, MDA含量均显著低于对照(P < 0.05),处理28 d的MDA含量略高于对照,但差异不显著(P > 0.05)。100 mmol L–1盐处理的MDA含量在处理14 d时降至最低,之后逐渐升高,但均显著低于对照和50 mmol L–1盐处理的(P < 0.05)。200 mmol L–1盐处理的前14 d,MDA含量略低于对照(P > 0.05),之后迅速升高,至处理21 d时达到峰值,且显著高于对照32.98%,之后又下降,处理28 d依然显著高于对照34.89% (P < 0.05)。而300 mmol L–1盐处理的MDA含量均显著高于对照,处理28 d的显著高于对照40.30% (P < 0.05)。
3 讨论 3.1 生长对混合中性盐的反应生长受限是植物对盐胁迫最敏感、最直观的生理反应[21-22],且高浓度盐胁迫会使植物产生离子毒害和渗透胁迫,致使其生长受到抑制[23]。但由于不同植物因其遗传特性、组织结构和生理生化代谢等方面的差异,导致其耐盐能力亦不相同。Woolley[24]研究表明,1 mmol L–1 NaCl处理的番茄(Lycoper- sicon esculentum)干重显著增加,认为NaCl对番茄生长具有一定的促进作用;刘爱荣等[19]也报道, 10 mmol L–1 NaCl处理明显促进金盏菊植株生物量的积累,而100 mmol L–1处理的生物量积累程度与对照差异不大,本研究也有类似结果,50 mmol L–1混合中性盐处理的金盏菊幼苗生长指标明显高于对照,说明该浓度促进金盏菊幼苗的生长;而100 mmol L–1盐处理的金盏菊幼苗各生长指标仅略低于对照,说明金盏菊幼苗可耐100 mmol L–1盐胁迫。根冠比可在一定程度上反映植物的耐盐能力, 盐胁迫下根冠比越大,说明植物耐盐能力越强。本研究结果表明,混合中性盐处理对茎鲜质量和叶片鲜质量的影响显著高于根鲜质量,导致金盏菊幼苗根冠比增大,这与郑春芳等[25]报道NaCl胁迫下桐花树(Aegiceras corniculatum)幼苗根冠比的研究结果不一致,可能与所选试验材料不同有关。
3.2 光合指标对混合中性盐的反应光合作用是植物生长所需能量的主要来源,有研究表明,盐胁迫会导致植物光合能力的降低[26-27]。本研究结果表明,随着混合中性盐浓度的升高,金盏菊幼苗叶片的Pn逐渐降低,而随着处理时间的延长,不同盐浓度处理的Pn逐渐升高。气孔因素与非气孔因素是盐胁迫引起植物Pn下降的主要因素。Farqugar等[28]认为,气孔因素引起的Pn降低表现为Gs和Ci的降低,而非气孔因素引起的Pn降低则伴随着Ci的升高。本研究结果表明,混合中性盐处理7 d,随着盐浓度的逐渐增加,Gs和Ci随着Pn的降低而逐渐降低,说明气孔因素是导致盐处理早期Pn下降的主要因素。而处理14~28 d, Gs虽然与Pn的变化一致,但Ci却逐渐升高,说明随盐处理时间的延长,Pn下降的主要因素是非气孔因素,这与张涛等[29]对结缕草(Zoysia japonica)在NaCl胁迫下的研究结果基本一致。本研究结果还表明,随着处理时间的延长,不同盐浓度处理Pn与Gs逐渐升高,这与王丹等[30]对甘草(Glycyrrhiza uralensis)在盐胁迫下的研究结果一致,而与张涛等[29]的研究结果不一致,这可能与所选材料不同有关。
金盏菊幼苗随混合中性盐浓度的升高,Tr下降, 但在不同盐处理时间的下降速率并不一致,且随着盐胁迫时间的延长,不同盐浓度处理的Tr与Pn变化基本一致,说明盐处理早期,金盏菊幼苗蒸腾速率的降低受气孔因素影响较大,之后因根系与地上部生长受抑制,导致吸水能力降低,最终Tr降低。
3.3 叶片保护酶活性和MDA含量对混合中性盐的反应NaCl和Na2SO4混合中性盐处理与单盐处理相比,不仅加重了植物的生理干旱,更加重了复杂的离子毒害,同时也真实客观地反映生产实际。在正常条件下,植物体内活性氧的产生与清除维持动态平衡,但受到盐渍、干旱等逆境胁迫时,植物会产生大量活性氧,形成氧化损伤,而SOD、POD与CAT等是植物体内重要的活性氧清除酶,可有效清除活性氧自由基[31],维持质膜代谢平衡,使MDA含量维持正常水平。SOD能歧化
综上所述,混合中性盐胁迫显著抑制金盏菊幼苗的生长。轻度盐胁迫下(< 100 mmol L–1),金盏菊幼苗叶片通过提高SOD、POD与CAT活性,降低MDA含量来维持活性氧的代谢平衡与膜结构的完整性,使其维持较强的光合能力,进而维持正常生长。随着盐胁迫程度的增加,叶片内保护酶活性迅速降低,导致活性氧代谢平衡被打破,膜透性遭到严重破坏,使其光合能力迅速下降,进而影响其生长发育。本研究结果表明,金盏菊幼苗可耐100 mmol L–1混合中性盐(NaCl和Na2SO4的摩尔比为9:1)胁迫。本研究不仅对盐渍土地区园林绿化品种的开发,还对盐渍土生态系统的改善具有深远的现实意义。值得一提的是,本研究通过利用混合中性盐模拟中性盐土环境,基本界定了金盏菊幼苗对中性盐的耐受阈值,但在实际生产中,盐碱土的成分复杂,在混合盐碱条件下,金盏菊幼苗的生理特性会如何变化,还需进一步的研究。
| [1] |
NIU D L, WANG Q J. Research progress on saline-alkali field control[J].
Chin J Soil Sci, 2002, 33(6): 449-455. 牛东玲, 王启基. 盐碱地治理研究进展[J]. 土壤通报, 2002, 33(6): 449-455. DOI:10.3321/j.issn:0564-3945.2002.06.014 |
| [2] | YANG C W, XU H H, WANG L L, et al. Conparative effects of salt-stress and a kali-stress on the growth, photosynthesis, solute accumulation, and ion balance of barley plants[J]. Photosynthetica, 2009, 47(1): 79-86. DOI:10.1007/s11099-009-0013-8 |
| [3] | BARANOVA E N, GULEVICH A A, POLYAKOV V Y, et al. Compa-rative analysis of anatomic structure of cotyledons for determining salt and osmotic tolerance of modified plants[J]. Russ Agric Sci, 2007, 33(4): 236-238. DOI:10.3103/S1068367407040076 |
| [4] |
QIN L, KANG W H, QI Y L, et al. Effects of salt stress on mesophyll cell structures and photosynthetic characteristics in leaves of wine grape (Vitis spp.)[J].
Sci Agric Sin, 2012, 45(20): 4233-4241. 秦玲, 康文怀, 齐艳玲, 等. 盐胁迫对酿酒葡萄叶片细胞结构及光合特性的影响[J]. 中国农业科学, 2012, 45(20): 4233-4241. DOI:10.3864/j.issn.0578-1752.2012.20.013 |
| [5] | PENG Y L, GAO Z W, GAO Y, et al. Eco-physiologica1 characteristics of alfalfa seedlings in response to various mixed salt-alkaline stresses[J]. J Integr Plant Biol, 2008, 50(1): 29-39. DOI:10.1111/j.1744-7909.2007.00607.x |
| [6] | SHU S, YUAN L Y, GUO S R, et al. Effects of exogenous spermine on chlorophyll fluorescence, antioxidant system and ultrastructure of chloroplasts in Cucumis sativus L.under salt stress[J]. Plant Physiol Biochem, 2013, 63: 209-216. DOI:10.1016/j.plaphy.2012.11.028 |
| [7] | BERNSTEIN N, SHORESH M, XU Y, et al. Involvement of the plant antioxidative response in the differential growth sensitivity to salinity of leaves vs roots during cell development[J]. Free Rad Biol Med, 2010, 49(7): 1161-1171. DOI:10.1016/j.freeradbiomed.2010.06.032 |
| [8] |
HONG W J, SHEN C Q, ZHUANG X Y, et al. Effect of NaCl stress on physiological responses and anatomical structure of Salix spp.seedlings[J].
J Trop Subtrop Bot, 2017, 25(5): 489-496. 洪文君, 申长青, 庄雪影, 等. 盐胁迫对竹柳幼苗生理响应及结构解剖的研究[J]. 热带亚热带植物学报, 2017, 25(5): 489-496. DOI:10.11926/jtsb.3741 |
| [9] |
LU L M, WU F M, ZHANG Q, et al. Growth and physiological indexes of Ixora collinea 'Gillettese How' under NaCl stress[J].
J Trop Subtrop Bot, 2015, 23(3): 262-267. 陆銮眉, 吴福妹, 张琼, 等. NaCl胁迫对大黄龙船花生长及生理生化的影响[J]. 热带亚热带植物学报, 2015, 23(3): 262-267. DOI:10.11926/j.issn.1005-3395.2015.03.005 |
| [10] |
GUAN Z Y, CHEN S M, CHEN F D, et al. Salt tolerance screening of 32 taxa from Chrysanthemum and its relative genera[J].
Sci Agric Sin, 2010, 43(19): 4063-4071. 管志勇, 陈素梅, 陈发棣, 等. 32个菊花近缘种属植物耐盐性筛选[J]. 中国农业科学, 2010, 43(19): 4063-4071. DOI:10.3864/j.issn.0578-1752.2010.19.019 |
| [11] |
GUAN Z Y, CHEN F D, CHEN S M, et al. Morphological and physiological changes of chrysanthemum inflorescence under NaCl stress[J].
Acta Bot Boreali-Occid Sin, 2009, 29(8): 1624-1629. 管志勇, 陈发棣, 陈素梅, 等. NaCl胁迫对菊花花序形态及生理指标的影响[J]. 西北植物学报, 2009, 29(8): 1624-1629. DOI:10.3321/j.issn:1000-4025.2009.08.020 |
| [12] |
GUO W M, MAO L S.
Introduction of Ornamental Horticulture[M]. Beijing: China Agricultural Press, 2001: 234.
郭维明, 毛龙生. 观赏园艺概论[M]. 北京: 中国农业出版社, 2001: 234. |
| [13] | AZZAZ N A, HASSAN E A, ELEMAREY F A, et al. Physiological, anatomical, and biochemical studies on pot marigold (Calendula officinalis L.) plants[J]. Afr Crop Sci Soc Conf, 2007, 5(8): 1727-1738. |
| [14] |
JIANG Z P, LU J W, LI W X, et al. Studies on fertilization effect and fertilizer formula screen for Calendula officinalis L.[J].
Acta Hort Sin, 2007, 35(2): 269-276. 蒋志平, 鲁剑巍, 李文西, 等. 盆栽金盏菊氮磷钾肥料配方的研究[J]. 园艺学报, 2007, 35(2): 269-276. DOI:10.16420/j.issn.0513-353x.2008.02.008 |
| [15] |
ZHANG W J, LU J W, JIANG Z P, et al. Effects of nitrogen, phosphorus, and potassium fertilizer on the growth, blossom, and N, P, K uptake in Calendula officinalis L.[J].
J Wuhan Bot Res, 2010, 28(4): 491-196. 张文君, 鲁剑巍, 蒋志平, 等. 施肥对金盏菊生长、开花及养分吸收的影响[J]. 武汉植物学研究, 2010, 28(4): 491-196. DOI:10.3724/SP.J.1142.2010.40491 |
| [16] |
LIU W L, SHI S L, MA H L, et al. Comparative research on the drought resistance of four flower plants of ground cover in the common garden of Lanzhou[J].
Acta Agrest Sin, 2015, 23(4): 780-784. 刘文兰, 时尚礼, 马晖玲, 等. 兰州市4种常见园林观花地被植物抗旱性比较研究[J]. 草地学报, 2015, 23(4): 780-784. DOI:10.11733/j.issn.1007-0435.2015.04.017 |
| [17] |
LIU J N, ZHOU Q X, SUN T. Growing responses and hyper accu-mulating characteristics of three ornamental plants to Cd-Pb combined pollution[J].
Acta Sci Circumst, 2006, 26(12): 2039-2044. 刘家女, 周启星, 孙挺. Cd-Pb复合污染条件下3种花卉植物的生长反应及超积累特性研究[J]. 环境科学学报, 2006, 26(12): 2039-2044. DOI:10.3321/j.issn:0253-2468.2006.12.017 |
| [18] |
BAI X Y, LIU H H, HAN B P, et al. Experimental study on ornamental plants remediation of heavy metals in sewage sludge[J].
Environ Sci Technol, 2010, 33(10): 39-44, 105. 白向玉, 刘汉湖, 韩宝平, 等. 花卉植物修复剩余污泥中重金属的实验研究[J]. 环境科学与技术, 2010, 33(10): 39-44, 105. DOI:10.3969/j.issn.1003-6504.2010.10.009 |
| [19] |
LIU A R, ZHANG Y B, FANG Y Y, et al. Effects of salt stress on the growth, antioxidant ability and salt stress protein of Calendula officinalis[J].
Acta Pratac Sin, 2011, 20(6): 52-59. 刘爱荣, 张远兵, 方圆圆, 等. 盐胁迫对金盏菊生长、抗氧化能力和盐胁迫蛋白的影响[J]. 草业学报, 2011, 20(6): 52-59. DOI:10.11686/cyxb20110607 |
| [20] |
ZHAO S J, SHI G A, DONG X C.
Techniques of Plant Physiological Experiment[M]. Beijing: China Agricultural Science and Technology Press, 2002: 95-97.
赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002: 95-97. |
| [21] | HERNÁNDEZ J A, OLMOS E, CORPAS F J, et al. Salt-induced oxidative stress in chloroplasts of pea plants[J]. Plant Sci, 1995, 105(2): 151-167. DOI:10.1016/0168-9452(94)04047-8 |
| [22] | TAKEMURA T, HANAGATA N, SUGIHARA K, et al. Physiological and biochemical responses to salt stress in the mangrove, Bruguiera gymnorrhiza[J]. Aquat Bot, 2008, 68(1): 15-28. DOI:10.1016/S0304-3770(00)00106-6 |
| [23] | QIAN Y L, ENGELKE M C, FOSTER M. Salinity effects on zoysia-grass cultivars and experimental lines[J]. Crop Sci, 2000, 40(2): 488-492. DOI:10.2135/cropsci2000.402488x |
| [24] | WOOLLEY J T. Sodium and silicon as nutrients for the tomato plant[J]. Plant Physiol, 1957, 32(4): 317-321. DOI:10.1104/pp.32.4.317 |
| [25] |
ZHENG C F, JI D W, LIU W C, et al. Eco-physiological responses of high-latitude transplanted Aegiceras corniculatum seedlings to NaCl stress[J].
Chin J Appl Ecol, 2011, 22(9): 2279-2284. 郑春芳, 冀德伟, 刘伟成, 等. NaCl胁迫下高纬度移植桐花树幼苗的生理生态效应[J]. 应用生态学报, 2011, 22(9): 2279-2284. |
| [26] | KE Y Q, PAN T G. Effects of salt stress on the ultrastructure of chloroplast and the activities of some protective enzymes in leaves of sweet potato[J]. Acta Photophysiol Sin, 1995, 25(3): 229-233. |
| [27] | MORADI F, ISMAIL A M. Responses of photosynthesis, chlorophyll fluorescence and ROS-scavenging systems to salt stress during seedlings and reproductive stages in rice[J]. Ann Bot, 2007, 99(6): 1161-1173. DOI:10.1093/aob/mcm052 |
| [28] | FARQUHAR D G, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Ann Rev Plant Physiol, 1982, 33(1): 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [29] |
ZHANG T, LIU X B, LI Z H, et al. Effects of salt stress on the growth and photosynthetic physiology characteristics of Zoysia japonica[J].
Acta Agrest Sin, 2015, 23(3): 539-548. 张涛, 刘信宝, 李志华, 等. NaCl胁迫对结缕草生长及光合生理的影响[J]. 草地学报, 2015, 23(3): 539-548. DOI:10.11733/j.issn.1007-0435.2015.03.016 |
| [30] |
Wang D, Wan C Y, Hou J L, et al. The effect of salt stress on content of photosynthetic pigment and photosynthetic characteristics in Glycyrrhiza uralensis Fisch[J].
Chin J Trop Crops, 2014, 35(5): 957-961. 王丹, 万春阳, 侯俊玲, 等. 盐胁迫对甘草叶片光合色素含量和光合生理特性的影响[J]. 热带作物学报, 2014, 35(5): 957-961. DOI:10.3969/j.issn.1000-2561.2014.05.021 |
| [31] | SIDDIQUI M H, AL-KHAISHANY M Y, AL-QUTAMI M A, et al. Morphological and physiological characterization of different geno-types of faba bean under heat stress[J]. Saudi J Biol Sci, 2015, 22(5): 656-663. DOI:10.1016/j.sjbs.2015.06.002 |
| [32] |
HE M, WANG H, XU P F, et al. Physiological responses of Miscanthus sacchariflorus seedlings under mixed salt alkali stress[J].
Acta Bot Boreali-Occid Sin, 2016, 36(3): 506-514. 何淼, 王欢, 徐鹏飞, 等. 荻幼苗对复合盐碱胁迫的生理响应[J]. 西北植物学报, 2016, 36(3): 506-514. DOI:10.7606/j.issn.1000-4025.2016.03.0506 |
| [33] |
TENG W C, ZHENG S X, QIN M, et al. Physiological mechanism of Lagerstroemia speciosa L.seedlings under salt stress[J].
J NE For Univ, 2015, 43(7): 31-34. 滕维超, 郑绍鑫, 覃梅, 等. 大花紫薇幼苗对盐胁迫的生理响应[J]. 东北林业大学学报, 2015, 43(7): 31-34. DOI:10.13759/j.cnki.dlxb.20150703.009 |
 2018, Vol. 26
2018, Vol. 26

