六角果鸢尾(Iris hexagona)原产于美国路易斯安娜州,目前主要分布于墨西哥湾的海滨滩涂。其具有花大色艳、花型奇特、适应于盐土水域生长等特点,对于海滨地区滩涂绿化具有较高的应用价值。近年来,对六角果鸢尾的研究多集中在耐盐性[1-2]、耐寒性[3]和遗传特异性[4]等方面,而对其繁殖技术体系的研究尚未见报道。在自然状态下,鸢尾属植物主要有种子繁殖和分株繁殖两种繁殖途径,目前有许多鸢尾品种不能形成种子,使种子繁殖受到很大局限性,并且分株繁殖速度慢,规模有限,不能满足大规模商业生产的需求[5],通过组织培养快速繁殖是目前尽快满足应用需求的有效途径[5-6]。目前组织培养技术在德国鸢尾(I. germanica)[6-7]、西伯利亚鸢尾(I. sibirica)[8]、溪荪(I. sanguinea)[9]等鸢尾属植物中获得了成功,但不同种类的鸢尾属植物对不定芽诱导、增殖、生根适宜的培养基和生长调节剂组合并不相同。因此,本文对六角果鸢尾组织培养快速繁殖体系进行研究,以期为六角果鸢尾产业化推广应用提供技术支持。
1 材料和方法 1.1 材料和消毒采用田间栽种的六角果鸢尾(Iris hexagona)一年生根状茎为为外植体,用流水清洗干净(1~2 h), 再用洗洁精溶液浸泡根状茎搅拌消毒10 min,冲洗干净后放入烧杯中,盖上纱布,置于流水中冲洗(3~ 4 h)。于超净工作台上,先加入75%的酒精浸泡根状茎30 s,无菌水冲洗3次后用0.1%的HgCl2分别浸泡11、13、15、17 min,浸泡过程不断搅拌,无菌水冲洗5次后置于无菌培养皿中,用无菌滤纸吸干表面的水分,用解剖刀从节间部位切取外植体块(以节部为中心),接种于培养基中, 每瓶接3块, 培养7 d后观察,以筛选最佳消毒时间。重复3次。
1.2 基本培养基的筛选根状茎外植体消毒后接种于丛生芽诱导培养基上。诱导培养基选用MS、1/2MS和N6为基本培养基,并附加0.5 mg L–1 6-BA+0.8 mg L–1 NAA+0.6 mg L–1 KT。每个处理接种10瓶,每个培养瓶中接种3个茎段,暗培养10 d后光照培养20 d进行观察统计。重复3次。
1.3 丛生芽诱导和增殖的植物生长调节剂配方筛选将根状茎接种于最佳基本培养基中,植物生长调节剂6-BA和NAA采用两因素完全随机区组设计, 共9个处理(表 1)。每个处理10瓶,每瓶接种3个茎段,暗培养10 d后光照培养20 d进行观察统计。重复3次。
| 表 1 丛生芽诱导的试验设计方案 Table 1 Experimental design for buds induction |
诱导出的健壮丛生芽,切取茎段,接种于添加不同植物生长调节剂的MS培养基上进行增殖培养, 6-BA、NAA和KT采用三因素三水平L9(33)正交试验设计(表 2),共9个处理,每个处理30瓶,每瓶接种1个茎段,光照培养30 d后进行观察统计。重复3次。
| 表 2 丛生芽增殖的正交设计试验 Table 2 Orthogonal designs for buds proliferation |
将六角果鸢尾健壮不定芽接种于MS培养基中, 设置IBA浓度梯度为0、0.1、0.5、1.0和1.5 mg L–1, 每个处理接种15瓶,每瓶接种1个不定芽, 每7 d观察1次,45 d后用根系分析仪测定组培苗的根系特征值。
按照常规方法炼苗移栽。移栽前将试管苗取出,用温水仔细清洗根部的培养基,移栽入基质中。移栽基质分别为腐殖土、珍珠岩+泥炭土+蛭石(1:2:1)、蛭石+珍珠岩(1:1),移栽前用0.2%~ 0.4%的多菌灵水溶液对基质进行消毒,移栽前期经常给小苗喷雾,适时浇水,防止小苗失水萎蔫,移栽30 d后进行观察统计。
1.5 数据的统计分析采用Excel 2003进行数据统计,用SPSS 17.0进行极差分析,用Duncan’s法进行显著性检验。
2 结果和分析 2.1 消毒时间的影响HgCl2消毒时间与外植体的死亡率呈正相关, 而与污染率呈负相关,表明HgCl2消毒时间越长对外植体的毒害作用越大。HgCl2消毒时间为11 min时, 外植体的污染率最大(53.53%), 死亡率为5.77%。消毒13 min的外植体死亡率只有6.90%,污染率为33.30%;消毒15 min的污染率(27.10%)虽比13 min有所下降,但死亡率却大幅度上升,达到30.63%;当消毒时间延长到17 min,外植体的死亡率极显著上升,高达78.47%。因此,根状茎的HgCl2消毒时间以13 min为最佳。
2.2 基本培养基的影响根状茎分别接种在3种基本培养基上培养30 d后,丛生芽诱导率的差异达极显著水平(P < 0.01)。MS培养基中丛生芽的诱导率最高,达45.56%,而在1/2MS和N6培养基中诱导率则较低,分别为24.44%和0。在MS培养基中诱导的丛生芽高大健壮,叶片正常伸展,而在1/2MS培养基中诱导的丛生芽矮小瘦弱, 叶扭曲, N6培养基中无丛生芽萌生。因此,MS培养基可作为六角果鸢尾组织培养的最适基本培养基。
2.3 植物生长调节剂配方的影响在植物生长调节剂配方的9组处理中(表 3), A7与A8处理的不定芽诱导率最高,且差异不显著, 但与其他处理的差异均达极显著水平(P < 0.01)。因此A7与A8处理较适合六角果鸢尾不定芽的诱导。从不定芽长势来看,A7处理的单芽较矮小细弱不易成活,而A8处理诱导的不定芽生长较为健壮。因此, 适合六角果鸢尾不定芽诱导的培养基为MS+6-BA 1.5 mg L–1+NAA 0.5mg L–1,诱导率可达56.67%。选择健壮的不定芽切取茎段,接种于增殖培养基中培养。培养30 d后进行观察统计(表 4)。不同增殖培养基中不定芽的生长情况、增殖系数差异明显, 以B2培养基的增殖系数最高,达3.71,且不定生芽高大健壮,叶色墨绿。因此,六角果鸢尾不定芽增殖的最适宜培养基为MS+6-BA 0.5 mg L–1+NAA 0.2 mg L–1+KT 0.3 mg L–1。极差分析结果表明,植物生长调节剂对不定芽增殖的影响以6-BA > NAA > KT (表 5)。
| 表 3 植物生长调节剂对六角果鸢尾不定芽诱导的影响 Table 3 Effect of plant growth regulator combination on adventitious bud induction of Iris hexagon |
| 表 4 植物生长调节剂对六角果鸢尾不定芽增殖的影响 Table 4 Effect of plant growth regulator on adventitious bud proliferation of Iris hexagon |
| 表 5 极差分析 Table 5 Rang analysis |
将六角果鸢尾健壮不定芽接种于含不同浓度IBA的培养基中,45 d后观察统计生根状况。从表 6可见,随着IBA浓度的增加,根数、长度、表面积、体积、直径、分形维数、生根率均逐渐升高, 形态特征方面也呈现出梯度差异。培养基中不添加IBA时,根直径、生根率显著低于其他处理(P < 0.05), 且多数为无效根,生根速度慢,根系很细,几乎没有侧根,移栽不容易成活。当IBA浓度为1.5 mg L–1时,不定芽生根速度较快,侧根数量丰富,根系粗壮且较长,且根直径与其他处理间达显著差异(P < 0.05,图 1)。
| 表 6 不同IBA浓度六角果鸢尾试管苗根系特征值 Table 6 Eigenvalue of Iris hexagon roots with different concentration of IBA |
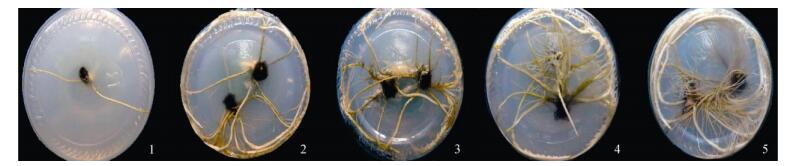
|
图 1 不同IBA浓度对六角果鸢尾不定芽生根的影响。 1: 0; 2: 0.1 mg L–1; 3: 0.5 mg L–1; 4: 1.0 mg L–1; 5: 1.5 mg L–1。 Fig. 1 Effect of IBA concentration on rooting of Iris hexagona. 1: 0; 2: 0.1 mg L–1; 3: 0.5 mg L–1; 4: 1.0 mg L–1; 5: 1.5 mg L–1. |
移栽基质是影响试管苗移栽成活的主要因素, 主要表现在根系的生长和分布情况上。六角果鸢尾试管苗移入3种基质1个月后,移栽的成活率均达到100%,说明六角果鸢尾试管苗极易成活。采用腐殖土、珍珠岩+泥炭土+蛭石(1:2:1)作为移栽基质时,试管苗长势较好,叶色墨绿,植株健壮且生长旺盛。采用蛭石+珍珠岩(1:1)作为移栽基质时,移栽苗的叶色比另两种基质的偏黄,这可能与基质中缺乏营养物质有关。因此,六角果鸢尾试管苗宜采用腐殖土或珍珠岩:泥炭土:蛭石(1:2:1)作为移栽基质。
3 讨论 3.1 不定芽的诱导和增殖基本培养基能提供植物生长所需的基本营养成分,也是植物组织培养能否获得成功的重要因素之一。但是,不同的基本培养基含有不同的离子, 适合培养不同植物[10]。高丽等[11]以素心建兰(Cymbi- dium ensifolium)茎尖诱导产生的根状茎为材料,以MS、1/2MS、Hyponex、KC等为基本培养基,认为MS培养基为最佳增殖培养基。而在体胚再生研究中, Thuzar等[12]报道N6比MS更有利于细胞生长和愈伤细胞分化。对于六角果鸢尾而言,在MS培养基中不定芽的诱导率最高,茎段萌发的不定芽数量最多,说明丰富的有机成分与无机离子有利于不定芽的诱导,而高硝酸钾含量培养基N6和低无机盐培养基1/2MS不适合六角果鸢尾不定芽诱导的培养。
细胞分裂素与生长素对植物芽的诱导和增殖有重要作用。葛桂民等[8]报道6-BA 2.0 mg L–1和NAA 0.2 mg L–1[8]是西伯利亚鸢尾不定芽诱导的最适组合;张全锋等[13]报道6-BA 4.0 mg L–1和NAA 0.5 mg L–1是有髯鸢尾(I. barbata)不定芽增殖的适宜组合。不同浓度的6-BA和NAA导致试管苗玻璃化程度也不一样[14],表明6-BA与NAA的浓度过大或过小都不利于植物芽的诱导或增殖。本研究中,六角果鸢尾不定芽增殖培养基中还添加了KT,虽然极差分析结果表明KT的影响不如6-BA和NAA, 但他们搭配使用能提高丛生芽的增殖系数, 推测KT和NAA配合使用可以对内源激素产生影响,而不定芽中的内源激素发生变化,有利于细胞分裂,从而提高丛生芽的增殖系数。
3.2 组培苗生根的基本条件不定根的形成是组织培养过程中的关键环节, 它直接影响了组培苗移栽成活率的高低,而外源生长调节剂对于不定根的形成具有至关重要的作用, 其含量不同可以导致生根质量差异[15-16]。通常采用PP333、IAA、NAA和IBA进行根系的诱导,其中以NAA与IBA最为常用。张晓丽等[17]诱导盾叶薯蓣(Dioscorea zingiber)试管苗生根的研究表明,IBA使植株根数、根长和株高等性状均优于NAA。在马蔺(I. lactea)[18]、有髯两季花鸢尾‘常春黄’(I. germanica cv. ‘Chang-Chun Huang’)[19]的研究中, IBA的效果明显优于NAA。IBA能够促进生根,是因为它可以通过调节植物体内IAA氧化酶,抑制IAA氧化,从而调节植物体内IAA/ABA的水平, 在一定范围内二者比值高,有利于不定根的形成[20-21]。在德国鸢尾生根影响的研究中,IBA 0.2 mg L–1是不定芽生根的最适宜浓度[22];西伯利亚鸢尾不定芽生根的最适IBA浓度更高,为1.0 mg L–1[21];而六角果鸢尾不定芽生根的IBA浓度为1.5 mg L–1。可以看出,不同种鸢尾的组培苗生根所要求的IBA浓度也是不一样的。此外,经过IBA处理的六角果鸢尾组培苗根数量、直径、生根率均显著高于对照,且不同浓度IBA处理的根系形态不同,这是由于IBA作为重要的植物生长调节剂,参与了根的生长、维管束组织的形成和分化过程[23]。
| [1] | MOPPER S, WIENS K C, GORANOVA G A. Competition, salinity, and clonal growth in native and introduced irises[J]. Amer J Bot, 2016, 103(9): 1575-1581. DOI:10.3732/ajb.1600075 |
| [2] | HANLEY M E, GOVE T L, CAWTHRAY G R, et al. Differential responses of three coastal grassland species to seawater flooding[J]. J Plant Ecol, 2017, 10(2): rtw037 DOI:10.1093/jpe/rtw037 |
| [3] | LI D Q, ZHANG J, ZHANG J P, et al. Green period characteristics and foliar cold tolerance in 12 Iris species and cultivars in the Yangtze Delta, China[J]. Horttechnology, 2017, 27(3): 399-407. DOI:10.21273/HORTTECH03692 |
| [4] | SUNG C J, BELL K L, NICE C C, et al. Integrating Bayesian genomic cline analyses and association mapping of morphological and ecolo-gical traits to dissect reproductive isolation and introgression in a Loui-siana Iris hybrid zone[J/OL]. Mol Ecol, 2018. doi: 10.1111/mec.14481. |
| [5] |
XU Y F, WANG W Y, SUN X M, et al. Research advance in Iris[J].
J Anhui Agric Sci, 2006, 34(24): 6478-6479. 许玉凤, 王文元, 孙晓梅, 等. 鸢尾属植物的研究概况[J]. 安徽农业科学, 2006, 34(24): 6478-6479. DOI:10.13989/j.cnki.0517-6611.2006.24.035 |
| [6] |
DONG Y F, GUO C X, ZHOU Y, et al. Construction of tissue culture system for two Iris germanica varieties[J].
J NW Agric For Univ (Nat Sci), 2014, 42(2): 107-112. 董艳芳, 郭彩霞, 周媛, 等. 2种德国鸢尾组织培养体系的建立[J]. 西北农林科技大学学报(自然科学版), 2014, 42(2): 107-112. DOI:10.13207/j.cnki.jnwafu.2014.02.070 |
| [7] |
LIAO Q, BAI L, MARHAHA Wsman, et al. Iris germanica L.seedlings breeding technology research[J].
Xinjiang Agric Sci, 2017, 54(3): 470-478. 廖晴, 白楠, 玛尔哈巴·吾斯满, 等. 德国鸢尾种苗繁殖技术研究[J]. 新疆农业科学, 2017, 54(3): 470-478. DOI:10.6048/j.issn.100-4330.2017.03.011 |
| [8] |
GE G M, HOU J S, LIU Z L, et al. Research on in vitro propagation of Iris sibirica L.shoot tip[J].
J Henan Agric Sci, 2013, 42(8): 105-108. 葛桂民, 侯俊山, 刘宗立, 等. 西伯利亚鸢尾茎尖离体培养快繁技术研究[J]. 河南农业科学, 2013, 42(8): 105-108. DOI:10.15933/j.cnki.1004-3268.2013.08.043 |
| [9] |
LI L, HANG H, QU Y T, et al. The in-vitro rapid propagation research of the Iris sanguinea[J].
Territ Nat Resour Study, 2017, 39(5): 90-91. 李黎, 韩辉, 曲彦婷, 等. 溪荪鸢尾离体快繁技术研究[J]. 国土与自然资源研究, 2017, 39(5): 90-91. DOI:10.16202/j.cnki.tnrs.2017.05.024 |
| [10] |
MENG Z X, GUO S X, YU X M, et al. Effect of plant growth regulator on proliferation of axillary buds of Anoectochilus roxburghii[J].
Chin Pharm J, 2008, 42(23): 1777-1780. 孟志霞, 郭顺星, 于雪梅, 等. 植物生长调节剂对福建金线莲丛生芽增殖的影响[J]. 中国药学杂志, 2008, 42(23): 1777-1780. DOI:10.3321/j.issn:1001-2494.2008.23.005 |
| [11] |
GAO L, LI H L, YANG B. Effects of basic medium and plant growth regulator combination on multiplication and differentiation of rhizome in Cymbidium ensifolium var.susin[J].
Subtrop Plant Sci, 2007, 36(4): 13-15. 高丽, 李洪林, 杨波. 基本培养基与生长调节剂组合对素心建兰根状茎增殖和芽分化的影响[J]. 亚热带植物科学, 2007, 36(4): 13-15. DOI:10.3969/j.issn.1009-7791.2007.04.004 |
| [12] | THUZAR M, VANAVICHIT A, TRAGOONRUNG S, et al. Efficient and rapid plant regeneration of oil palm zygotic embryos cv.'Tenera' through somatic embryogenesis[J]. Acta Physiol Plant, 2011, 33(1): 123-128. DOI:10.1007/s11738-010-0526-6 |
| [13] |
ZHANG Q F, YIN X Y, CHU B Y, et al. Regeneration system for mature embryo of beared irises hybrid seeds[J].
N Hort, 2016, 40(22): 111-116. 张全锋, 尹新彦, 储博彦, 等. 有髯鸢尾杂交种成熟胚培养成苗技术[J]. 北方园艺, 2016, 40(22): 111-116. DOI:10.11937/bfyy.201622028 |
| [14] |
YAN D K, LIU Z P, LONG X H. Primary culture of Helianthus tuberosus plantlet and its adventitious bud induction from callus[J].
J Plant Resour Environ, 2014, 23(4): 108-110. 严德凯, 刘兆普, 隆小华. 菊芋试管苗的初代培养及愈伤组织不定芽诱导[J]. 植物资源与环境学报, 2014, 23(4): 108-110. DOI:10.3969/j.issn.1674-7895.2014.04.17 |
| [15] |
GU C H, WANG S X, WANG M. In vitro culture and germination of three cultivars of Lagerstroemia indica L.[J].
J Anhui Agric Sci, 2011, 39(23): 14009-14011. 顾翠花, 王守先, 王敏. 3个紫薇品种花粉离体培养与萌发研究[J]. 安徽农业科学, 2011, 39(23): 14009-14011. DOI:10.3969/j.issn.0517-6611.2011.23.041 |
| [16] | FATTORINI L, FALASCA G, KEVERS C, et al. Adventitious rooting is enhanced by methyl jasmonate in tobacco thin cell layers[J]. Planta, 2009, 231(1): 155-168. DOI:10.1007/s00425-009-1035-y |
| [17] |
ZHANG X L, LIU W, LU J, et al. Effect of the different inducible factors on rooting of plantlet cultured in vitro of Dioscorea zingi-berensis C.H.Wright[J].
Seed, 2013, 32(2): 114-116. 张晓丽, 刘雯, 芦婕, 等. 不同诱导因子对盾叶薯蓣试管苗生根的影响[J]. 种子, 2013, 32(2): 114-116. DOI:10.3969/j.issn.1001-4705.2013.02.038 |
| [18] |
MENG L, XIAO K, ZHAO M L, et al. Technological system of tissue culture and rapid propagation of Iris lactea Pall.var.chinensis (Fisch.) Koidz.[J].
Bull Bot Res, 2009, 29(2): 193-197. 孟林, 肖阔, 赵茂林, 等. 马蔺组织培养快繁技术体系研究[J]. 植物研究, 2009, 29(2): 193-197. DOI:10.7525/j.issn.1673-5102.2009.02.012 |
| [19] |
WU J H, LI Y H. Study on tissue culture and rapid propagation of Iris germanica cv.'Chang-Chun Huang' spending two seasons with beard[J].
J Anhui Agric Sci, 2010, 38(33): 18671-18672. 吴建华, 李永华. 有髯两季花鸢尾'常春黄'组织培养快繁技术研究[J]. 安徽农业科学, 2010, 38(33): 18671-18672. DOI:10.3969/j.issn.0517-6611.2010.33.019 |
| [20] |
HAN D W. Effect of IBA on rooting of blueberry seedlings[J].
Jiangsu Agric Sci, 2013, 41(7): 38-40. 韩德伟. IBA对蓝莓组培苗瓶内生根的影响[J]. 江苏农业科学, 2013, 41(7): 38-40. DOI:10.3969/j.issn.1002-1302.2013.07.012 |
| [21] |
ZHU J F, LI F, YUAN Y M, et al. Research on tissue culture and rapid propagation of Iris[J].
Acta Agric Jiangxi, 2015, 27(5): 25-28. 祝剑峰, 李芬, 袁宇明, 等. 鸢尾组织培养快速繁殖技术研究[J]. 江西农业学报, 2015, 27(5): 25-28. DOI:10.19386/j.cnki.jxnyxb.2015.05.006 |
| [22] |
GAO L B, LIANG C H, DENG Y, et al. Preliminary study on effect of IBA on rooting of Iris[J].
Shanghai Agric Sci Technol, 2010, 40(3): 122-123. 郜李彬, 梁晨浩, 邓源, 等. IBA对鸢尾生根培养的初步研究[J]. 上海农业科技, 2010, 40(3): 122-123. DOI:10.3969/j.issn.1001-0106.2010.03.085 |
| [23] |
LÜ J, YU J Q. Mechanism of auxin action[J].
Plant Physiol Commun, 2004, 40(5): 624-628. 吕健, 喻景权. 植物生长素的作用机制[J]. 植物生理学通讯, 2004, 40(5): 624-628. |
 2018, Vol. 26
2018, Vol. 26


