b. 云南农业大学西南中药材种质创新与利用国家地方联合工程研究中心, 昆明 650201
b. Yunnan Provincial Research Center on Good Agricultural Practice for Dominant Chinese Medicinal Materials, Yunnan Agricultural University, Kunming 650201, China
光照的强弱影响植物的光合作用及生物量分配等生理过程,从而对植物的生长产生影响。光照强度的变化还会影响植物地下根的形态、生物量及次生代谢产物积累[1-3]。当环境光强降低时,植物会发生一系列的形态变化,如植株冠幅增大、株高和叶面积增加、分枝数和单株叶片数减少等,以增加光能的捕获效率[4]。毛立彦等[5]报道提高光强加速了曼陀罗(Datura stramonium)的生殖生长、增加了茎和叶生物量的积累;相对较高的光照条件有利于淫羊藿(Epimedium bervicornum)结实率的提高[6]。
植物叶片是对光照最敏感的器官之一。高光照时,叶片的比叶面积(SLA)较低,叶片、叶肉细胞都较厚,栅栏组织层数和海绵组织细胞较多、单位叶面积叶绿体数目较高等[7-12]。植物主要是在栅栏组织进行光合作用,其含有较多叶绿体,弱光下叶绿体大多分布于栅栏组织的细胞质内,以便叶绿体吸收光能。此外,植物生长环境的光照强度同样影响叶片的亚显微结构,低光照时,叶绿体基质的体积比较小,而叶绿体基粒的体积比较大[13]。植物光合作用的关键酶主要集中于基质,而基粒含有大部分的叶绿素。显然这些形态结构的改变最终会影响植物叶片的光合能力。
由次生代谢产生的一类细胞生命活动或植物生长发育非必需的小分子有机化合物,被称为植物次生代谢产物。而一般次生代谢产物很有可能是药用植物的重要药用成分[14-15]。药用植物三七(Panax notoginseng)主要药效成分皂苷均属于萜类次生代谢物。关于三七的次生代谢物研究,主要在分类、药效、药理及在植物中的分布位置、代谢途径和过程等方面[16],而关于次生代谢产物积累对不同光环境响应特征的研究则相对较少。光照强度对植物生长发育有重要作用,同时也是影响植物体内次生代谢产物合成与积累的重要因素[17]。
三七是一种典型的喜荫药用植物[18],种植在相对荫蔽的环境中,不同光照强度对三七的生长发育的影响不同。左端阳等[19]的研究表明,在透光率为5.10%~46.5%荫棚中生长的二年生三七,随着光强降低,净光合作用增强,说明适度遮荫可增大三七的碳获得;匡双便等[20]的研究表明,透光率为11.8%时最有利于一年生和二年生三七根系的生长。本文在前期研究工作的基础上,设置系列更为合理的生长环境透光率梯度,重点探究二年生三七在不同透光率荫棚下的生长特征、解剖结构、干物质积累和分配及皂苷积累特征,以期筛选到二年生三七生长的最适光照强度,为三七种植科学设定光照强度提供依据。
1 材料和方法 1.1 试验地概况试验地位于云南省文山州砚山县苗乡三七实业有限公司三七科技示范园(104°32′ E,23° 53′ N)。砚山县在我国云南省东南部,年均温为16.1℃,最冷月平均温度为9℃,最热月的平均温度为21℃。年降雨量在1 008 mm,≥10℃的年积温为5 000℃,冬无严寒,夏无酷暑,作为三七的主要传统和道地产区,非常适合三七的种植。土壤pH值为6.95, 土壤全氮、全磷和全钾含量分别为61.28、1.69和10.38 g kg–1, 水解氮、有效磷和有效钾含量分别为131.56、17.06和1 210.00 mg kg–1。
1.2 试验设计选用三七生产过程中的专用遮阳网搭建荫棚, 透光率通过调整3种遮荫网的层数来调节。每个荫棚长4 m,宽4 m,高2 m。在晴天中午12:00-14:00使用Li-190R量子传感器和Li-1500光量子记录仪(Li-Cor, USA)测量荫棚内光照强度。同一时间内, 荫棚内外的光强之比即为透光率,棚内以不同地方测量的透光率平均值为荫棚的透光率。本试验搭建的6个荫棚透光率分别为34.3%、17.8%、13.5%、9.2%、6.3%和2.3%,以2.3%的透光率代表低光照水平,34.3%的透光率代表高光照水平。
1.3 材料试验材料三七(Panax notoginseng),土壤为当地生土(红壤),2016年1月选取生长健壮且均匀一致的三七种苗,移置到不同透光率的荫棚中,种植管理措施参考匡双便[20]的方法。
1.4 方法形态指标的测量 2017年12月从不同透光率荫棚中采集二年生三七植株带回实验室。取样时,刨开基质,连根部整株取出,用水洗净,每个处理选12~15株。参考匡双便[20]的方法,测量块根直径(mm)、根系体积(mL)、株高(cm)、冠幅(cm)、主根长(cm)、块根长(cm)、总根长(cm)、小叶长和宽(cm)。三七的叶片近似椭圆形,利用椭圆公式计算叶面积(cm2),并统计单株总叶面积(cm2)。
生物量及分配的测量 将三七的根、茎、叶在烘箱105℃杀青1 h后,烘干(60℃)到恒重,分别称量须根、块根、根、茎和叶的生物量(g),计算根重比、茎重比、叶重比和根冠比。
叶片解剖结构的观察 参考王灶安[21]的方法制作石蜡切片和观察叶片解剖结构。用FAA固定液固定叶片12 h以上,用梯度酒精脱水、透明、浸蜡、包埋,切片机切片(厚度10 μm),苏木精染色,随后用中性树胶封固制成永久切片。在10×10和40×10光学显微镜(DM2500, LEICA, Germany)下观察测量叶片、上表皮、下表皮、栅栏组织和海绵组织厚度,并拍照。
1.5 皂苷含量的测定标准品的制备 精确称取三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd标准品适量,用甲醇溶解并定容于10 mL容量瓶中, 摇匀,制得标准品溶液,浓度分别为0.454、0.355、0.462、0.466、0.449 mg mL–1,4℃保存,备用。
供试品溶液制备 参考《中国药典》[22]中的方法。精确称取三七块根样品0.6 g (过40目), 置于具塞锥形瓶中,加入甲醇30 mL,称取重量,浸泡30 min,超声处理(功率180 W,频率40 kHz), 用甲醇定容至刻度,摇匀,静置30 min;放冷再称取重量,用甲醇补足减少的重量,摇匀, 过滤,取过滤液作为供试品溶液。
对照品制备 精确称取三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd对照品适量,用甲醇定容到10 mL,摇匀,终浓度分别为0.454、0.355、0.462、0.466、0.449 mg mL–1的混合对照品溶液,于4℃保存,待用。
色谱条件 色谱柱Agilent ZORBAX SB-C18 (250 mm×4.6 mm, 5 μm),流动相为乙腈(A)-水(B), 梯度洗脱(0~22 min,20% A,22~47 min,20%~46% A,47~57 min,46%~55% A,57~62 min, 55% A, 62~63 min,55%~20% A,63~69 min,20% A), 流速1.5 mL min–1,检测波长203 nm,柱温30℃。
样品皂苷含量测定 进样体积10 μL,按照药典要求理论塔板数不低于5 000,分离度达到要求,采用外标法,分别计算三七皂苷R1、人参皂苷Re、人参皂苷Rg1、人参皂苷Rd和人参皂苷Rb1的含量。
1.6 数据统计和分析用Excell 2003和SPSS 14.0软件对数据进行统计分析和作图;采用单因素方差(One-way ANOVA)分析比较不同透光率下三七农艺性状、生物量积累及皂苷含量等的差异。采用Duncan多重比较法进行差异显著性分析,以P≤0.01表示差异极显著, P≤0.05表示差异显著。
2 结果和分析 2.1 生长特征和叶片解剖结构的响应不同光强对三七的生长特征影响较大(表 1)。透光率为6.3%和2.3%时,三七的株高、冠幅和复叶柄长最大;透光率为34.3%时,茎粗和叶基径最大;比叶面积在透光率为2.3%时最大,并随光照强度的增加而减小;叶面积比和总叶面积都以6.3%透光率最大,34.3%透光率最小,且差异显著。透光率为34.3%时,块根直径最大;主根长在透光率为17.8%和2.3%时较大;根体积在透光率为13.5%时最大, 显著大于6.3%和2.3%透光率的;须根数则在透光率为9.2%时最多;总根长在透光率为17.8%和9.2%时较大,显著大于6.3%和2.3%透光率的。
| 表 1 不同透光率对三七形态特征的影响 Table 1 Effect of transmittance on the morphology of Panax notoginseng |
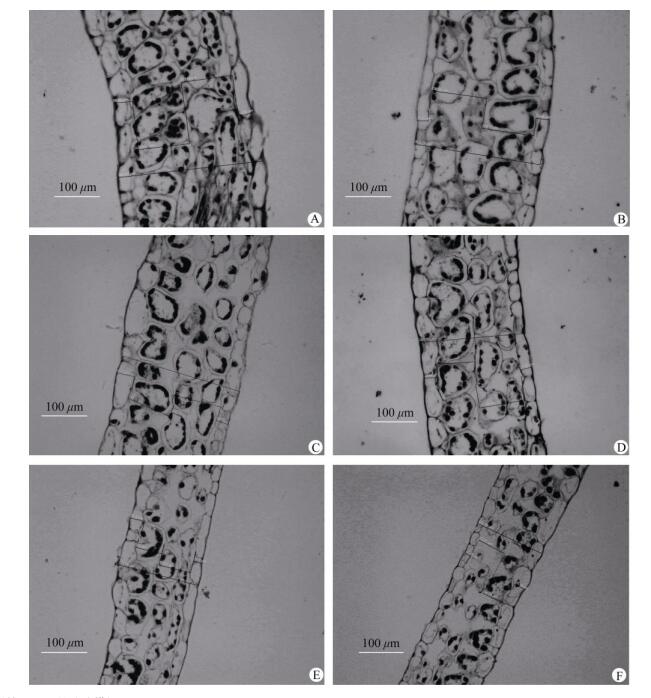
不同光照强度对三七叶片解剖结构的影响很大(表 2,图 1)。上表皮厚度在中等透光率13.5%最大,与透光率34.3%的值差异不显著;在透光率为34.3%时,下表皮厚度、栅栏组织厚度和海绵组织厚度具有最大值,且总体趋势是随着光照强度的减小而减小(除了9.2%处理下的栅栏组织厚度),2.3%的条件下具有最小值。
| 表 2 不同透光率对三七叶片解剖结构的影响 Table 2 Effects of transmittance on leaf anatomy of Panax notoginseng |
|
图 1 光学显微镜下三七的叶片横切面。 A: 34.3%; B: 17.8%; C: 13.5%; D: 9.2%; E: 6.3%; F: 2.3%。 Fig. 1 Transection of Panax notoginseng leaf under light microscopy. A: 34.3%; B: 17.8%; C: 13.5%; D: 9.2%; E: 6.3%; F: 2.3%. |
从表 3可见,不同光照强度对三七生物量积累和分配的影响显著。透光率为17.8%时,须根生物量最大;剪口生物量、主根生物量和根生物量在透光率13.5%时最大,地下部分以中等透光率时最大,且显著高于低透光率的。叶生物量在13.5%透光率时最大。34.3%、17.8%、13.5%和9.2%透光率的根重比差异均不显著,但显著大于6.3%和2.3%透光率的,其中34.3%和13.5%透光率的根重较大;茎重比、根冠比和叶重比则以低光照下(6.3%和2.3%透光率)的较大。
| 表 3 不同透光率对三七生物量和生物量分配的影响 Table 3 Effects of transmittance on biomass and biomas allocationof Panax notoginseng |
不同光照强度对三七皂苷组分含量有显著影响(表 4)。在透光率为9.2%时,除人参皂苷Rb1, 其他几种皂苷及总皂苷含量最高,与透光率为2.3%的差异显著;人参皂苷Rb1 (%)和人参皂苷Rb1含量在透光率为17.8%时最大,且显著高于透光率为6.3%和2.3%的;总皂苷(%)在透光率为9.2%时最大,且显著高于透光率为34.3%、13.5%、6.3%和2.3%的, 总皂苷单株含量在透光率为13.5%和17.8%时较大,且显著高于透光率为6.3%和2.3%的。
| 表 4 不同透光率对三七根皂苷含量的影响 Table 4 Effects of transmittance on saponins content in Panax notoginseng roots |
光照强度对三七的生长发育及生物量的影响显著。在光照不足时,植物通过增加株高和叶片光合面积,以捕获更多光能[23]。万小燕等[24]的研究表明,在遮荫条件下凉粉草(Mesona chinensis)株高、节长、叶柄长都变长,水田七(Schizocapsa planta-ginea)和牛耳枫(Daphniphyllum calycinum)的株高和叶柄变长。卢安萨等[25]的研究表明,适当遮光明显促进火炭母(Polygonum chinense)生物量的增加。本研究结果表明,三七的株高和主根长在最小透光率2.3%时最大,茎粗、叶基径和块根直径在最高透光率34.3%时最大,冠幅、分枝数、块根长、复叶柄长、根系体积、总根长和总叶面积都是在中等透光率下最大。本研究结果还表明,二年生三七在低光下,植株向高空伸展以增加株高;低光严重限制了块根直径的增加,并且限制其叶面积、复叶柄长等形态指标的增长,因此,三七虽是喜荫植物,但过低的光照强度不利于三七的生长[19]。
比叶面积的大小与光照强度关系密切。一般情况下,长期生活在高光照下的植株叶面积相对较小,单位面积积累的生物量较多,比叶面积(SLA)相对较小,生活在低光照下的则反之。薛建平等[26]报道,遮荫后喜荫药用植物半夏(Pinellia ternata)的SLA增加。汪越等[27]对药用植物紫背天葵(Begonia fimbristipula)的研究表明,高光下叶片SLA显著减小,低光下叶片增加叶面积,从而增大自身的光接收面积。本研究结果表明,三七SLA在最小透光率2.3%时最大,在最大透光率34.3%时最小,随着光照强度的增加而减小。SLA与光捕获效率密切相关, 因此,在低光照环境下二年生三七通过增加SLA提高叶片光能捕获能力,在高光照下利用更多的生物量构建保卫细胞或者是增加叶肉细胞的密度,使叶片增厚,进而增加叶片的光合能力和碳固定。通过增加SLA也是三七的一种对低光的适应策略。
叶片组织结构对环境改变发生响应,叶片作为对环境因子改变最敏感的营养器官,也是生长中最重要的生理功能——光合作用发生的场所。当植物生长的环境发生变化时,叶片通常以改变形态结构来适应。在弱光照环境下,光合色素被光氧化伤害几率很小,叶绿体中的基粒增大,基粒片层垛叠厚度增高,从而增加捕光色素蛋白的数量[28]。毛立彦等[5]的研究表明曼陀罗叶片、海绵组织和栅栏组织厚度均随着光照强度的增强而增加;吴涛等[29]的研究表明,随着生境光强增强,爬山虎(Parthenocissus tricuspidata)的叶片、上表皮和栅栏组织厚度,以及栅栏组织细胞面积都增加,栅栏组织细胞长度、周长和下表皮厚度呈显著上升趋势;汪越等[27]报道紫背天葵在低光环境中,叶片通过降低上表皮和叶片厚度,以便于光照穿过叶片表皮到叶肉组织,从而增加叶片的光能捕获能力。吕晋慧等[30]报道,随着光照强度的减弱,金莲花(Trollius chinensis)的栅栏组织和海绵组织细胞间隙增大。本研究结果表明, 三七叶片的上表皮、海绵组织、栅栏组织和叶片厚度都以透光率为34.3%时达到最大,这样的叶片结构有利于植物在高光下减少光捕获,因为厚的上表皮和海绵组织可以有效地减弱到达叶绿体的光能, 在透光率为2.3%时最小;其中海绵组织、栅栏组织和叶片厚度几乎均呈现出随透光率的降低而减小, 这与左端阳[19]等的结果一致。这说明三七叶片为了适应高光照环境,通过增加上表皮、海绵组织、栅栏组织和叶片厚度来减少光捕获。
光照在植物生长发育中有重要作用,同时也是影响植物体内次生代谢产物合成与积累的重要因素。从影响机制来看,光合反应产物是参与次生代谢的必需前体物质,光照对植物皂苷生物合成的影响可能与光合反应产物积累及在两个代谢途径中的分配有一定联系[31]。有研究表明,光强是影响药用作物虎杖(Polygonum cuspidatum)合成白藜芦醇的关键因素[32];北细辛(Asarum heterotropoides)挥发油含量也和光照强度显著相关[33]。不同植物形成次生代谢物的最适光强不尽相同,本研究结果表明, 三七次生代谢产物总皂苷含量以透光率为9.2%时最高,单株皂苷含量则以透光率为17.8%时最高(表 5),说明在透光率为9.2%~17.8%时皂苷积累量最大。
综上所述,三七是一种典型的喜荫药用植物, 在生长过程中必须进行适当遮荫。当光照强度减弱时,三七株高、复叶柄长、冠幅叶面积和比叶面积增加,上表皮、栅栏组织、海绵组织和叶片厚度降低,分配更多的生物量到茎部和叶片部分,以便三七能捕获更多光能。同时,二年生三七生长的最佳透光率为9.2%~13.5%,最适宜地下部分生物量及皂苷的积累。
| [1] | de SIMONE S, OKA Y, INOUE Y. Effect of light on root hair formation in Arabidopsis thaliana phytochrome-deficient mutants[J]. J Plant Res, 2000, 113(1): 63-69. DOI:10.1007/PL00013917 |
| [2] | WAHL S, RYSER P, EDWARDS P J. Phenotypic plasticity of grass root anatomy in response to light intensity and nutrient supply[J]. Ann Bot, 2001, 88(6): 1071-1078. DOI:10.1006/anbo.2001.1551 |
| [3] | NAGEL K A, SCHURR U, WALTER A. Dynamics of root growth stimulation in Nicotiana tabacum in increasing light intensity[J]. Plant Cell Environ, 2006, 29(10): 1936-1945. DOI:10.1111/j.1365-3040.2006.01569.x |
| [4] | VALLADARES F, WRIGHT S J, LASSO E, et al. Plastic phenotypic response to light of 16 congeneric shrubs rom a Panamanian rainforest[J]. Ecology, 2000, 81(7): 1925-1936. DOI:10.1890/0012-9658(2000)081[1925:PPRTLO]2.0.CO;2 |
| [5] |
MAO L Y. Effect of light intensity and temperature on Datura stramonium Linn. [D]. Yangling: Northwest Agricultural & Forestry University, 2012.
毛立彦. 光照强度及温度对曼陀罗生长的影响[D]. 杨凌: 西北农林科技大学, 2012. |
| [6] |
WU C M, LI Y X, QUAN Q M, et al. Relationship between fruit maturity and habitats of Epimedium brevicornum[J].
Chin J Appl Environ Biol, 2008(2): 187-191. 吴春梅, 黎云祥, 权秋梅, 等. 淫羊藿果实成熟与生境的关系[J]. 应用与环境生物学报, 2008(2): 187-191. DOI:10.3321/j.issn:1006-687X.2008.02.008 |
| [7] | SKILLMAN J B, GARCIA M, VIRGO A, et al. Growth irradiance effects on photosynthesis and growth in two co-occurring shade-tolerant neotropical perennials of contrasting photosynthetic pathways[J]. Amer J Bot, 2005, 92(11): 1811-1819. DOI:10.3732/ajb.92.11.1811 |
| [8] | LEE D W, OBERBAUER S F, JOHNSON P, et al. Effects of irradiance and spectral quality on leaf structure and function in seedlings of two southeast Asian Hopea (Dipterocarpaceae) species[J]. Amer J Bot, 2000, 87(4): 447-455. DOI:10.2307/2656588 |
| [9] | HANBA Y T, KOGAMI H, TERASHIMA I. The effect of growth irradiance on leaf anatomy and photosynthesis in Acer species differing in light demand[J]. Plant Cell Environ, 2002, 25(8): 1021-1030. DOI:10.1046/j.1365-3040.2002.00881.x |
| [10] | OGUCHI R, HIKOSAKA K, HIROSE T. Leaf anatomy as a constraint for photosynthetic acclimation:differential responses in leaf anatomy to increasing growth irradiance among three deciduous trees[J]. Plant Cell Environ, 2005, 28(7): 916-927. DOI:10.1111/j.1365-3040.2005.01344.x |
| [11] | MARKESTEIJN L, POORTER L, BONGERS F. Light-dependent leaf trait variation in 43 tropical dry forest tree species[J]. Amer J Bot, 2007, 94(4): 515-525. DOI:10.3732/ajb.94.4.515 |
| [12] | OSADA N, ONODA Y, HIKOSAKA K. Effects of atmospheric CO2 concentration, irradiance, and soil nitrogen availability on leaf photo-synthetic traits of Polygonum sachalinense around natural CO2 springs in northern Japan[J]. Oecologia, 2010, 164(1): 41-52. DOI:10.1007/s00442-010-1635-z |
| [13] | EVANS J R, POORTER H. Photosynthetic acclimation of plants to growth irradiance:The relative importance of specific leaf area and nitrogen partitioning in maximizing carbon gain[J]. Plant Cell Environ, 2001, 24(8): 755-767. DOI:10.1046/j.1365-3040.2001.00724.x |
| [14] |
HUANG L Q, GUO L P. Secondary metabolites accumulating and geoherbs formation under enviromental stress[J].
China J Chin Mat Med, 2007, 32(4): 277-280. 黄璐琦, 郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成[J]. 中国中药杂志, 2007, 32(4): 277-280. DOI:10.3321/j.issn:1001-5302.2007.04.001 |
| [15] |
WANG D, WANG Z Y, WANG Z Q, et al. Brief on the progress of productive ways of the secondary metabolites in medicinal plants[J].
Inf Trad Chin Med, 2008, 25(1): 29-32, 82. 王丹, 王振月, 王宗权, 等. 药用植物次生代谢产物生产途径的研究概述[J]. 中医药信息, 2008, 25(1): 29-32, 82. DOI:10.3969/j.issn.1002-2406.2008.01.012 |
| [16] |
HUANG L Q, CHEN M L, XIAO P G. The study of Chinese medicinal materials authentic modern biological basis and model hypothesis[J].
China J Chin Mat Med, 2004, 29(6): 494-496. 黄璐琦, 陈美兰, 肖培根. 中药材道地性研究的现代生物学基础及模式假说[J]. 中国中药杂志, 2004, 29(6): 494-496. DOI:10.3321/j.issn:1001-5302.2004.06.001 |
| [17] | SZAKIEL A, PĄCZKOWSKI C, HENRY M. Influence of environ-mental abiotic factors on the content of saponins in plants[J]. Phyto-chem Rev, 2011, 10(4): 471-491. DOI:10.1007/s11101-010-9177-x |
| [18] |
GUO Q S.
Medicinal Plant Cultivation[M]. Beijing: Higher Education Press, 2004.
郭巧生. 药用植物栽培学[M]. 北京: 高等教育出版社, 2004. |
| [19] |
ZUO D Y, KUANG S B, ZHANG G H, et al. Eco-physiological adaptation of Panax notoginseng to different light intensity[J].
J Yunnan Agric Univ, 2014, 29(4): 521-527. 左端阳, 匡双便, 张广辉, 等. 三七(Panax notoginseng)对不同光照强度的生理生态适应性研究[J]. 云南农业大学学报(自然科学), 2014, 29(4): 521-527. DOI:10.3969/j.issn.1004-390X(n).2014.04.010 |
| [20] |
KUANG S B, XU X Z, MENG Z G, et al. Effects of light transmittance on plant growth and root ginsenoside content of Panax notoginseng[J].
China J Appl Environ Biol, 2015, 21(2): 279-286. 匡双便, 徐祥增, 孟珍贵, 等. 不同透光率对三七生长特征及根皂苷含量的影响[J]. 应用与环境生物学报, 2015, 21(2): 279-286. DOI:10.3724/SP.J.1145.2014.08002 |
| [21] |
WANG Z A.
Plant Microscopy Techniques[M]. Beijing: Agricultural Press, 1992.
王灶安. 植物显微技术[M]. 北京: 农业出版社, 1992. |
| [22] |
Chinese Pharmacopoeia Commission.
The Chinese Pharmacopoeia, Vol.1[M]. Beijing: China Medical Science and Technology Press, 2015.
国家药典委员会. 中国药典, 一部[M]. 北京: 中国医药科技出版社, 2015. |
| [23] |
KUNG S B, ZHANG G H, CHEN Z J, et al. Change in morphological and growth indexes of Panax notoginseng seedling under different light conditions[J].
J Plant Resour Environ, 2014, 23(2): 54-59. 匡双便, 张广辉, 陈中坚, 等. 不同光照条件下三七幼苗形态及生长指标的变化[J]. 植物资源与环境学报, 2014, 23(2): 54-59. DOI:10.3969/j.issn.1674-7895.2014.02.08 |
| [24] |
WAN X Y. Effects of shading treatment on the growth and photo-synthesis characteristics in several medicinal plants[D]. Nanning: Guangxi University, 2014.
万小燕. 遮阴处理对几种药用植物生长和光合特性的影响[D]. 南宁: 广西大学, 2014. |
| [25] |
LU A S. Light adaptation and its medicinal composition of Chinese knotweed (Polygonum chinense)[D]. Nanning: Guangxi University, 2015.
卢安萨. 药用植物火炭母(Polygonum chinense)的光适应及其药用成分分析研究[D]. 南宁: 广西大学, 2015. |
| [26] |
XUE J P, WANG X, ZHANG A M, et al. Effects of shading on photo-synthetic characteristics of Pinellia ternata leaves[J].
China J Chin Mat Med, 2008, 33(24): 2896-2900. 薛建平, 王兴, 张爱民, 等. 遮荫对半夏光合特性的影响[J]. 中国中药杂志, 2008, 33(24): 2896-2900. DOI:10.3321/j.issn:1001-5302.2008.24.006 |
| [27] |
WANG Y, LIU N, REN H, et al. Responses of leaf morphological and physiological characteristics of Begonia fimbristipula Hance to light intensity[J].
Ecol Environ Sci, 2015, 24(6): 957-964. 汪越, 刘楠, 任海, 等. 紫背天葵(Begonia fimbristipula Hance)叶片形态和生理生态特征对不同光强的响应[J]. 生态环境学报, 2015, 24(6): 957-964. DOI:10.16258/j.cnki.1674-5906.2015.06.008 |
| [28] |
LI Z, XIE S Q, XU W G, et al. Steady-state and dynamic photo-synthetic performance in the shade-demanding plant Amorphophallus xiei under different levels of growth irradiance[J].
Guihaia, 2016, 36(5): 529-538. 李珍, 谢世清, 徐文果, 等. 不同光照条件下喜阴植物谢君魔芋对稳态和动态光源的响应特征[J]. 广西植物, 2016, 36(5): 529-538. DOI:10.11931/guihaia.gxzw201412012 |
| [29] |
WU T, GENG Y F, CHAI Y, et al. Response of leaf anatomical structure and photosynthesis characteristics of Parthenocissus himala-yana to three habitat types[J].
Ecol Environ Sci, 2014, 23(10): 1586-1592. 吴涛, 耿云芬, 柴勇, 等. 三叶爬山虎叶片解剖结构和光合生理特性对3种生境的响应[J]. 生态环境学报, 2014, 23(10): 1586-1592. DOI:10.3969/j.issn.1674-5906.2014.10.004 |
| [30] |
LÜ J H, WANG X, FENG Y M, et al. Effects of shading on the photosynthetic characteristics and anatomical structure of Trollius chinensis Bunge[J].
Acta Ecol Sin, 2012, 32(19): 6033-6043. 吕晋慧, 王玄, 冯雁梦, 等. 遮荫对金莲花光合特性和叶片解剖特征的影响[J]. 生态学报, 2012, 32(19): 6033-6043. DOI:10.5846/stxb201109101327 |
| [31] |
JIAO X L, GAO W W. Advances in studies on influence of environ-mental factors on triterpenoid saponin synthesis in medicinal plants[J].
Chin Trad Herb Drugs, 2011, 42(2): 398-402. 焦晓林, 高微微. 环境因子对药用植物三萜皂苷合成影响的研究进展[J]. 中草药, 2011, 42(2): 398-402. |
| [32] |
WEN T, LIANG L, ZENG Y, et al. Effect of different light intensity on Polygonum cuspidatum callus[J].
China J Chin Mat Med, 2007, 32(13): 1277-1280. 文涛, 梁莉, 曾杨, 等. 不同光照强度对虎杖愈伤组织的影响[J]. 中国中药杂志, 2007, 32(13): 1277-1280. DOI:10.3321/j.issn:1001-5302.2007.13.006 |
| [33] |
WANG Z Q, ZHENG P H, PANG S F, et al. Effect of light intensity on growth and quality of Asarum heterotropoides var.mandshuricum[J].
China J Chin Mat Med, 2011, 36(12): 1558-1567. 王志清, 郑培和, 逄世峰, 等. 光照强度对北细辛生长发育及质量的影响[J]. 中国中药杂志, 2011, 36(12): 1558-1567. DOI:10.4268/cjcmm20111203 |
 2018, Vol. 26
2018, Vol. 26



