光对植物十分重要,它不仅是植物进行光合作用的能量基础,而且还影响植物的生长和发育[1-2]。但光强超过植物本身所能利用的量时就会对光合机构产生潜在的危害[3]。在南亚热带地区,夏季一般是处于普遍高光状态, 在高光环境下,当植物光合器官吸收的光能超过其进行光合作用所需能量时就会发生光能过剩。不能及时耗散的过剩光能会诱导活性氧的生成,从而对光合系统造成光抑制或者光破坏[4],因此植物需要采取一些必要的措施来避免光能过剩对光合机构造成伤害。由于植物幼叶叶绿体还没发育成熟,光合系统还未完善,所以相对而言更容易发生光抑制[5],因此为了避免光合器官受到过剩光能的伤害,植物在长期的进化过程中形成了不同的保护策略,如幼叶叶柄角度变化[6]、叶片移动、叶绿体移动[3]、花色素苷的光能屏蔽[7-9]、热耗散[10]和光呼吸作用[11]等。
光还是推动植物群落演替和进化的重要驱动力[12-13]。南亚热带森林群落在自然状况下是遵循一定客观规律趋向更优化的气候顶级群落演替的[14]。其中季风常绿阔叶林属热带和亚热带的过渡类型, 是南亚热带具代表性的典型的地带性植被[15-18]。在光因子的驱动下,以阳生性树种为优势种的常绿阔叶林逐渐被以中生性树种为优势种的常绿阔叶林所取代,这是南亚热带常绿阔叶林最主要的群落动态变化形式之一。中生性树种的耐阴能力强,在林下弱光环境中也能正常生长,与之相比,阳生性树种耐高光但不耐阴,在林下弱光环境中不能正常生长也不能维持种群的更新。在竞争过程中往往中生性树种在群落处于优势地位。随着演替的进行,植物的光合能力呈现逐渐下降的趋势[13]。与阳生性树种相比较,中生性树种它具有较低的光合速率、暗呼吸速率和较高的表观量子效率[13, 19],也许正是因为中生性树种具有这些光合特性,才增强了其幼苗利用森林中林下弱光的能力,提高了它们的种间竞争力。然而中生性树种幼苗的长大成熟成为林冠层植物后,就会直接暴露在高光环境下。理论上在高光的环境下,中生性树种因为光合能力弱,对光的利用效率低,更容易受到光抑制的影响。实际上中生性树种在高光的环境下并没有出现光抑制现象, 因为它采取了各种灵活的光保护策略来应对长时间暴露在高光的环境中,从而对光合机构进行有效保护,如叶片移动、提高植物叶片的热耗散[13]、提高植物幼叶的花色素苷的含量[20],其中幼叶积累花色素苷是植物最常见的一种保护措施[21-22]。相比较而言中生性树种植物成熟叶的不同生理生化特性对光能力和光保护机制已经被广泛研究[14, 23],而对幼叶光保护的研究却很少。
本文以鼎湖山南亚热带常绿阔叶林为研究对象,分别选取了3种演替中期代表性阳生优势树种和3种演替后期代表性中生优势树种进行盆栽控制试验,通过测定多种生理生化指标来探究阳生树种和中生树种的幼叶和成熟叶光保护特性的差异,从而初步揭示夏季南亚热带森林演替中后期优势种幼叶的光保护机制,为南亚热带森林群落演替机制提供部分理论依据。
1 材料和方法 1.1 材料以鼎湖山南亚热带常绿阔叶林群落演替中后期具有代表性的阳生性和中生性优势种为材料,阳生性优势树种为木荷(Schima superba)、黧蒴(Castanopsis fissa)、锥栗(C. chinensis);中生性优势树种为华润楠(Machilus chinensis)、厚壳桂(Cryptocarya chinensis)、黄果厚壳桂(C. concinna)。每种20棵树苗(株高1 m左右)从鼎湖山森林采挖回来后,以盆栽方式栽种于华南师范大学生命科学院楼顶试验基地,设置2个生长光强,自然全光照模拟林冠层光强,30%全光照由两层黑色尼龙遮阳网获得,模拟了亚热带森林的林下环境,30%全光照相对辐照度(%)根据Zhu等[24]的方法估计。常规管理,定期浇水、拔草和施肥。2年后测量6树种幼叶和成熟叶的花色素苷含量、总酚及类黄酮含量、总抗氧化能力、叶绿素含量及高光胁迫后叶绿素荧光的恢复。
1.2 花色素苷含量的测定用打孔器取5个8 mm叶圆片,再加入4 mL 1%盐酸-甲醇溶液,将其放入4℃冰箱充分浸泡24 h, 每个样品设置5个重复。测量前在提取液中加入4 mL的氯仿和2 mL的纯水,充分混匀后,叶绿素溶于下层氯仿相,花色素苷溶于上层甲醇-水相。取上层甲醇-水相溶液,然后用UV2450型分光光度计(Shimadzu, Tokyo, Japan)在530 nm处测定吸光值。利用矢车菊素-3-O-葡萄糖苷作标准曲线,计算花色素苷含量。
1.3 类黄酮和总酚含量的测定用打孔器钻取2个8 mm的叶圆片,加入3 mL 95%甲醇中,放入4℃冰箱过夜,每个样品设置5个重复。
类黄酮含量测定参照Heimler[25]的方法,作细微修改。取0.5 mL10倍稀释后的样液,然后依次添加0.2 mL 5% NaNO2、0.3 mL现配的10% AlCl3和1 mL 1 mol L-1 NaOH,用去离子水定容至3.5 mL, 将所有溶液混匀后静置10 min,最后在波长510 nm处测定吸光值。用浓度范围为25~1 000 μmol L-1的儿茶素建立标准曲线,计算样品中总类黄酮的含量。
总酚含量的测定参照Ainsworth[26]的方法,使用福林酚试剂测定。取0.5 mL提取样液,先加入1 mL 10%福林酚试剂充分摇匀后,再加入2 mL 0.7 mmol L-1 Na2CO3,混匀后室温静置显色,在波长765 nm处测定吸光值变化。用浓度范围为50~ 250 μmol L-1的没食子酸做标准曲线,计算样品中总酚的含量。
1.4 总抗氧化能力的测定抗氧化物质按类黄体酮和总酚的提取方法。参照彭长连等[27]的方法并适当修改,用DPPH自由基(1, 1-二苯基-2-三硝基苯肼, 1, 1-diphenyl-2-picrylhy- drazyl)的清除反应来测定样品的总抗氧化能力(total antioxidant capacity, TAC)。用95%甲醇配制100 μmol L-1的DPPH溶液,现配现用。取10 μL提取液加入3 mL DPPH溶液充分混匀,在室温下静置5 min,用95%的甲醇做空白对照,在517 nm处测定吸光度。用DPPH溶液梯度稀释(10~100 μmol L-1)建立标准曲线,计算样品清除DPPH的能力。不同叶片的总抗氧化能力用单位叶面积清除DPPH的nmol数表示。
1.5 类胡萝卜素含量的测定用打孔器钻取2个8 mm叶圆片,放入10 mL塑料离心管中,添加少量的液氮用金属棒捣碎成粉末,然后加入4 mL 80%丙酮在4℃冰箱中浸提过夜,实验重复5次。提取液充分摇匀后,通过充分静置的方式获得澄清透明的上清液。轻轻吸取上清液在波长663、645和470 nm处测定吸光值变化,以80%的丙酮作为空白对照。参照Wellburn[28]的公式计算叶绿素a (Chl a)、叶绿素b (Chl b)、总叶绿素(Chl a+b)及类胡萝卜素(Car)的含量:Chl a (μg mL-1)= 12.21A663-2.81A646; Chl b (μg mL-1)=20.13A646- 5.03A663; Car (μg mL-1)=(1000A470-3.27Chl a-104 Chl b)/198。
1.6 高光胁迫后叶绿素荧光的恢复在不同生长光强下选取6种树的幼叶和成熟叶各5片,置于暗处让叶片充分暗适应,接着用1 800 μmol m-2s-1白色高光处理叶片40 min,温度为30℃,然后将叶片在低光10 μmol m-2s-1恢复2 h。处理过程中,用PAM 2100便携式荧光仪(Waltz, Germany)测定Fv/Fm的变化。在离体高光处理过程中,需将叶柄插在水中,防止叶片失水[8]。
1.7 数据分析所有数据以平均值(mean)±标准误(SE)表示。数据统计分析和多重比较采用SPSS 19.0软件完成。用Duncan多重比较法检验2个演替阶段植物叶片生理指标在不同光强下的差异显著性,显著性水平为0.05。数据作图由Sigmaplot 12.5软件完成。
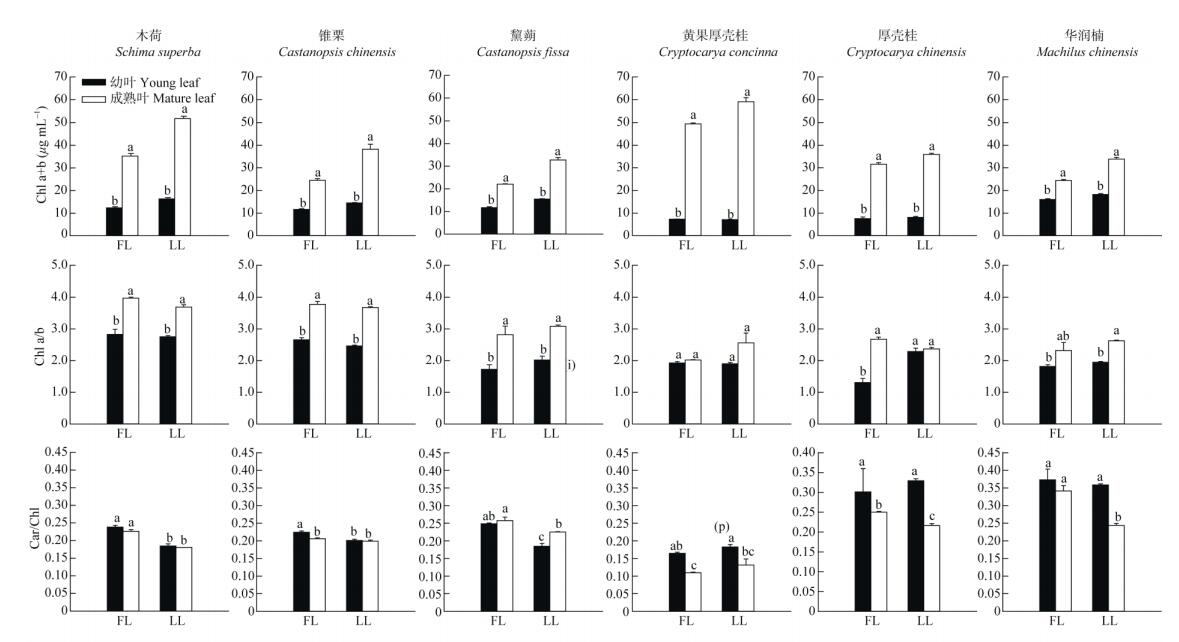
2 结果和分析 2.1 叶片表型和光合色素含量的变化演替中期与演替后期6种植物在不同光照强度下生长,叶片表型具有较明显的差异。同种植物在30%全光照下的成熟叶明显大于全光照下的,且叶片绿色更深(图 1)。30%全光照下6种植物成熟叶的叶绿素含量显著比全光照的高,幼叶虽然也高于全光照的,但没有达到显著差异,这与叶片表型变化吻合(图 2)。两个演替阶段不同树种幼叶的Chl a/b都低于成熟叶,且演替中期成熟叶的Chl a/b比演替后期的高。相反,两个演替阶段不同树种幼叶的Car/Chl都高于成熟叶。

|
图 1 全光照(FL)和30%全光照(LL)下优势树种幼叶和成熟叶的表型 Fig. 1 Young and mature leaf phenotypes of six tree species grown under 100% (FL) and 30% (LL) full light |
|
图 2 两种生长光强下叶片的Chl a+b、Chl a/b和Car/Chl的变化。FL:全光照; LL:30%全光照;柱子上不同字母表示显著差异(P < 0.05)。下图同。 Fig. 2 Changes in Chl a+b, Chl a/b, and Car/Chl in leaves under two light intensities. FL: 100% full sunlight; LL 30% full sunlight; different letters above column indicate significant differences at 0.05 level The same is following Figures. |
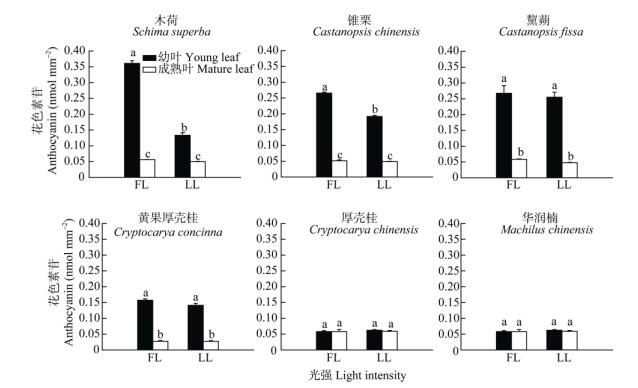
全光照下演替中期优势种木荷、锥栗和黧蒴的幼叶均表现出明显的变红现象(图 1),而叶片变红正是由于花色素苷的累积(图 3)。与全光照的相比,在30%全光照下木荷、锥栗和黧蒴叶片的花色素苷含量均降低,其中木荷和锥栗间有显著差异(P < 0.05),而黧蒴的差异不显著。演替后期优势树种无论是全光照还是30%全光照,除黄果厚壳桂外都没有出现明显的花色素苷积累,而且黄果厚壳桂叶片的花色素苷含量还低于演替中期优势树种。另外黄果厚壳桂在全光照下的花色素苷含量比30%全光照的高,这也与演替中期优势树种的一致。
|
图 3 两种生长光强下优势树种叶片花色素苷含量的变化 Fig. 3 Change in content of anthocyanins in leaves of dominant tree species under two light intensities |
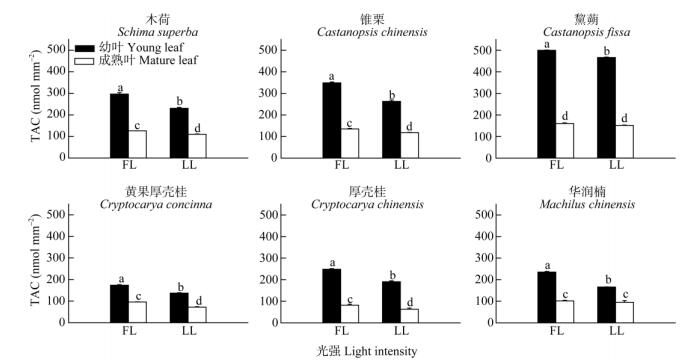
无论是演替中期还是演替后期优势树种幼叶的总抗氧化能力高于成熟叶,全光照下幼叶的总抗氧化能力高于30%全光照的(图 4)。演替中期优势树种幼叶的总抗氧化能力比演替后期的高,这与花色素苷含量的变化趋势(图 3)相似。演替中期阶段的黧蒴幼叶的总抗氧化能力比其他两种优势树种的高,锥栗次之,木荷最少。演替后期阶段各优势树种的总抗氧化能力差别不大。
|
图 4 两种生长光强下优势树种叶片的总抗氧化能力(TAC)变化 Fig. 4 Change in total antioxidant capacity (TAC) in leaves of dominant tree species under two light intensities |
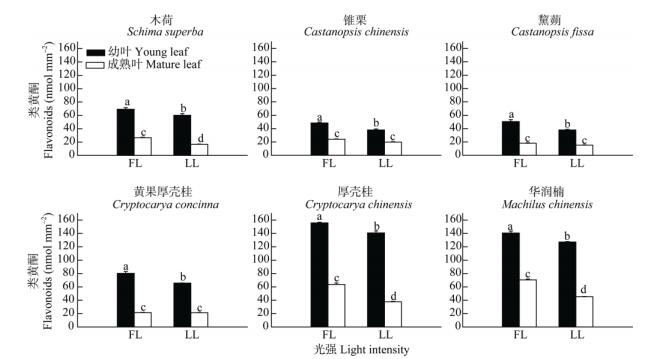
演替后期优势树种幼叶和成熟叶的类黄酮含量比演替中期优势树种的高1~2倍(图 5)。在两个演替阶段中,全光照下植物幼叶和成熟叶的类黄酮含量高于30%全光照的;幼叶的类黄酮含量远高于成熟叶。演替后期树种厚壳桂和华润楠的类黄酮比黄果厚壳桂的高,演替中期优势树种的类黄酮含量以木荷 > 黧蒴 > 锥栗。
|
图 5 两种生长光强下优势树种叶片的类黄酮含量的变化 Fig. 5 Change in flavonoids content in leaves of dominant tree species under two light intensities |
总体来说,幼叶的总酚含量往往高于成熟叶, 演替后期优势树种的幼叶总酚含量高于演替中期树种的(图 6)。演替中期阶段,黧蒴的总酚含量比其他两树种的高,锥栗次之,木荷最少。相同演替阶段全光照下无论是幼叶还是成熟叶的总酚含量均比30%全光照的高,其中锥栗、厚壳桂和华润楠在两种光照间达到显著性差异,而木荷、黧蒴、黄果厚壳桂的没有显著性差异。
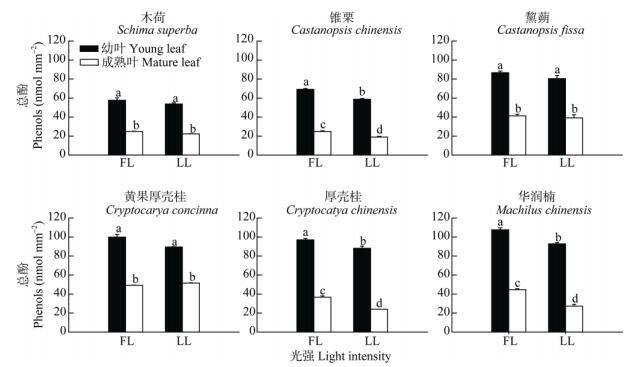
|
图 6 两种生长光强下优势树种叶片总酚含量的变化 Fig. 6 Change in phenols content in leaves of dominant tree species under two light intensities |
两个演替阶段优势树种在不同生长光强下生长,经高光处理后的低光恢复试验表明,成熟叶的最大光化学效率(Fv/Fm)比幼叶的高,经40 min的高光处理演替中期阶段树种成熟叶的Fv/Fm下降幅度比演替后期阶段树种的小,且幼叶也呈现相同规律。再经2 h的低光恢复,演替中期阶段树种幼叶的恢复能力比演替后期阶段树种的强(图 7, 8),且全光照下幼叶的恢复能力比30%全光照下的又快又强。经过2 h的恢复后,各优势树种幼叶和成熟叶Fv/Fm的变化趋于平缓。
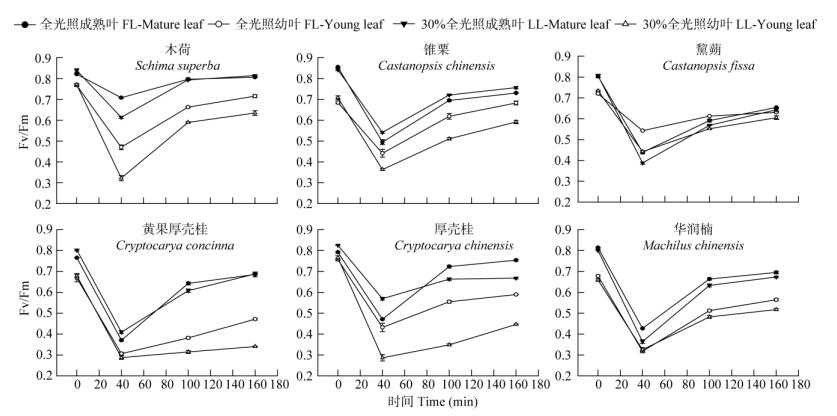
|
图 7 两种生长光强下优势树种叶片的最大光化学效率的变化 Fig. 7 Change in maximum photochemical efficiency (Fv/Fm) in leaves of dominant tree species under two light intensities |
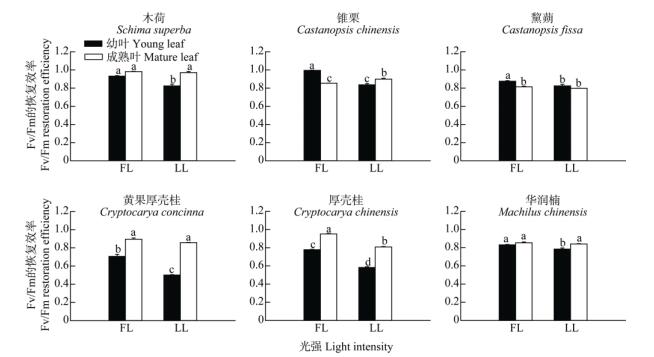
|
图 8 两种生长光强下优势树种叶片的Fv/Fm的恢复效率的变化 Fig. 8 Change in restoration efficiency of Fv/Fm in leaves of dominant tree species under two light intensities |
从图 9可见,幼叶的花色素苷含量与总抗氧化能力、类黄酮、总酚含量和Fv/Fm的恢复效率呈显著的线性相关关系。演替中期优势树种幼叶的花色素苷含量高、总抗氧化能力强和Fv/Fm的恢复效率高,而类黄酮含量低、总酚含量低;演替后期优势树种的花色素苷含量低、总抗氧化能力较弱和Fv/Fm的恢复效率低,而类黄酮含量高、总酚含量高。幼叶的花色素苷含量与总抗氧化能力和Fv/Fm的恢复效率呈显著的正相关关系(分别为P < 0.0001和P=0.0004),而与类黄酮和总酚含量呈显著的负相关关系(分别为P < 0.0001和P=0.0003)。
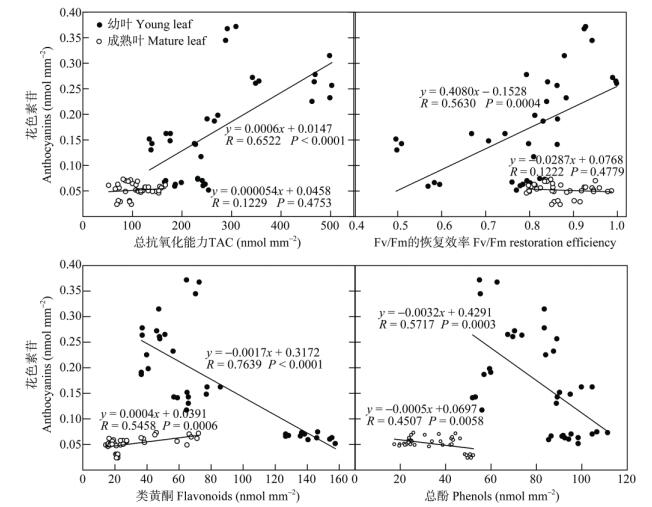
|
图 9 优势树种叶片的花色素苷含量与总抗氧化能力、Fv/Fm的恢复效率、类黄酮和总酚含量的相关性分析 Fig. 9 Relationship between anthocyanins content and total antioxidant capacity (TAC), Fv/Fm restoration efficiency, flavonoids and phenols contents in leaves of dominant tree species |
对不同生长光强下两个演替阶段优势树种幼叶和成熟叶花色素苷、类黄酮、总酚、DPPH•、Chl a+b、Chl a/b和Car/Chl等生理指标进行了主成分分析(图 10)。根据各指标的分布和贡献力, PC2可以解释为演替阶段,PC1可以解释为光合能力和光保护潜力。左图的4个区域分界明显, 演替中期阶段树种成熟叶指标、演替后期阶段树种成熟叶指标、演替中期阶段树种幼叶指标和演替后期阶段树种幼叶指标分别聚集在左上角、左下角、右上角和右下角。从右图可以看出,DPPH•、总酚、类黄酮含量在PC1的正极端有较大的载荷,花色素苷含量和Car/Chl在PC1的正极端有较小的载荷, 而Chl a+b在PC1负极端的载荷较大、Chl a/b的载荷较小。DPPH•在PC2正极端的载荷较大而Chl a/b、花色素苷、总酚含量载荷较小, 类黄酮含量在PC2负极端的载荷较大而Chl a+b、Car/Chl的载荷较小。

|
图 10 优势树种叶片生理指标的主成分分析及其对主成分的贡献能力 Fig. 10 Principal component analysis of physiological indexes and their contributions to its principal component in leaves of dominant tree species |
在南亚热带季风常绿阔叶林的群落演替过程中,演替中期优势种和演替后期优势种乔木在两种生长光强下,幼叶和成熟叶的光合色素、花色素苷、类黄酮和总酚含量、光合特征以及抗氧化能力不同,这些表现出植物为了避免发生光抑制,无论是幼叶还是成熟叶都有相应的策略来维持光能吸收和光能利用的平衡。30%全光照下的成熟叶面积明显大于全光照下的同种植物成熟叶,且成熟叶的叶绿素含量比全光照的高,这表明叶片可以通过改变叶绿素含量和增强自身的可塑性来适应不同的生长光强。演替中期优势种幼叶和成熟叶的光合能力都高于演替后期优势种[29-30],那么演替后期优势种在同样的光照下吸收过剩光能的潜在风险更大,因此更需要多种光保护方式来避免发生光能过剩的危害。
植物一般能够通过采取多种物理和生化的策略来防止过剩光能对光合器官的伤害。目前大部分的研究表明花色素苷保护植物光合器官主要是通过减少入射光,从而降低光合机构吸收过剩光能的风险[30-32]。但还有一些研究认为花色素苷既可过滤有害的辐射光,又能够清除植物体内的因光能过剩产生的活性氧自由基,因而在植物体内参与了物理防护以及生化防控[33]。在演替中期和后期优势树种幼叶中都有花色素苷的积累,但在夏季,演替中期树种的花色素苷含量明显比演替后期的高,且在高光下花色素苷的积累比低光下的多,同时花色素苷含量多的幼叶,其Fv/Fm的恢复效率更高(图 7, 8)。植物的总抗氧化能力与花色素苷含量的累积趋势十分相似,呈显著的正相关关系(图 9),说明花色素苷的积累在一定程度上可以提高幼叶的抗氧化能力,因此在高光下幼叶花色素苷的积累是一种重要的光抑制防护方式。虽然演替后期优势种叶片的花色素苷含量较少但其他的抗氧化物质(类黄酮、总酚)含量多(图 9),因此后期优势种是通过类黄酮和总酚的积累来提高幼叶的抗氧化能力。除了花色素苷外,类胡萝卜素(Car)、类黄酮、总酚和光呼吸都是植物普遍用于避免产生光抑制的重要生化策略,对植物光合器官起重要的光保护作用[3, 11, 34]。在不同演替阶段和不同光强下,演替后期优势种的幼叶和成熟叶具有较高的Car/Chl (图 2),说明在演替后期阶段的树种具有较强的热耗散潜能,为幼叶能够适应高光环境提供了保障。
许多胁迫因子都能够诱导植物叶片合成花色素苷,其中光是必不可少的条件之一[35-36]。有研究表明,花色素苷的积累与光照强度呈正相关关系[29, 37]。演替中期和演替后期优势种在经过1 800 μmol m-2s-1的高光胁迫后,6树种都发生了光抑制现象,再经10 μmol m-2s-1弱光恢复1 h后,演替中期优势种幼叶的Fv/Fm能够快速恢复,且成熟叶也能恢复到较高水平,而演替后期优势种成熟叶能恢复到较高水平,但幼叶却只恢复到较低水平。6树种幼叶的Fv/Fm恢复效率与花色素苷含量和总抗氧化能力均具有显著的正相关关系(图 9),说明花色素苷在6树种的光抑制保护和修复过程中起到了重要的作用。
幼叶在演替过程中的光合能力是比较弱的,但光保护潜力强,而光保护潜力正是来自于总抗氧化能力、总酚、Car/Chl、花色素苷和类黄酮,其中演替中期树种的DPPH•和花色素苷贡献率更大,演替后期树种的类黄酮和Car/Chl的贡献率更大,通过这些指标的相互协作提高了植物对高光胁迫氧化的防护作用,从而形成完善的光保护潜力系统。成熟叶的光合能力要比幼叶强,这是因为成熟叶光合机构发育完善,能够承受的有效光多,产生的过剩光机会要比幼叶少,其中Chl、Chl a/b在光合能力方面作出了很大的贡献,其中演替中期树种的Chl a/b贡献更大,演替后期树种的Chl a+b贡献更大。因此植物光保护潜力与其光合能力成反比关系。
综合来看,无论是演替中期还是演替后期优势树种叶片的大小、Chl a+b、Chl a/b随光照强度的降低呈上升趋势,而Car/Chl、花色素苷、类黄酮、总酚含量、总抗氧化能力则呈下降趋势。在夏季, 随着群落的演替,除花色素苷含量外,类黄酮和总酚含量呈上升趋势。因此植物对于光能过剩的防护, 是通过这些光保护物质的相互协同作用来完成的, 在夏季花色素苷对演替中期光能过剩防护上的贡献更加明显,而演替后期类黄酮和总酚的贡献更加明显,因此相比于成熟叶,幼叶的光保护潜力更高,这就意味着光保护潜力与光合能力成反比关系,这不仅体现不同演替阶段优势种幼叶的trade-off策略, 也体现出植物在幼叶和成熟叶间的trade-off策略。从高光胁迫的恢复试验中可以看出,演替后期优势种的幼叶和成熟叶对光强均比演替中期优势种的更敏感。这与Zhu等[29]的研究结果一致,而且演替后期优势种的光合能力要小于演替中期优势种,因此演替后期优势种必须通过提高综合的光保护潜力来适应不同的光环境,其中就包含提高单位面积的类胡萝卜素、类黄酮和总酚含量,以便能够及时地清除幼叶中由于过剩光产生的活性氧自由基[38]。所以演替中期的幼叶有花色素苷的保护, 而演替后期的幼叶有类黄酮、类胡萝卜素和总酚的保护,这为幼叶在不同光强与不同演替阶段正常生长和顺利发育提供了强有力的安全保障。
| [1] | BLOOR J M G, GRUBB P J. Growth and mortality in high and low light:Trends among 15 shade-tolerant tropical rain forest tree species[J]. J Ecol, 2003, 91(1): 77-85. DOI:10.1046/j.1365-2745.2003.00743.x |
| [2] | KELLY J, JOSE S, NICHOLS J D, et al. Growth and physiological response of six Australian rainforest tree species to a light gradient[J]. For Ecol Manag, 2009, 257(1): 287-293. DOI:10.1016/j.foreco.2008.09.008 |
| [3] | TAKAHASHI S, BADGER M R. Photoprotection in plants:a new light on photosystem Ⅱ damage[J]. Trends Plant Sci, 2011, 16(1): 53-60. DOI:10.1016/j.tplants.2010.10.001 |
| [4] | MURATA N, ALLAKHVERDIEV S I, NISHIYAMA Y. The mecha-nism of photoinhibition in vivo:Re-evaluation of the roles of catalase, α-tocopherol, non-photochemical quenching, and electron transport[J]. Biochim Biophys Acta, 2012, 1817(8): 1127-1133. DOI:10.1016/j.bbabio.2012.02.020 |
| [5] | KRAUSE G H, VIRGO A, WINTER K. High susceptibility to photo-inhibition of young leaves of tropical forest trees[J]. Planta, 1995, 197(4): 583-591. DOI:10.1007/BF00191564 |
| [6] |
JIANG C D, GAO H Y, ZOU Q, et al. The co-operation of leaf orien-tation, photorespiration and thermal dissipation alleviate photoinhi-bition in young leaves of soybean plants[J].
Acta Ecol Sin, 2005, 25(2): 319-325. 姜闯道, 高辉远, 邹琦, 等. 叶角、光呼吸和热耗散协同作用减轻大豆幼叶光抑制[J]. 生态学报, 2005, 25(2): 319-325. DOI:10.3321/j.issn:1000-0933.2005.02.021 |
| [7] | FEILD T S, LEE D W, HOLBROOK N M. Why leaves turn red in autumn:The role of anthocyanins in senescing leaves of red-osier dogwood[J]. Plant Physiol, 2001, 127(2): 566-574. DOI:10.1104/pp.010063 |
| [8] | HUGHES N M, NEUFELD H S, BURKEY K O. Functional role of anthocyanins in high-light winter leaves of the evergreen herb Galax urceolata[J]. New Phytol, 2005, 168(3): 575-587. DOI:10.1111/j.1469-8137.2005.01546.x |
| [9] | HUGHES N M, SMITH W K. Attenuation of incident light in Galax urceolata(Diapensiaceae):Concerted influence of adaxial and abaxial anthocyanic layers on photoprotection[J]. Amer J Bot, 2007, 94(5): 784-790. DOI:10.3732/ajb.94.5.784 |
| [10] | MÜLLER P, LI X P, NIYOGI K K. Non-photochemical quenching:A response to excess light energy[J]. Plant Physiol, 2001, 125(4): 1558-1566. DOI:10.1104/pp.125.4.1558 |
| [11] | VOSS I, SUNIL B, SCHEIBE R, et al. Emerging concept for the role of photorespiration as an important part of abiotic stress response[J]. Plant Biol, 2013, 15(4): 713-722. DOI:10.1111/j.1438-8677.2012.00710.x |
| [12] | VALENTINI R, EPRON D, DE ANGELIS P, et al. In situ estimation of net CO2 assimilation, photosynthetic electron flow and photo-respiration in Turkey oak (Q.cerris L.) leaves:Diurnal cycles under different levels of water supply[J]. Plant Cell Environ, 1995, 18(6): 631-640. DOI:10.1111/j.1365-3040.1995.tb00564.x |
| [13] | ZHANG Q, ZHANG T J, CHOW W S, et al. Photosynthetic charac-teristics and light energy conversions under different light environ-ments in five tree species occupying dominant status at different stages of subtropical forest succession[J]. Funct Plant Biol, 2015, 42(7): 609-619. DOI:10.1071/FP14355 |
| [14] |
PENG S L.
Community Dynamics in South Subtropical Forest[M]. Beijing: Science Press, 1996: 84-99.
彭少麟. 南亚热带森林群落动态学[M]. 北京: 科学出版社, 1996: 84-99. |
| [15] |
WANG B S, ZHANG Z Q, LAN C Y, et al. Studies on sampling techni-ques of the south-subtropical evergreen broad-leaf forest in Guangdong Province, China[J].
Acta Phytoecol Geobot Sin, 1982, 6(1): 51-61. 王伯荪, 张志权, 蓝崇钰, 等. 南亚热带常绿阔叶林取样技术研究[J]. 植物生态学与地植物学丛刊, 1982, 6(1): 51-61. |
| [16] |
WANG B S, LI M G, PENG S L.
Phytopopulology[M]. Guangzhou: Guangdong Higher Education Press, 1995: 132-148.
王伯荪, 李鸣光, 彭少麟. 植物种群学[M]. 广州: 广东高等教育出版社, 1995: 132-148. |
| [17] |
PENG S L, FANG W. Studies on the dynamic of dominant populations of Dinghushan forest during succession:Ⅲ.Cryptocarya chinensis and Cryptocarya concinna populations[J].
J Trop Subtrop Bot, 1994, 2(4): 79-87. 彭少麟, 方炜. 鼎湖山植被演替过程优势种群动态研究Ⅲ.黄果厚壳桂和厚壳桂种群[J]. 热带亚热带植物学报, 1994, 2(4): 79-87. DOI:10.3969/j.issn.1005-3395.1994.4.008 |
| [18] |
PENG S L, FANG W. Studies on dynamics of Castanopsis chinensis and Schima superba population in forest succession of Dinghushan Mountain[J].
Acta Phytoecol Sin, 1995, 19(4): 311-318. 彭少麟, 方炜. 鼎湖山植被演替过程中椎栗和荷木种群的动态[J]. 植物生态学报, 1995, 19(4): 311-318. |
| [19] | ZHANG Q, CHEN Y J, SONG L Y, et al. Utilization of lightflecks by seedlings of five dominant tree species of different subtropical forest successional stages under low-light growth conditions[J]. Tree Physiol, 2012, 32(5): 545-553. DOI:10.1093/treephys/tps043 |
| [20] | ZHU H, ZHANG T J, ZHENG J, et al. Anthocyanins function as a light attenuator to compensate for insufficient photoprotection mediated by nonphotochemical quenching in young leaves of Acmena acumina-tissima in winter[J/OL]. Photosynthetica[2017-07-28]. doi: 10.1016/j.envexpbot.2017.07.016. |
| [21] | CHRISTIE P J, ALFENITO M R, WALBOT V. Impact of low-temperature stress on general phenylpropanoid and anthocyanin path-ways:Enhancement of transcript abundance and anthocyanin pigmen-tation in maize seedlings[J]. Planta, 1994, 194(4): 541-549. DOI:10.1007/BF00714468 |
| [22] | STEYN W J, WAND S J E, JACOBS G, et al. Evidence for a photo-protective function of low-temperature-induced anthocyanin accumu-lation in apple and pear peel[J]. Physiol Plant, 2009, 136(4): 461-472. DOI:10.1111/j.1399-3054.2009.01246.x |
| [23] | POORTER H, NⅡNEMETS Ü, POORTER L, et al. Causes and conse-quences of variation in leaf mass per area (LMA):A meta-analysis[J]. New Phytol, 2009, 182(3): 565-588. DOI:10.1111/j.1469-8137.2009.02830.x |
| [24] | ZHU H, ZHANG T J, ZHANG P, et al. Pigment patterns and photo-protection of anthocyanins in the young leaves of four dominant sub-tropical forest tree species in two successional stages under contrasting light conditions[J]. Tree Physiol, 2016, 36(9): 1092-1104. DOI:10.1093/treephys/tpw047 |
| [25] | HEIMLER D, VIGNOLINI P, DINI M G, et al. Rapid tests to assess the antioxidant activity of Phaseolus vulgaris L.dry beans[J]. J Agric Food Chem, 2005, 53(8): 3053-3056. DOI:10.1021/jf049001r |
| [26] | AINSWORTH E A, GILLESPIE K M. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin-Ciocalteu reagent[J]. Nat Protoc, 2007, 2(4): 875-877. DOI:10.1038/nprot.2007.102 |
| [27] |
PENG C L, CHEN S W, LIN Z F, et al. Detection of antioxidative capacity in plants by scavenging organic free radical DPPH[J].
Prog Biochem Biophys, 2000, 27(6): 658-661. 彭长连, 陈少薇, 林植芳, 等. 用清除有机自由基DPPH法评价植物抗氧化能力[J]. 生物化学与生物物理进展, 2000, 27(6): 658-661. DOI:10.3321/j.issn:1000-3282.2000.06.022 |
| [28] | WELLBURN A R. The spectral determination of chlorophylls a and b, as well as total carotenoids, using various solvents with spectrophoto-meters of different resolution[J]. J Plant Physiol, 1994, 144(3): 307-313. DOI:10.1016/S0176-1617(11)81192-2 |
| [29] | ZHU S D, SONG J J, LI R H, et al. Plant hydraulics and photo-synthesis of 34 woody species from different successional stages of subtropical forests[J]. Plant Cell Environ, 2013, 36(4): 879-891. DOI:10.1111/pce.12024 |
| [30] | ZHANG T J, CHOW W S, LIU X T, et al. A magic red coat on the surface of young leaves:Anthocyanins distributed in trichome layer protect Castanopsis fissa leaves from photoinhibition[J]. Tree Physiol, 2016, 36(10): 1296-1306. DOI:10.1093/treephys/tpw080 |
| [31] | TUCIĆ B, VULETA A, JOVANOVIĆ S M. Protective function of foliar anthocyanins:in situ experiments on a sun-exposed population of Iris pumila L.(Iridaceae)[J]. Pol J Ecol, 2009, 57(4): 779-783. |
| [32] | ZHANG K M, YU H J, SHI K, et al. Photoprotective roles of antho-cyanins in Begonia semperflorens[J]. Plant Sci, 2010, 179(3): 202-208. DOI:10.1016/j.plantsci.2010.05.006 |
| [33] | NEILL S O, GOULD K S. Anthocyanins in leaves:light attenuators or antioxidants?[J]. Funct Plant Biol, 2003, 30(8): 865-873. DOI:10.1071/FP03118 |
| [34] | JAHNS P, HOLZWARTH A R. The role of the xanthophyll cycle and of lutein in photoprotection of photosystem Ⅱ[J]. Biochim Biophys Acta, 2012, 1817(1): 182-193. DOI:10.1016/j.bbabio.2011.04.012 |
| [35] | TAKOS A M, JAFFÉ F W, JACOB S R, et al. Light-induced expre-ssion of a MYB gene regulates anthocyanin biosynthesis in red apples[J]. Plant Physiol, 2006, 142(3): 1216-1232. DOI:10.1104/pp.106.088104 |
| [36] | ALBERT N W, LEWIS D H, ZHANG H B, et al. Light-induced vegetative anthocyanin pigmentation in Petunia[J]. J Exp Bot, 2009, 60(7): 2191-2202. DOI:10.1093/jxb/erp097 |
| [37] | PAIVA É A S, ISAIAS R M S D S, VALE F H A, et al. The influence of light intensity on anatomical structure and pigment contents of Trade-scantia pallida (Rose) Hunt.cv.Purpurea Boom (Commelinaceae) leaves[J]. Braz Arch Biol Technol, 2003, 46(4): 617-624. DOI:10.1590/S1516-89132003000400017 |
| [38] | AGATI G, TATTINI M. Multiple functional roles of flavonoids in photoprotection[J]. New Phytol, 2010, 186(4): 786-793. DOI:10.1111/j.1469-8137.2010.03269 |
 2018, Vol. 26
2018, Vol. 26



