安祖花(Anthurium andraeanum Lind.)又名红掌、花烛等,是一种名贵的观赏花卉, 因花期较长,花葶姿态优美而受到关注。安祖花传统采用实生繁殖和分株繁殖,但由于雌雄蕊异熟,导致有活性的种子数量较少,且需随采随播,因此目前实生繁殖只在育种工作中应用,而分株繁殖速度则较慢[1]。自从成功建立安祖花组织培养体系以来,利用工厂化生产种苗己成为一种快速而有效的繁殖方式[2]。
体细胞胚胎现象具有增殖速度快,且分化不需要生根等优点,已成为植物组织培养的热点[3]。植物胚状体再生与器官再生是两个完全不同的过程, 但植物胚状体发生途径也可归纳为两种:直接途径和间接途径。直接途径是指离体的组织可以不经过愈伤组织阶段,而直接产生胚状体[4];间接途径是指离体组织先先形成胚性愈伤组织,然后再分化出胚状体[5]。辛伟杰[6]以安祖花根段、叶片、叶柄为外植体,探索了不同浓度的2, 4-D和KT对胚性愈伤组织和胚性结构诱导的影响,并优化了胚性结构诱导和分化的培养条件。Ebrahim等[7]以安祖花‘Tera’品种的叶盘为外植体,研究了器官发生途径和胚状体发生途径中不同浓度的2, 4-D、BA和KT对愈伤组织诱导率的影响,并对两种途径获得的愈伤组织进行了比较。许传营[8]以安祖花‘Amigo’品种的胚性愈伤组织为材料,研究了液体培养时影响胚性愈伤组织增殖及胚状体分化的因素,并改良了液体培养体系。储丽红等[9]以安祖花‘Dakota’以及‘Pink Champion’嫩叶为外植体,认为Phytagel的胚性愈伤组织诱导效果显著优于琼脂,而MS+3 mg L–1 Picloram培养基对胚性愈伤组织增殖效果最好。Pinheiro等[10]报道以安祖花‘Eidibel’品种茎节为外植体时,体胚诱导效果较好。Jaime等[11]对近年来安祖花多个品种的离体培养条件进行了分析,强调基础研究与实际应用结合的重要性,例如以胚状体再生技术为基础制作人工种子,将花药培养和多倍体诱导技术结合进行品种改良等。
研究体细胞胚的发生对于解释合子胚发育、细胞分化、形态建成、基因表达及调控等具有十分重要的意义[12]。本研究在前人工作的基础上,重点探讨了基本培养基、植物生长调节剂、品种及外植体等对安祖花胚性愈伤组织诱导和胚状体再生的影响,并对不同发育阶段的胚状体结构进行了观察, 优化了‘粉冠军’品种的胚状体发生途径,以期为安祖花离体快繁、变异体筛选和品种改良奠定理论和实践基础[13]。
1 材料和方法 1.1 材料试验材料为安祖花(Anthurium andraeanum)的3个盆栽品种,分别为‘Robino’ (‘罗宾奴’)、‘Pink Champion’ (‘粉冠军’)和‘Champion’ (‘冠军’),均购自上海鲜花港中荷园艺培训示范中心。3个安祖花品种的差异主要体现在佛焰苞片和肉穗花序的颜色上[14]。‘Robino’佛焰苞片血红色,肉穗花序上端黄绿色,下端橘红色;‘Pink Champion’佛焰苞片粉色,肉穗花序多金黄色或黄绿色;‘Champion’佛焰苞片白色,肉穗花序上端暗血红色,下端淡乳红色。组培苗为本实验室保存,培养条件为温度(25±1)℃, 湿度50%~60%,光强25~37.5 μmol m–2s–1, 16 h/8 h光暗交替,40 d继代1次。实验前期,先以茎段为外植体,通过器官发生途径获得了3个品种的再生植株[13],然后再从生长强健的再生苗上(图 1)取幼嫩叶片、叶柄为外植体,进行胚性愈伤组织的诱导和二次再生试验。切下叶片,保留中脉,去掉叶尖、叶柄,在中脉处划伤,叶背向下平放在培养基上。叶柄切为0.5 cm左右的小段接种到培养基上。

|
图 1 安祖花3个品种的再生植株。A: ‘罗宾奴’; B: ‘粉冠军’; C: ‘冠军’。 Fig. 1 Regenerated seedlings of three cultivars of Anthurium andreanum. A: 'Robino'; B: 'Pink Champion'; C: 'Champion'. |
培养基使用前,用1 mol L–1 NaOH将pH调至5.6~6.0,并在121℃、1.1 kg cm–2下灭菌2 h。胚性愈伤组织诱导培养基编号为MS71~MS79,MS71参照徐彬[15]的诱导培养基成分,基本培养基为改良MSb;MS72参照刘雪莲等[16]的成分,基本培养基为改良MSb;MS73参照王杰等[17]的成分,基本培养基为改良MSb;MS74参照郭子彪等[18]的成分, 基本培养基为改良MSb;MS75参照魏开发[19]的成分,基本培养基变为改良MB;MS76参照Musa等[20]的Medium B,2, 4-D为18 µmol L–1,基本培养基为改良MS1;MS77为改良MS2+3.0 mg L–1 TDZ+2%蔗糖+1000 mg L–1 Tryptone+170 mg L–1 NaH2PO4+ 0.25% Phytagel;MS78和MS79分别参照Adelheid等[21]的Medium S和Medium F,基本培养基为改良MS3。体细胞胚分化培养基编号为MS91~MS93, 参照Adelheid等[21]的培养基成分,基本培养基为1/2改良MSa,碳源为2%蔗糖。MS91培养基不添加BA,凝固剂为0.8%琼脂;MS92培养基中BA为0.5 mg L–1,凝固剂为0.25% Phytagel;MS93培养基不添加BA,凝固剂为0.25% Phytagel。改良MSa中不含NH4NO3;1/2改良MSa中仅大量元素减半;改良MSb中添加300 mg L–1 CH和500 mg L–1 L-谷氨酰胺;改良MB为MS培养基(含B5有机成分)+ 500 mg L–1 CH+700 mg L–1 L-脯氨酸;改良MS1参照Musa等[20]的成分;改良MS2为1/2MS大量元素+1/2MS微量元素+MS有机成分;改良MS3为1/2MS大量元素+MS微量元素+3/5铁盐+MS有机成分(不含甘氨酸)。
1.3 方法胚性愈伤组织的诱导 将叶片、叶柄接种于培养基上,每个培养皿接种10个外植体,每种培养基接种4~5个皿,暗培养60 d后统计胚性愈伤组织诱导率。胚性愈伤组织诱导率=形成胚性愈伤组织的外植体数/接种外植体总数。之后,再以‘粉冠军’的叶片、叶柄为外植体,放置于添加了不同浓度2, 4-D (1.0, 1.5, 2.0, 3.0, 4.0 mg L–1)的MS78培养基上,每个培养皿接种10个外植体,每种外植体接种4~5个皿,暗培养60 d后统计胚性愈伤组织诱导率。
胚状体的萌发 体细胞胚发育时,选择生长状态较好、色泽较浅的胚性愈伤组织,将其表层乳白色或者淡黄色、带有光泽的颗粒状体胚分离下来,置于MS91~MS93培养基中。每皿接种10个外植体,每种培养基接种8~10个皿,将一半置于暗培养45 d,另一半置于光培养45 d。观察体胚的萌发情况。
胚状体发育的组织学观察 选取不同发育阶段的安祖花胚状体,一部分用FAA固定液固定24 h以上,50%乙醇浸洗,爱氏苏木精整染,经过脱水、透明、浸蜡、包埋后进行常规石蜡切片,Nikon倒置显微镜TE-2000U下观察并照相。另一部分置于含蒸馏水的培养皿中,用Olympus体视显微镜SZX2-ILLT观察胚性结构的发育。
二次再生植株的壮苗、驯化和移栽 待安祖花胚状体萌发约4~6周后,植株发育完整,可先将小植株接种到1/2MS培养基中壮苗生长2~3周,待有4~6片完全展开的叶片后,打开封口膜,洗净苗根部的培养基,移栽到疏松透气的基质中(珍珠岩:泥炭土=1:1),于光照培养箱中放置5~7 d,然后移至温室自然生长,每2周浇1次MS液体培养基。
1.3 数据分析用Microsoft Excel和SAS软件对数据进行统计、方差分析及多重比较(Duncan法,P=0.05), 百分数经反正弦(y=arcsinx1/2)转换后,再进行统计分析。
2 结果和分析 2.1 胚性愈伤组织的诱导从表 1可见,不同品种和外植体诱导胚性愈伤组织的能力有显著差异,不同培养基成分对胚性愈伤组织诱导率有显著影响。胚性愈伤组织诱导率以MS78上培养的‘粉冠军’叶片最高(57.9%),叶片接入培养基60 d后,叶片边缘开始有胚性愈伤组织出现,生长较慢,大多呈淡黄色,质地疏松,表面有许多点状、光泽的突起,且容易脱落(图 2)。大多数叶柄在培养基中发生褐化死亡,少部分诱导出的愈伤组织呈黄色,质地紧密,不易分散,可能为非胚性愈伤组织,只有极少数叶柄上有成簇状的胚性愈伤组织形成。因此,诱导胚性愈伤组织的较适品种为‘粉冠军’,以叶片为外植体,最佳培养基为MS78。
| 表 1 安祖花的胚性愈伤组织诱导率(%) Table 1 Embryogenic callus induction (%) of Anthurium andreanum |

|
图 2 ‘罗宾奴’(A)和‘粉冠军’(B)叶片在MS78培养基,‘粉冠军’(C)叶片在MS72培养基上的胚性愈伤组织诱导 Fig. 2 Embryogenic callus induction from leaves of 'Robino' (A) and 'Pink Champion' (B) on MS78 medium, 'Pink Champion' (C) on MS72 medium |
从表 2可见,以最佳诱导培养基为基础,2, 4-D浓度对胚性愈伤组织的诱导率有显著影响。当2, 4-D为1.5 mg L–1时,‘粉冠军’叶片的胚性愈伤组织诱导率最高(57.9%)。叶柄与叶片间的胚性愈伤组织诱导率差异显著,叶柄的较低,仅为12.7%。因此,‘粉冠军’叶片在胚性愈伤组织诱导时,最佳的2, 4-D浓度建议选择1.5 mg L–1。
| 表 2 2, 4-D对‘粉冠军’胚性愈伤组织诱导率(%)的影响 Table 2 Effects of 2, 4-D on embryogenic callus induction rate (%) of 'Pink Champion' |
结果表明(图 3),在MS91和MS93培养基上部分胚状体能正常分化,获得完整的再生小植株,且在MS93上的分化率(31.6%)高于MS91(21.7%),但差异不显著,说明凝固剂对胚状体的分化影响不大。而加入BA的MS92培养基对胚状体的分化不利, 加入BA会诱发根或芽的生长,大部分胚状体发生褐化现象,不能分化,逐渐转为非胚性组织,这可能与材料的长期继代,体内激素积累有关。同时,黑暗和光照下安祖花胚状体都能正常分化,且分化率的差异不显著。因此,安祖花胚状体分化的最佳培养基建议选择MS93。

|
图 3 胚状体的分化。 A:胚性愈伤组织; B:胚状体; C: ‘罗宾奴’ (暗); D: ‘冠军’ (暗); E: ‘粉冠军’ (光); F: ‘粉冠军’再生植株(光)。 Fig. 3 Embryoid differentiation. A: Embryogenic callus; B: Embryoiod; C: 'Robino' under dark; D: 'Champion' under dark; E: 'Pink Champion' under light; F: Plantlets of 'Pink Champion' under light. |
石蜡切片结果表明,愈伤组织的本质为无序的大型薄壁细胞团,其中胚性愈伤组织的细胞排列紧密、细胞核大、核仁明显,几乎占据整个细胞(图 4: B);而非胚性愈伤组织的细胞核小,占整个细胞的体积也较小(图 4: A)。同时观测到较多的分生组织细胞团,多数位于胚性愈伤组织表面或脱离愈伤组织单独存在,具有显著加厚的细胞壁,染色较深。由外起源途径产生的多细胞原胚在发育过程中与愈伤组织细胞团连接处的基部会逐渐收缩,和邻近细胞形成明显的分界线,最终产生细胞隔离(图 4: C)。在切片观察时也发现了较典型的球形胚、心形胚、叶原基等结构,但未观察到较明显的鱼雷形胚等后期发育结构(图 4: D~G)。
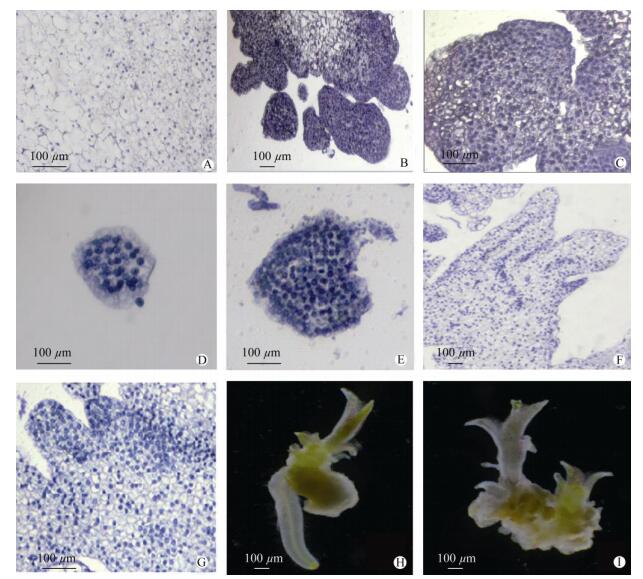
|
图 4 胚状体的结构。 A:非胚性愈伤组织; B:胚性愈伤组织; C:外起源途径产生的多细胞原胚; D:球形胚阶段纵切面; E:心形胚阶段纵切面; F:簇生胚状体纵切面; G:分生组织芽原基发育; H:胚状体分化(体视显微镜); I:愈伤组织出芽(体视显微镜)。 Fig. 4 Structure of embryoid. A: Non-Embryogenic callus; B: Embryogenic callus; C: Proembryos forming from the surface of the callus; D: Longitudinal section of globular stage embryo; E: Longitudinal section of heart stage embryo; F: Longitudinal section of cluster embryos attached each other; G: Bud primordium developed from meristem cells; H: Differentiation of embryoid under stereo microscope; I: Adventitious buds from callus under stereo microscope. |
体视显微镜观察结果表明(图 4: H, I),一部分胚性愈伤组织表面分化出胚状体,易与母体分离, 且表现出两极性现象。同时,另一部分愈伤组织直接再生出茎、芽,未表现出两极性现象。因此,认为安祖花的离体再生过程中,可能同时存在器官发生途径和胚状体发生途径。
2.4 二次再生植株的壮苗,驯化及移栽安祖花二次再生的植株转接到1/2MS培养基壮苗培养1~2周后,小植株经驯化移栽,在温室中能够100%存活(图 5)。

|
图 5 安祖花二次再生植株的驯化移栽。 A: ‘粉冠军’; B: ‘冠军’; C: ‘罗宾奴’。 Fig. 5 Transplanting of the second-regenerated seedlings of Anthurium andreanum. A: 'Pink Champion'; B: 'Champion'; C: 'Robino'. |
在植物胚状体发生的过程中,体细胞胚胎发生的频率与基因型有关。在大多数植物培养中,一般都要经历胚性愈伤组织分化,才能形成体细胞胚[22]。因此,得到高质量的胚性愈伤组织是体细胞胚形成的关键。同时,对胚状体发生有重要影响的因子是外植体来源和发育阶段。对于单子叶植物, 细胞分裂旺盛的分生组织或器官,如叶片基部、茎尖、幼胚、幼花序轴、胚珠等都是较优良的外植体[23]。本研究中虽然采用了重新再生的植株为外植体,但3个品种仅在部分培养基中诱导得到了少量胚性愈伤组织,且诱导率极低,可能是由于供试材料为继代超过6年的安祖花组培苗,材料本身已高度驯化,再生能力低下,缺乏胚性细胞,限制了胚性愈伤组织的形成。同时,胚性愈伤组织集中出现在叶片基部与叶柄相连的周边部位,而其余部位的诱导效果较差。因此,在后续试验中,可考虑采取田间实生苗的分生组织为外植体,以期提高胚性愈伤组织的诱导率。
3.2 植物生长调节剂对胚性愈伤组织诱导的作用在间接诱导体细胞胚发生时,生长素不仅为细胞分裂所必需,也被诱导的胚胎决定细胞所需。诱导胚性愈伤组织的生长素主要以2, 4-D为主,配合使用少量的细胞分裂素,不仅可以提高诱导率,还能减少褐化现象的发生。通过改变外源激素的水平,能刺激体细胞形成胚性结构。当需要体胚发育时,必须及时降低或去掉2, 4-D,诱导得到的胚性细胞才能按照胚状体的发育途径正常发育[21]。本研究结果表明,在胚性愈伤组织诱导时2, 4-D浓度为1.5 mg L–1较好,这比辛伟杰[6]的结果要低,这可能是由于组培苗长期继代,激素在植株内有积累所致;而在胚状体分化时,去掉植物生长调节剂才能获得再生小植株。
3.3 胚状体萌发过程中存在的问题本研究中发现体细胞胚转入分化培养基后,仍然有部分不能正常分化,它们在发育过程中会出现畸形、褐化,从而失去再生能力;而在能够分化的胚状体中,也有部分存在着根与茎芽发育不均衡的现象,两极生长速度差异大,最终无法形成完整的小植株。推测可能是由于外源生长调节剂的过量添加,导致组织内在生理状态的失调,淀粉粒、糖和蛋白质等代谢物的积累不足使得体细胞胚还未发育成熟就被迫萌发,最终使得植物形态建成失败[12]。
3.4 器官发生与体胚发生并存的再生方式本研究初期是以直接诱导胚状体为目标的,但多次试验后安祖花这些品种都无法直接诱导出胚状体,少部分即使诱导出胚状体也会逐渐愈伤化从而失去分化能力,后期我们将试验重点转向安祖花胚性愈伤组织的诱导上,在一部分愈伤组织上出现了类似胚状体的结构,经过细胞学观察,认为是胚性愈伤组织,且其表面能形成具有正常再生功能的胚状体。这与麝香百合(Lilium longiflorum)的胚性愈伤组织诱导一致[17],通过间接方式获得了胚状体。同时,另一部分愈伤组织表面无法形成胚状体,后期分化形成不定芽。因此,我们认为在安祖花植株再生过程中,器官发生途径和胚状体发生途径是并存的。
| [1] |
LIU G F, ZHAO Q Q, BAO M Z. Factors affecting callus induction and plant regeneration from leaf explants of pot anthurium (Anthurium andraeanum Lind.)[J].
J Huazhong Agric Univ, 2009, 28(3): 356-360. 刘国锋, 赵庆庆, 包满珠. 盆栽安祖花叶片愈伤组织诱导及植株再生的影响因素[J]. 华中农业大学学报, 2009, 28(3): 356-360. DOI:10.3321/j.issn:1000-2421.2009.03.023 |
| [2] | PIERIK R L M, STEEGMANS H H M, van der MEYS J A J. Plantlet formation in callus tissues of Anthurium andraeanum Lind.[J]. Sci Hort, 1974, 2(2): 193-198. DOI:10.1016/0304-4238(74)90009-0 |
| [3] | VERGNE P, MAENE M, GABANT G, et al. Somatic embryogenesis and transformation of the diploid Rosa chinensis cv.Old Blush[J]. Plant Cell Tiss Org, 2010, 100: 73-81. DOI:10.1007/s11240-009-9621-z |
| [4] |
ZHOU J Y. Embryoids produced from somatic plant cells in vitro:Ⅰ.In vitro embryogenesis of somatic plant cells[J].
Acta Phytophysiol Sin, 1981, 7(4): 389-397. 周俊彦. 植物体细胞在组织培养中产生的胚状体:Ⅰ.植物体细胞的胚状体发生[J]. 植物生理学报, 1981, 7(4): 389-397. |
| [5] | PLATA E, VIÉITEZ A M. In vitro regeneration of Camellia reticulata by somatic embryogenesis[J]. J Hort Sci Biotechnol, 1990, 65(6): 707-714. DOI:10.1080/00221589.1990.11516112 |
| [6] |
XIN W J. Somatic embryogenesis and physiological and biochemical characteristics of Anthurium[D]. Nanjing: Nanjing Agricultural University, 2006: 21-30.
辛伟杰. 花烛体细胞胚胎发生及相关生理生化研究[D]. 南京: 南京农业大学, 2006: 21-30. |
| [7] | BEYRAMIZADE E, AZADI P, MⅡ M. Optimization of factors affecting organogenesis and somatic embryogenesis of Anthurium andreanum Lind.'Tera'[J]. Propag Ornam Plants, 2008, 8(4): 198-203. |
| [8] |
XU C Y. Establishment of liquid cuture method for Anthurium somatic embryo and some physiological characteristics during somatic embryo-genesis[D]. Nanjing: Nanjing Agricultural University, 2008: 15-22.
许传营. 花烛体胚液体培养体系建立及体胚发生相关生理特征研究[D]. 南京: 南京农业大学, 2008: 15-22. |
| [9] |
CHU L H, LIU C, WANG Z, et al. Effects of different gelling agents and Picloram on embryonic callus induction and proliferation of Anthurium andraeanum[C]//Advances in Ornamental Horticulture of China. Guangzhou: Horticultural Specialized Committee of China Horticultural Society, 2012: 229-232.
储丽红, 刘春, 王钊, 等. 不同凝固剂及Picloram对安祖花胚性愈伤组织诱导、增殖的影响[C]//中国观赏园艺研究进展. 广州: 中国园艺学会观赏园艺专业委员会, 2012: 229-232. |
| [10] | PINHEIRO M V M, MARTINS F B, DA CRUZ A C F, et al. Somatic embryogenesis in anthurium (Anthurium andraeanum cv.Eidibel) as affected by different explants[J]. Acta Sci Agron, 2014, 36(1): 87-98. DOI:10.4025/actasciagron.v36i1.16557 |
| [11] | da SILVA J A T, DOBRÁNSZKI J, WINARTO B, et al. Anthurium in vitro:A review[J]. Sci Hort, 2015, 186: 266-298. DOI:10.1016/j.scienta.2014.11.024 |
| [12] |
CUI K R, DAI R L.
Molecular Biology of Plant Somatic Embryo-genesis[M]. Beijing: Science Press, 2000: 48-57.
崔凯荣, 戴若兰. 植物体细胞胚发生的分子生物学[M]. 北京: 科学出版社, 2000: 48-57. |
| [13] |
LIU B J. Agrobacterium-mediated transformation of AtCBF3 and PaFT gene into Anthurium andraeanum[D]. Wuhan: Huazhong Agricultural University, 2011: 10-11.
刘宝骏. 农杆菌介导AtCBF3及PaFT基因转化安祖花的研究[D]. 武汉: 华中农业大学, 2011: 10-11. |
| [14] |
WANG R X, WANG N.
Anthurium[M]. Beijing: China Forestry Publishing House, 2002: 6-12.
王若祥, 王赧. 花烛[M]. 北京: 中国林业出版社, 2002: 6-12. |
| [15] |
XU B. Establishment of in vitro propagation systems of several cultivars of Anthurium andreaenum and study on characteristics of leaf color chimeras[D]. Nanjing: Nanjing Agricultural University, 2005: 26-29.
徐彬. 几个花烛品种离体快繁体系的建立和离体叶色变异株系性状研究[D]. 南京: 南京农业大学, 2005: 26-29. |
| [16] |
LIU X L, FU Z X, GU D Z. Study on somatic embryogenesis of Anthurdum andraeanum 'Arizona'[J].
J Tonghua Norm Univ, 2010, 31(8): 35-37. 刘雪莲, 付志欣, 顾地周. 红掌"亚丽桑娜"体细胞胚胎发生的探研[J]. 通化师范学院学报, 2010, 31(8): 35-37. |
| [17] |
WANG J, LIU G F, BAO M Z, et al. Adjustment of the status of embryogenic callus and plant regeneration of Lilium longiflorum[J].
Acta Hort Sin, 2008, 35(2): 1795-1802. 王杰, 刘国锋, 包满珠, 等. 麝香百合胚性愈伤组织状态的调整与植株再生[J]. 园艺学报, 2008, 35(2): 1795-1802. |
| [18] |
GUO Z B, GAI J Y. Embryogenic callus inducing and differentiating regulated by endogenous IAA and ABA[J].
Soybean Sci, 1997, 15(3): 194-198. 郭子彪, 盖钧镒. 内源激素IAA、ABA对大豆萌发子叶胚性愈伤组织诱导及其分化的调控[J]. 大豆科学, 1997, 15(3): 194-198. |
| [19] |
WEI K F. Studies on somatic embryogenesis of Chinese narcissus and GUS gene genetic transformation mediated by Agrobacterium tume-faciens[J].
J Nanjing For Univ (Nat Sci), 2009, 33(4): 33-37. 魏开发. 水仙胚性愈伤的获得及农杆菌介导GUS基因的遗传转化[J]. 南京林业大学学报(自然科学版), 2009, 33(4): 33-37. |
| [20] | Musa H, Abdul G A K, Pierre D. Somatic embryogenesis and plant regeneration in Anthurium scherzerianum.[J]. Plant Cell Tiss Org, 1997, 48: 189-193. DOI:10.1023/A:1005834131478 |
| [21] | ADELHEID R, KUEHNLE, CHEN F C, et al. Somatic embryogenesis and plant regeneration in Authurium andraeanum[J]. Plant Cell Rep, 1992, 11(9): 438-442. |
| [22] |
HAO J P, JIN Z P, WANG Y K, et al. Study on embryo development and somatic embryogenesis of jujube[J].
J Mol Cell Biol, 2006, 39(5): 423-430. 郝建平, 金竹萍, 王永康, 等. 枣合子胚和体细胞胚发育过程的观察与比较[J]. 分子细胞生物学报, 2006, 39(5): 423-430. DOI:10.3321/j.issn:1673-520X.2006.05.005 |
| [23] |
YUAN S, JIA Y J, LIN H H. Several physiological factors inducing somatic embryogenesis of plant[J].
Plant Physiol Commun, 2003, 39(5): 508-512. 袁澍, 贾勇炯, 林宏辉. 诱导植物体细胞胚发生的几个生理因素[J]. 植物生理学通讯, 2003, 39(5): 508-512. |
 2018, Vol. 26
2018, Vol. 26


