线纹香茶菜[Isodon lophanthoides (Buch.-Ham. ex D. Don) H. Hara]为唇形科(Lamiaceae)香茶菜属植物,是中药溪黄草的主要基原植物,为民间习用草药,主产于长江以南的湖南、湖北、四川、云南、江西、广东、广西、福建等省区。喜生于山谷阴湿溪旁,新鲜叶片捣碎有黄汁而得名[1]。其性味苦、甘、寒,归肝、胆经,具有清热利湿、凉血散瘀、退黄等功效,主要用于治疗急性黄疸型肝炎、急性胆囊炎、湿热痢疾、肠炎、跌打瘀肿和养生保健等。中药溪黄草在广东各地临床应用普遍,是著名的岭南特色中药材。现已开发出多种以其为主要原料的保健品和中成药,如溪黄草冲剂、溪黄草袋泡茶、消炎利胆片、复方胆通等,对护肝利胆、抗肿瘤有着显著的作用。此外,溪黄草是广式凉茶的重要成分,是岭南地区的居民经常饮用的凉茶之一。
线纹香茶菜的有效化学成分中挥发油占了大部分,而挥发油的产生与分泌则与植株腺毛的特征有着直接的联系,腺毛的分布密度越大、处于分泌时期的腺毛越多,其分泌能力就越高[2-3],但是有关溪黄草腺毛的相关研究甚少,仅在其他唇形科植物中有报道。因此,对线纹香茶菜腺毛的分布状况、类型及结构发育的研究不仅具有重要的理论意义, 而且对该属植物的开发利用亦具有参考价值。本文以中药溪黄草主要基原植物线纹香茶菜(原变种) (Isodon lophanthoides var. lophanthoides)为材料,制作半薄切片,采用光镜与扫描、透射电镜技术观察腺毛的形态结构与发育过程,为溪黄草的植物品种鉴定和开发利用提供参考。
1 材料和方法 1.1 材料于2016年9月在广东食品药品职业学院引种园采集线纹香茶菜(原变种)[Isodon lophanthoides var. lophanthoides]的栽培植株。凭证标本存于广东食品药品职业学院标本馆,采集者为袁亮,凭证标本号为S00167。
1.2 方法体视镜观察 分别取线纹香茶菜正常生长的幼叶和成熟新鲜叶片, 在装有Zeiss AxioCam MRC数码相机的Zeiss Stemi SV Ⅱ体视镜下观察腺毛的分布及外部形态,并拍照。
半薄切片 分别取线纹香茶菜的茎尖、幼叶和成长叶,切成l mm2左右的小块,用3%戊二醛和1%锇酸双重固定,系列酒精脱水,Epon812包埋, 用LKB-11800半薄切片机切成2 μm的薄切片,用甲苯胺蓝染色,用OLYMPUS-DP50光学显微镜观察并拍照。
扫描电镜观察 分别取线纹香茶菜仅具1~2对幼叶的茎尖、不同发育程度的幼叶及成熟叶片, 切成约1 mm2左右的小块,于2%戊二醛溶液中固定24 h、系列酒精脱水、临界点干燥及喷镀处理后,用JSM-6360扫描电镜观察并摄影。
透射电子显微镜观察 分别取线纹香茶菜不同发育时期带有叶原基的茎端、幼叶和成熟叶, 切成1 mm3的小块,用2%戊二醛(pH 7.0磷酸缓冲液配制)和1%锇酸双重固定,系列酒精脱水,环氧丙烷过渡, Spurr包埋后,LKB-11800半薄切片机切片,切片厚度2 μm,甲苯胺蓝染色,Olympus-DP50显微镜观察并照相。用Leica-Ultracut S超薄切片机制作超薄切片,切片用醋酸双氧铀和柠檬酸铅染色后,用JEM-1010透射电镜观察和拍照[4]。
2 结果 2.1 腺毛的形态结构在解剖镜下,线纹香茶菜叶和花萼上的腺毛大多数为红色(图 1: A, B),少部分为无色透明(图 1: B)。

|
图 1 解剖镜下溪黄草的两种腺毛。 A:叶上红色的腺毛(箭); B:花萼上红色(箭)及无色透明(箭头)的腺毛。标尺=200 μm Fig. 1 Two glandular trichomes of Isodon lophanthoides var. lophanthoides under anatomical microscope. A: Red glandular trichomes (arrows) on leaf; B: Red (arrows) and colorless (arrowhead) glandular trichomes on calyx. Bars=200 μm |
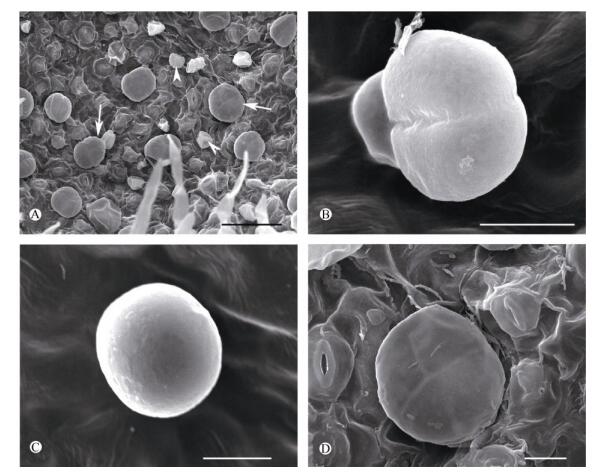
在扫描电镜下,线纹香茶菜腺毛有头状腺毛和盾状腺毛2种类型(图 2: A),处于分泌时期的单个成熟头状腺毛高约25 μm,头部直径约15 μm (图 2: B, C)。而成熟的盾状腺毛的大小几乎是头状腺毛的3倍,高约70 μm,头部直径约45 μm (图 2: D)。
|
图 2 扫描电镜下线纹香茶菜腺毛。 A:叶上的盾状腺毛(Pgt, 箭)和头状腺毛(Cgt, 箭头); B:头部2个分泌细胞的头状腺毛; C:头部1个分泌细胞的头状腺毛; D:头部4个分泌细胞的盾状腺毛。标尺: A=50 μm; B~D=10 μm Fig. 2 Glandular trichomes of Isodon lophanthoides var. lophanthoides under SEM. A: Peltate (arrow) and capitate glandular trichome (arrowhead) on leaf; B: Capitate glandular trichome with 2 secretory cells; C: Capitate glandular trichome with 1 secretory cell; D: Peltate glandular trichome with 4 secretory cells. Bars: A=50 μm; B-D=10 μm |
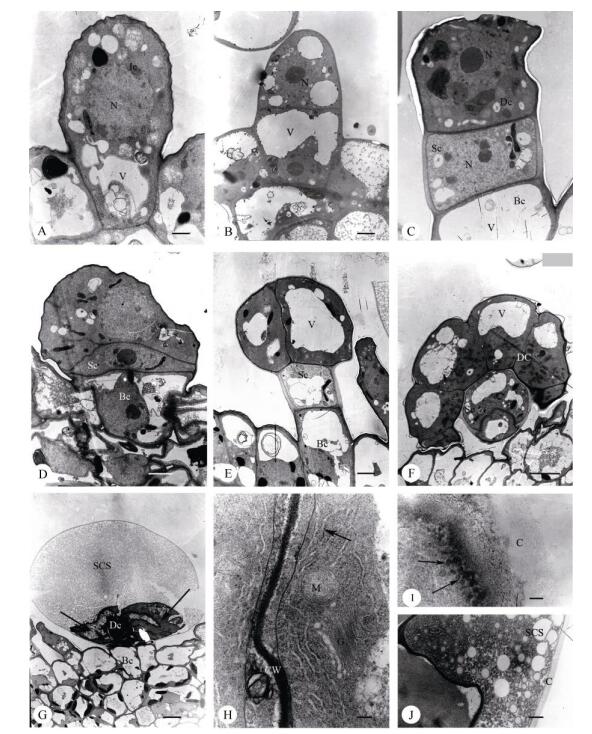
腺毛发育初期,头状腺毛和盾状腺毛均由1个原始细胞(图 3: A)经过平周分裂发育为2-细胞时期(图 3: B),头部细胞再经1次平周分裂发育为3-细胞时期(图 3: C)。由于柄细胞状态不同而发育成为2种腺毛, 柄细胞保持长方形的(图 3: C)发育为头状腺毛(图 3: E),保持扁平形状的(图 3: D)发育为盾状腺毛(图 3: F, G)。
|
图 3 透射电镜下线纹香茶菜腺毛的结构。 N:细胞核; CW:细胞壁; V:液泡; Sc:柄细胞; Bc:基细胞; Dc:头细胞; Bc:基细胞; C:角质层。A:腺毛原始细胞(Ic); B: 2-细胞时期的腺毛; C: 3-细胞时期的头状腺毛,柄细胞(Sc)方形; D: 3-细胞时期的盾状腺毛,柄细胞(Sc)扁平状; E:分泌时期的头部双细胞(Dc)的头状腺毛,前质体丰富(白箭),角质层间隙(SCS)正在形成(黑箭); F:分泌时期头部8细胞(Dc)的盾状腺毛; G:分泌晚期的盾状腺毛,角质层空间(SCS)几乎占满整个头部,分泌细胞(箭)基本退化变形; H:分泌期的盾状腺毛头部分泌细胞的超微结构,具有丰富的粗面内质网(RER),线粒体(M)和高尔基体(G); I:分泌期的盾状腺毛头部分泌细胞的超微结构,大量的分泌小泡(箭)载着嗜锇物质在细胞质膜附近; J:分泌期的盾状腺毛角质层下间隙(SCS)中大量的分泌物质。标尺: A=1 μm; B~E=2 μm; F=5 μm; G=7 μm; H=200 nm; I=100 nm; J=500 nm Fig. 3 Glandular trichomes structure of Isodon lophanthoides var. lophanthoides under TEM. N: Nucleus; CW: Cell wall; V: Vacuole; Sc: Stalk cell; Bc: Basic cell; Dc: Disc cell; C: Cuticular. A: Initial cell (Ic); B: Glandular trichomes at 2-cells stage; C: Capitate glandular trichomes at 3-cell stage, showing square stalk cell (Sc); D: Peltate glandular trichomes at 3-cell stage, showing flat stalk cell (Sc); E: Capitate glandular trichomes at secretory stage, showing disc cells is rich in plastids (white arrow), the subcuticular space (SCS) is formatting (black arrow); F: Peltate glandular trichome with 8 secretory disc cells (Dc); G: Peltate glandular trichome at late secretory stage, showing subcuticular space (SCS) is full of secretion, and the degraded secretory cells (arrow); H: Ultrastructure of a peltate glandular trichome at secretory stage, the secretory cells contain abundant rough endoplasmic reticulum (RER), mitochondria (M) and Golgi (G); I: Ultrastructure of a peltate glandular trichome at secretory stage, a large number of secretory vesicles (arrow) carrying the osmiophilic material beside the cell membrane; J: Peltate glandular trichome at secretory stage, showing secretory substances in the subcuticular space (SCS). Bars: A=1 μm; B-E=2 μm; F= 5 μm; G=7 μm; H=200 nm; I=100 nm; J=500 nm |
头状腺毛由1个基细胞、1个柄细胞和1或2个分泌细胞的头部组成(图 3: E)。纵切面观有2种形态。一种头部呈扁球形,由双细胞组成(图 2: B),基细胞纵向延长,呈短棒状,柄细胞略横向延长, 呈长方形,具大液泡,细胞质稀少(图 3: E),此类头状腺毛更普遍;另一种头部呈椭圆形,由1个分泌细胞组成(图 2:C),基细胞、柄细胞与前者基本相似。成熟的头状腺毛具有角质层下间隙(图 3: E)。
盾状腺毛由1或2个基细胞、1个柄细胞和4~8个分泌细胞排列成1层而形成宽大头部(图 2: D, 图 3: F, G)。盾状腺毛基细胞(纵切面观)略呈长方形, 液泡大, 柄细胞通常呈扁平状,也有呈方形的, 细胞质浓厚, 液泡不明显(图 3: D)。头部分泌细胞具大液泡或几个分散的液泡(图 3: F),成熟的盾状腺毛具有角质层下间隙,随着分泌物的增多,角质层间隙越大(图 3: G)。
2.2 盾状腺毛分泌过程的超微结构由于盾状腺毛是分泌挥发油的最主要场所,本文仅描述盾状腺毛分泌过程中的典型特征。
分泌前期,盾状腺毛的头部经历了2、4、8个分泌细胞的时期。在2细胞和4细胞时期,前质体仍比较小,形似变形虫且含有少量的嗜锇滴;内质网、高尔基体相对较少;角质层已经形成但不明显。当头部分裂成8细胞时,质体体积扩大,内质网开始增多,与质膜及质体平行排列,且频繁出现在细胞质的外围(图 3: F, H),成为此时期的主要特征。
分泌期,盾状腺毛的体积扩大,头部细胞分布着许多大小不一的液泡;质体继续增大,内质网仍然非常丰富,分布在整个细胞质中;高尔基体少。嗜锇物质(分泌小泡)出现在细胞质膜附近(图 3: I)。角质层空隙充满了分泌物(图 3: J)。
分泌后期,盾状腺毛的角质层下间隙进一步扩大,头部分泌细胞严重退化萎缩,细胞器也进一步退化变形(图 3: G)。
3 讨论头状和盾状腺毛在外形上的多样性被视为唇形科植物的分类特征。一般来说,头状腺毛的头部呈圆形到梨形,有1~2个分泌细胞,但不同种植物的头状腺毛的柄细胞长度不同[3]。盾状腺毛柄细胞较扁平,有宽大的或圆形的头部,直径60~90 μm,高约60 μm,其头部常由4~8个分泌细胞组成一简单的盾状或球形的盘体[5-6],或者由12~18个分泌细胞排成同一中心的环行盘[7-8]。
线纹香茶菜和某些唇形科植物的腺毛在类型和结构上较为类似,如薄荷(Mentha haplocalyx)[9-10]、羽叶薰衣草(Lavandula pinnata)[11]等均由头状腺毛和盾状腺毛组成,头状腺毛由1个基细胞、1个柄细胞和1个或2个头部分泌细胞构成;盾状腺毛由1或2个基细胞、1个柄细胞和4~8个分泌细胞构成头部。但线纹香茶菜的盾状腺毛头部细胞的直径约45 μm,普遍小于所报道的60~90 μm。此外,线纹香茶菜大部分腺毛在自然状态下呈红色,少部分为无色透明状,红色基本为盾状腺毛,无色透明的为头状腺毛。然而,大部分唇形科植物的盾状腺毛为无色透明状,而线纹香茶菜红色的盾状腺毛是区别于其他植物腺毛的显著特征,也很可能是其揉之带黄色汁液的原因之一。
根据我们对线纹香茶菜茎、叶上两类腺毛发生发育过程的观察,盾状腺毛和头状腺毛的原始细胞都来源于叶或茎的原表皮细胞,两类腺毛的早期发育相同,先由腺毛原始细胞经1次平周分裂形成2-细胞时期,再由顶细胞经1次平周分裂,形成线状排列的3个细胞,既基细胞、柄细胞和头细胞。以后的发育过程与前人报道[9, 11]的基本一致,认为柄细胞的分化状态决定了两类腺毛的发育,推测柄细胞的分化状态直接影响到头部细胞所处的分化状态。若柄细胞形成后迅速延长并液泡化,其3-细胞时期的顶细胞则不再分裂,形成单个分泌细胞构成头部的头状腺毛;若柄细胞保持分生状态,则头部细胞也将保持分生状态,3-细胞时期的顶细胞将继续进行垂周分裂,形成盾状腺毛。由此可见,柄细胞的分化状态影响腺毛的后期发育,决定3-细胞时期的腺毛分化为头状或盾状腺毛。
在唇形科植物的相关研究中,大部分都认为盾状腺毛为挥发油及萜类物质产生的主要结构,腺毛密度越高,其挥发油含量越大[12-13]。扫描电镜观察到线纹香茶菜叶上密布盾状腺毛,说明其挥发油含量较高。化学成分测定结果也充分印证了这点。线纹香茶菜的化学成分主要为挥发油类,占总成分的70%以上,其中萜类物质是主要药效成分之一[14]。
早期研究报道,唇形科腺毛的脂类物质合成位点可以是液泡[15]、质体[16]、或者是光滑内质网[17];还有报道提出精油是在质体中合成产生的,但是通过光滑内质网转运的[18]。在本研究中,尽管我们未观察到光滑内质网,但腺毛在分泌期及分泌后期腺毛分泌细胞中的粗面内质网非常丰富,推测粗面内质网很可能在萜类物质的合成与分泌中扮演着重要的角色[10, 19]。
本文首次报道了线纹香茶菜的腺毛形态结构, 可为溪黄草物种及品种的鉴定与开发提供一定的参考。线纹香茶菜的红色腺毛很可能是由其腺毛所分泌的化合物性质所决定,其潜藏的机理值得深究,腺毛中分泌物化学成分究竟如何?其萜类代谢途径有何差异?可成为今后的研究方向。
致谢: 本文所采集的线纹香茶菜样品由中国科学院华南植物园叶华谷研究员鉴定,特此感谢。| [1] |
Xiao S X, YANG Q C, LÜ H. The source of "Xihuangcao" and distinguish from adulterant[J].
J Chin Med Mat, 1993, 16(6): 24-26. 肖树熊, 杨启存, 吕红. 溪黄草的来源及与混淆品的鉴别[J]. 中药材, 1993, 16(6): 24-26. DOI:10.13863/j.issn1001-4454.1993.06.012 |
| [2] | SUDRÍA C, PALAŹON J, CUSIDÓ R, et al. Effect of benzyla-denine and indolebutyric acid on ultrastructure, glands formation, and essential oil accumulation in Lavandula dentata plantlets[J]. Biol Plant, 2001, 44(1): 1-6. DOI:10.1023/A:1017998800224 |
| [3] | HUANG S S, KIRCHOFF B K, LIAO J P. The capitate and peltate glandular trichomes of Lavandula pinnata L.(Lamiaceae):Histo-chemistry, ultrastructure, and secretion[J]. J Torrey Bot Soc, 2008, 135(2): 155-167. DOI:10.3159/07-RA-045.1 |
| [4] | GERSBACH P V. The essential oil secretory structures of Prostanthera ovalifolia (Lamiaceae)[J]. Ann Bot, 2002, 89(3): 255-260. DOI:10.1093/aob/mcf033 |
| [5] | ASCENSÃO L, MOTA L, CASTEO M D M. Glandular trichomes on the leaves and flowers of Plectranthus ornatus:Morphology, distribution and histochemistry[J]. Ann Bot, 1999, 84(4): 437-447. DOI:10.1006/anbo.1999.0937 |
| [6] | ANTUNES T, SEVINATE-PINTO I. Glandular trichomes of Teucrium scorodonia L.morphology and histochemistry[J]. Flora, 1991, 185(1): 65-70. DOI:10.1016/S0367-2530(17)30445-0 |
| [7] | SERRATO-VALENTI G, BISIO A, CORNARA L, et al. Structural and histochemical investigation of the glandular trichomes of Salvia aurea L.leaves, and chemical analysis of the essential oil[J]. Ann Bot, 1997, 79(3): 329-336. DOI:10.1006/anbo.1996.0348 |
| [8] | WERKER E, RAVID U, PUTIEVSKY E. Glandular hairs and their secretions in the vegetative and reproductive organs of Salvia sclarea and S.dominica[J]. Israel J Bot, 1985, 34(2/3/4): 239-252. |
| [9] |
YAN X X, WANG X L, HU Z H. A study on developmental anatomy of two kinds of glandular hairs on the leaves of Mentha haplocalyx Brig[J].
J Shandong Agric Univ (Nat Sci), 2000, 31(2): 157-160. 闫先喜, 王晓理, 胡正海. 薄荷叶两种腺毛的发育解剖学研究[J]. 山东农业大学学报(自然科学版), 2000, 31(2): 157-160. DOI:10.3969/j.issn.1000-2324.2000.02.010 |
| [10] | TURNER G W, GERSHENZON J, CROTEAU R B. Develop-ment of peltate glandular trichomes of peppermint[J]. Plant Physiol, 2000, 124(2): 665-680. DOI:10.1104/pp.124.2.665 |
| [11] |
HUANG S S, LIAO J P, WU Q G. Developmental anatomy of trichomes in Lavandula pinnata L.[J].
J Trop Subtrop Bot, 2006, 14(2): 134-140. 黄珊珊, 廖景平, 吴七根. 羽叶薰衣草表皮毛的发育解剖学研究[J]. 热带亚热带植物学报, 2006, 14(2): 134-140. DOI:10.3969/j.issn.1005-3395.2006.02.008 |
| [12] | CLARK L J, HAMILTON J G G, CHAPMAN J V, et al. Analysis of monoterpenoids in glandular trichomes of the catmint Nepeta racemosa[J]. Plant J, 1997, 11(6): 1387-1393. DOI:10.1046/j.1365-313X.1997.11061387.x |
| [13] | WERKER E, RAVID U, PUTIEVSKY E. Structure of glandular hairs and identification of the main components of their secreted material in some species of the Labiatae[J]. Israel J Bot, 1985, 34(1): 31-45. |
| [14] |
YE Q X, JIANG D X, XIONG Y H, et al. Chemical constituents in essential oil from Isodon serra Ku Du, I.lophanthoids var.gerardianus Hara and I.striatus assayed by GC-MS[J].
Chin Trad Patent Med, 2006, 28(10): 1482-1484. 叶其馨, 蒋东旭, 熊艺花, 等. GC-MS测定溪黄草、狭基线纹香茶菜及线纹香茶菜挥发油的化学成分[J]. 中成药, 2006, 28(10): 1482-1484. DOI:10.3969/j.issn.1001-1528.2006.10.027 |
| [15] | HANLIDOU E, KOKKINI S, BOSABALIDIS A M, et al. Glandular trichomes and essential oil constituents of Calamintha menthifolia (Lamiaceae)[J]. Plant Syst Evol, 1991, 177(1/2): 17-26. DOI:10.1007/BF00937823 |
| [16] | AMELUNXEN F. Elektronenmikroskopische untersuchungen an den drüsenschuppen von Mentha piperita L.[J]. Plant Med, 1965, 12(4): 457-473. DOI:10.1055/s-0028-1100141 |
| [17] | AKERS C P, WEYBREW J A, LONG R C. Ultrastructure of glandular trichomes of leaves of Nicotiana tabacum L., cv Xanthi[J]. Amer J Bot, 1978, 65(3): 282-292. DOI:10.2307/2442269 |
| [18] | SCHNEPF E. Tubuäires endoplasmatisches reticulum in drüsen mit lipophilen ausscheidungen von Ficus, Ledum und Salvia[J]. Biochem Physiol Pflanzen, 1972, 163(2): 113-125. DOI:10.1016/S0015-3796(17)31214-3 |
| [19] | VALKAMA E, SALMINEN J P, KORICHEVA J, et al. Compa-rative analysis of leaf trichome structure and composition of epicuticular flavonoids in Finnish birch species[J]. Ann Bot, 2003, 91(6): 643-655. DOI:10.1093/aob/mcg070 |
 2018, Vol. 26
2018, Vol. 26

