2. 安徽省重要生物资源保护与利用研究重点实验室, 安徽 芜湖 241000
2. Key Laboratory of Conservation and Employment of Biological Resources of Anhui, Wuhu 241000, Anhui, China
由于环境变化和人为因素对大自然的影响导致物种的生境片断化严重,生境片断化会引起生境小气候、边缘效应等生物与非生物条件的变化,从而影响种间基因交流、居群存活力、物种间相互作用及其一系列的生态过程,是导致生物多样性下降与物种濒危、灭绝的主要原因之一[1-2]。相对于动物的灵活移动能力,植物因其固着性而更容易遭受生境片段化的影响[3],而形成核心和边缘居群(前者指位于物种分布区的中心区域,后者位于物种分布区的边缘区域)[4]。通常认为核心居群一般占据物种分布适宜的生境,个体生长和繁殖状况较好[5];而边缘居群占据的生境质量通常较差及传粉缺乏等, 因而会经历更多的居群大小的波动和瓶颈效应[6], 因而居群规模一般会较小,个体生长和繁殖状况也较差,物种的多度和密度等较之于核心居群都在减少[7],这也就是所谓的“中心丰富模型”(abundant center model)假说,它对关于物种分布范围上的生态和进化问题的有关论点产生了深远影响[8]。但“中心丰富模型”假说还存在较大的争议[9-12],仍需要进一步研究与验证。
二型花柱(distyly)是指同一个居群内存在长柱花(long-styled flower)和短柱花(short-styled flower)两种花型,是最常见的一种雌雄蕊异位,现至少有23科植物存在二型花柱现象,其维持机制和自然选择压力一直是生态学和进化学研究领域的热点之一[13]。交互式雌雄异位(即长柱花的雌蕊和短柱花的雄蕊位于同一高位水平,而长柱花的雄蕊则和短柱花的雌蕊位于同一低位水平)是二型花柱植物花部性状的重要特征[14],它能有效地促进异交、防止自交和性器官之间的干扰[15-16]。二型花柱植物花朵的雌雄蕊是分离的,授粉过程需要传粉昆虫的参与,再加上花朵形态特征,尤其是性器官之间相互位置微小的改变都可能会对其适应进化产生深远的影响,因此对生境的片断化及边缘效应更为敏感[17]。但有关二型花柱植物的核心、边缘居群形态变异式样至今未见研究报道。
安徽羽叶报春(Primula merrilliana)隶属于报春花科(Primulaceae)报春花属,是一种典型的二型花柱植物[18],花色艳丽、花期长、具较高的园艺开发价值[19]。安徽羽叶报春是我国特有的珍稀濒危(VU级)物种,现仅分布于安徽省南部山区[20],近年来由于环境变化和人类活动的影响,其野生居群的数量和个体数量日趋减少,生境片段化严重,形成了明显的核心和边缘居群[21]。因此,本文拟通过对安徽羽叶报春边缘和核心居群形态变异进行研究,重点研究花部特征的变异,尤其是其雌雄蕊异位的互惠程度[22], 为“中心丰富模型”假说提供二型花柱植物的实证性研究资料,同时为该濒危植物的保护提供参考。
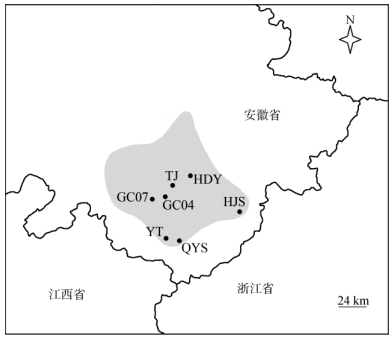
1 材料和方法 1.1 材料2016年3-4月份,在安徽羽叶报春盛花期前往其分布区进行调查采样,共采集了7个居群,其中4个核心居群和3个边缘居群(图 1, 表 1)。每个居群随机挑选24株健康植株(长柱花和短柱花各12株),YT居群由于规模较小,仅取了14株, 采样时每株间隔3 m以上。
|
图 1 安徽羽叶报春7个采样居群的地理分布图。阴影为物种的分布区; 居群TJ、HDY、GC07、GC04、HJS、YT、QYS见表 1。 Fig. 1 Distribution of 7 sampled populations of Primula merrilliana. The shadow shows the distribution area of this species; populations TJ, HDY, GC07, GC04, HJS, YT and QYS see Table 1. |
| 表 1 安徽羽叶报春采样居群信息 Table 1 Information of Primula merrilliana sampled populations |
新鲜植株测量(或计数)叶片数、花葶数、花朵数。取最长叶统计小羽片数,并用游标卡尺测量叶长和叶宽;随机挑选最长花葶上盛开的花朵1枚, 小心纵向解剖花筒后拍照(附标准比例尺),在Photoshop软件中测量花冠直径、花瓣宽、花柱高、花药高、花筒高(图 2)。

|
图 2 安徽羽叶报春花部性状测量示意图。AH:花药高度; SH:花柱高度; TL:花筒长; CD:花冠直径; CLW:花瓣宽。 Fig. 2 Schematic diagram of floral traits of Primula merrilliana. AH: Anther height; SH: Stigma height; TL: Cylinder length; CD: Corolla diameter; CLW: Petal width. |
采用Excel计算形态性状的均值和变异系数,利用SPSS 19.0软件进行单因素方差分析,比较边缘与核心居群间形态性状的差异,采用Sánchez的方法评估居群内雌雄蕊间的互惠指数[23],计算公式如下:
| $ {r_{\rm{a}}} = \frac{{\sum\limits_i^n {\sum\limits_j^m {\left( {\frac{{\left| {{E_i} - {S_j}} \right|}}{{\overline X }}} \right)} } }}{{nm}} $ | (1) |
| $ r = \sqrt {\left[ {{{\left( {\frac{{\sum\limits_i^n {\sum\limits_j^m {\left( {\frac{{\left| {{E_i} - {S_j}} \right|}}{{\overline X }}} \right)} } }}{{nm}}} \right)}^2} + {{\left( {\frac{{\sum\limits_l^p {\sum\limits_k^q {\left( {\frac{{\left| {{e_l} - {s_k}} \right|}}{{\overline X }}} \right)} } }}{{pq}}} \right)}^2}} \right]} $ | (2) |
| $ {r_{\rm{a}}} = \sqrt {\left[ {{{\left( {{r_{\rm{L}}}} \right)}^2} + {{\left( {{r_{\rm{S}}}} \right)}^2}} \right]} $ | (3) |
| $ sd{r_{\rm{a}}} = \sqrt {\left[ {\frac{{\sum\limits_i^n {\sum\limits_j^m {{{\left[ {\left( {\frac{{\left| {{E_i} - {S_j}} \right|}}{{\overline X }}} \right) - {r_{\rm{a}}}} \right]}^2}} } }}{{nm}}} \right]} $ | (4) |
| $ sdr = (sd{r_{\rm{L}}} + sd{r_{\rm{S}}})/2 $ | (5) |
| $ R = 1 - (r \times sdr \times 10) $ | (6) |
部分公式用Microsoft Visual c++ 6.0软件编程计算,式中E为短柱花雄蕊高度,S为长柱花雌蕊高度,e为长柱花雄蕊高度,s为短柱花雌蕊高度, n为居群内短柱花雄蕊数、m为居群内长柱花雌蕊数,p为居群内长柱花雄蕊数,q为居群内短柱花雌蕊数,X表示居群内雌雄蕊高度均值,ra为居群内雌雄蕊在某一位置的相对互惠均值,rL为居群内雌雄蕊在高位水平相对互惠均值,rS为居群内雌雄蕊在低位水平相对互惠均值,r为居群的总体互惠,sdra为雌雄蕊在某一位置高度差的标准偏差,sdrL为雌雄蕊在高位水平高度差的标准偏差,sdrS为雌雄蕊在低位水平高度差的标准偏差,sdr为居群雌雄蕊在不同位置水平上高度差的标准偏差的均值,R为居群总体互惠指数[22-23]。
2 结果和分析安徽羽叶报春7个自然居群的14个形态性状均存在显著差异,仅边缘居群的花瓣宽均大于核心居群,其他性状则无此规律。叶形态性状中羽片数、叶数以TJ居群最高,叶长、叶宽以QYS居群最高。雌雄蕊性状中,长柱花雌蕊高、雄蕊高、花筒长和短柱花雌蕊高均以GC07居群最高,而短柱花雄蕊高和花筒长以TJ居群最高;花朵性状中,花冠直径、花瓣宽以QYS居群最高, 花葶数、花朵数以TJ居群最高。14个形态性状的最大均值有10个来自核心居群,4个来自边缘居群(表 2)。
| 表 2 安徽羽叶报春不同居群的形态特征 Table 2 Morphological characteristics of Primula merrilliana in different populations |
核心居群的14个形态性状的变异系数为0.09~0.50,其中花朵数的变异系数(0.50)最大,其次为花葶数(0.46)和叶数(0.40),长柱花雄蕊高的变异系数(0.09)最小。边缘居群14个形态性状的变异系数为0.05~0.56,其中花朵数的变异系数(0.56)最大,其次为花葶数(0.53)和叶数(0.38),短柱花雄蕊高的变异系数(0.05)最小。边缘居群和核心居群形态性状的变异幅度差异不显著(表 3)。14个性状中叶片长、长柱花花筒长和花药高在两种居群间差异不显著,而边缘居群的花冠直径、花瓣宽和叶宽均值显著高于核心居群,其他8个性状(叶片数、羽片数、花葶数、花朵数、长柱花花柱及花药高、短柱花筒长、花柱及花药高)的均值都是核心居群显著大于边缘居群(表 3)。
| 表 3 安徽羽叶报春核心居群和边缘居群的形态特征 Table 3 Comparison of morphological characteristics between core and peripheral populations |
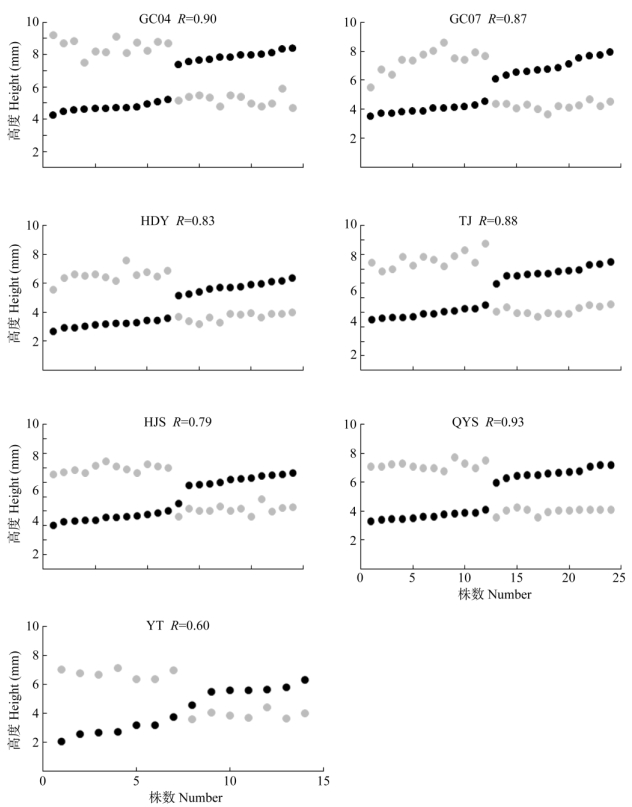
采用Sánchez[23]的方法评估了安徽羽叶报春核心和边缘地区各居群内雌雄蕊间的互惠值(R),核心地区各居群的R为0.83~0.90,居群间差别不大(图 3),表明核心地区各居群内两型花间雌雄蕊的位置互惠程度相对较高,偏离交互式雌雄异位的程度低,空间位置的变异较小较稳定,未见明显过渡类型的个体(即无明显介于长柱和短柱之间的花柱长)存在。而边缘地区各居群的R为0.60~0.93,居群间差别较大(图 3),QYS居群的R为0.93,互惠程度较高,而HJS和YT居群分别为0.79和0.60,互惠程度较差,有明显的过渡个体存在,边缘地区各居群内雌雄蕊位置的变异程度大小不一,互惠值不稳定。
|
图 3 安徽羽叶报春实验居群花柱和花药高散点图。    |
表型变异是植物适应环境变化的直接表现,也是影响其生存的主要因素之一[1, 24]。本文对安徽羽叶报春核心和边缘居群14个形态性状进行了比较研究,结果表明核心居群和边缘居群各形态性状都存在一定程度的变异,其中花朵大小和花部空间结构的变异相对于其他形态性状变异较小、较稳定(变异系数为0.05~0.13),这可能主要是花部性状与传粉者之间长期相互适应性选择,限制了其趋异变化;而营养器官性状及花葶数和花朵数变异较大(变异系数为0.18~0.56),尤其是花葶数和花朵数的变异系数均大于0.45,表明这些性状可能更容易受环境中水分、养分和光照等的影响。此外14个形态性状的均值除花冠直径、花瓣宽和叶宽3个性状外,其他11个性状的均值都是核心居群大于边缘居群,且有8个性状的差异显著。这与秦岭冷杉(Abies chensiensis)和蓖齿眼子菜(Stuckenia pectinata)形态性状的研究结果相似[9-10],支持“中心丰富模型”假说,即分布区中央的居群往往位于生境的适宜区, 居群规模较大,物种的生长和繁殖状况也较好[5], 从而多个性状如叶片数、花葶数、花朵数等体现繁殖力的性状也明显好于边缘居群[25]。但有意思的是,也有部分性状如花冠直径和花瓣宽却表现出边缘居群的优于核心居群的,这可能是由于边缘居群位于分布区边缘,生存的环境质量较差,居群规模也较小,再加上边缘区域传粉昆虫也可能较缺乏, 因而其在生殖构件的数量上要减少(即花葶数和花朵数减少),而增加对花朵显著度上的投入(即花冠直径和花瓣宽增大),以增加吸引传粉昆虫的能力,尤其是对于选型交配的二型花柱植物来说,有利于保障其边缘居群个体的繁殖成功。
3.2 交互式雌雄异位的偏离对二型花柱植物的影响二型花柱植物两种花型的雌雄蕊交互式异位匹配程度是关系到居群繁殖及两花型维持的重要指标,其评估方法有多种,早在1993年Richards、Koptur和1994年Eckert、Barret就提出了相关的计算方法,但这些方法都存在一些不足,如没有考虑到居群内个体变异或计算结果不够精确等[22]。Sánchez在2013年对计算方法加以改进,解决了以前所存在的问题,提出用互惠指数R的大小来表示两花型雌雄蕊交互匹配的程度,R值越大表示雌雄蕊间的互惠(匹配)程度越高[23],将会提高二型花柱植物花粉的精确传递、促进居群内非选型交配的机会[26];R值越小表示雌雄蕊间的互惠程度越低,将会导致二型花柱植物自交和型内自交的发生及型比偏离[17],造成花粉折损,降低花型间花粉传递效率[27]。
本研究中,核心地区各居群的R均值为0.87, 相对较大,与Keller[27]对3种报春花Primula elatior、P. veris和P. vulgaris以及Brys[17]对P. veris草地居群的研究结果(R值分别为0.84、0.90、0.85和0.88)相近,表明安徽羽叶报春核心居群二型花柱的花部特征维持较好,有利于花型间的传粉。而边缘地区各居群的R均值为0.77,相对较小,且大小不一, 其中YT和HJS居群仅为0.60和0.79,这有可能是边缘居群规模变化较大,遗传漂变和瓶颈效应的影响,从而导致雌雄异位发生较大偏离,互惠指数下降。而齐云山居群虽位于分布区边缘,但R值却最大(为0.93),这可能是由于齐云山居群并不是处于生态位的边缘,即生境也较适宜导致的。QYS居群的其他指标如叶片数、花葶数和花朵数均与核心居群的接近,明显高于另两个边缘居群,这也进一步支持其并不处于生态位的边缘。
3.3 保护建议安徽羽叶报春具有二型花柱,但其与大多数植物相似,也表现出了核心居群的多数形态学性状优于边缘居群,尤其是互惠指数,其核心居群较稳定,互惠程度较高。核心居群的自然生存状况本身较好,如果能得到相应的保护,生境不被破坏,其居群应该能够较好地自我维持。而边缘居群处于相对隔离状态,生境质量较差,经受着较极端的选择压力,因而通常在遗传学和形态学上与核心居群有较大差异。这种差异的定向选择压力推动着边缘居群的局部适应和遗传分化,从而可能包含着易变的、极端的环境条件下进化而来的新基因,这对于物种长期的生存与进化,尤其是在环境变化的情况下(如气候)物种维持是至关重要的,而且边缘居群也是新物种形成的一个重要来源[28-30],因此边缘居群有时也具有很高的保护价值。本研究安徽羽叶报春边缘居群的生境及生长状况与核心居群相比较差,边缘各居群仅花瓣宽均值大于核心居群,因此边缘居群的性状变异比较复杂,针对不同的居群保护策略也应不同,如边缘的QYS居群,其叶数、花葶数和花朵数均与核心居群相似,尤其是互惠值指数为0.93,两型花间维持着较高的互惠性,居群的自然更新能力也应较好,因此对它的保护重点同核心居群一样,应加强生境的保护。而HJS和YT两个边缘居群,其叶数、花葶数及花朵数明显减少,尤其是其互惠指数分别为0.79和0.60,表明互惠程度也较差,因此其自然更新能力也较弱,除了保护其现有的生境不被破坏外,应重点加强对其居群的复壮,如盛花期适当辅以居群内人工异型花授粉,以提高其结籽率。
| [1] | WILSON M C, CHEN X Y, CORLETT R T, et al. Erratum to:Habitat fragmentation and biodiversity conservation:Key findings and future challenges[J]. Landsca Ecol, 2016, 31(2): 229-230. DOI:10.1007/s10980-015-0322-1 |
| [2] | FAHRIG L. Effects of habitat fragmentation on biodiversity[J]. Annu Rev Ecol Evol Syst, 2003, 34(1): 487-515. DOI:10.1146/annurev.ecolsys.34.011802.132419 |
| [3] | HEINKEN T, WEBER E. Consequences of habitat fragmentation for plant species:Do we know enough?[J]. Perspect Plant Ecol, 2013, 15(4): 205-216. DOI:10.1016/j.ppees.2013.05.003 |
| [4] | WANG Y Q, ZHANG Z B, XU L X. The genetic diversity of central and peripheral populations of Ratlike hamster (Cricetulus triton)[J]. Chin Sci Bull, 2002, 47(3): 201-206. DOI:10.1360/02tb9048 |
| [5] | HUANG Z, LIU N, ZHOU T. A comparative study of genetic diversity of peripheral and central populations of Chukar partridge from north-western China[J]. Biochem Genet, 2005, 43(11/12): 613-621. DOI:10.1007/s10528-005-9118-3 |
| [6] | ECKERT C G, SAMIS K E, LOUGHEED S C. Genetic variation across species' geographical ranges:The central-marginal hypothesis and beyond[J]. Mol Ecol, 2008, 17(5): 1170-1188. DOI:10.1111/j.1365-294X.2007.03659.x |
| [7] | JOHANNESSON K, ANDR C. Life on the margin:genetic isolation and diversity loss in a peripheral marine ecosystem, the Baltic Sea[J]. Mol Ecol, 2006, 15(8): 2013-2029. DOI:10.1111/j.1365-294X.2006.02919.x |
| [8] | SAGARIN R D, GAINES S D. The 'abundant centre' distribution:To what extent is it a biogeographical rule?[J]. Ecol Lett, 2002, 5(1): 137-147. DOI:10.1046/j.1461-0248.2002.00297.x |
| [9] |
SUN Y L, LI Q M, YANG J Y, et al. Morphological variation in cones and seeds in Abies chensiensis[J].
Acta Ecol Sin, 2005, 25(1): 176-181. 孙玉玲, 李庆梅, 杨敬元, 等. 秦岭冷杉球果与种子的形态变异[J]. 生态学报, 2005, 25(1): 176-181. DOI:10.3321/j.issn:1000-0933.2005.01.027 |
| [10] | SANTAMARÍA L, FIGUEROLA J, PILON J J, et al. Plant perfor-mance across latitude:The role of plasticity and local adaptation in an aquatic plant[J]. Ecology, 2003, 84(9): 2454-2461. DOI:10.1890/02-0431 |
| [11] | KLUTH C, BRUELHEIDE H. Central and peripheral Hornungia petraea populations:Patterns and dynamics[J]. J Ecol, 2005, 93(3): 584-595. DOI:10.1111/j.1365-2745.2005.00997.x |
| [12] | HERLIHY C R, ECKERT C G. Evolution of self-fertilization at geographical range margins? A comparison of demographic, floral, and mating system variables in central vs. peripheral populations of Aquilegia canadensis (Ranunculaceae)[J]. Amer J Bot, 2005, 92(4): 744-751. DOI:10.3732/ajb.92.4.744 |
| [13] | BARRETT S C H, JESSON L K, BAKER A M. The evolution and function of stylar polymorphisms in flowering plants[J]. Ann Bot, 2000, 85(A): 253-265. DOI:10.1006/anbo.1999.1067 |
| [14] | ZHOU W, BARRETT S C H, WANG H, et al. Reciprocal herkogamy promotes disassortative mating in a distylous species with intramorph compatibility[J]. New Phytol, 2015, 206(4): 1503-1512. DOI:10.1111/nph.13326 |
| [15] | LLOYD D G, WEBB C J. The evolution of heterostyly[M]//BARRETT S C H. Evolution and Function of Heterostyly. Berlin, Heidelberg: Springer, 1992: 151-178. doi: 10.1007/978-3-642-86656-2_6. |
| [16] | LAU P, BOSQUE C. Pollen flow in the distylous Palicourea fendleri (Rubiaceae):An experimental test of the disassortative pollen flow hypothesis[J]. Oecologia, 2003, 135(4): 593-600. DOI:10.1007/s00442-003-1216-5 |
| [17] | BEYS R, JACQUEMYN H. Disruption of the distylous syndrome in Primula veris[J]. Ann Bot, 2015, 115(1): 27-39. DOI:10.1093/aob/mcu211 |
| [18] | SHAO J W, WU Y F, KAN X Z, et al. Reappraisal of Primula ranunculoides (Primulaceae), an endangered species endemic to China, based on morphological, molecular genetic and reproductive characters[J]. Bot J Linn Soc, 2012, 169(2): 338-349. DOI:10.1111/j.1095-8339.2012.01228.x |
| [19] |
GUO X H. The history of discovery and reserch on the plants of Primula L. from Anhui, China[J].
J Fuyang Teach Coll (Nat Sci), 1992(2): 28-29. 郭新弧. 安徽报春花属Primula L.植物的发现和研究史[J]. 阜阳师范学院学报(自然科学版), 1992(2): 28-29. |
| [20] |
DU D D, SHAO J W. Research status and outlook of Primula merrilliana, an endangered species endemic to China[J].
J Anhui Norm Univ (Nat Sci), 2010, 33(6): 562-565. 杜丹丹, 邵剑文. 中国特有濒危植物安徽羽叶报春的研究现状及展望[J]. 安徽师范大学学报(自然科学版), 2010, 33(6): 562-565. DOI:10.3969/j.issn.1001-2443.2010.06.014 |
| [21] | SHAO J W, WANG J, XU Y N, et al. Genetic diversity and gene flow within and between two different habitats of Primula merrilliana (Primulaceae), an endangered distylous forest herb in eastern China[J]. Bot J Linn Soc, 2015, 179(1): 172-189. DOI:10.1111/boj.12305 |
| [22] | SANCHEZ J M, FERRERO V, NAVARRO L. A new approach to the quantification of degree of reciprocity in distylous (sensu lato) plant populations[J]. Ann Bot, 2008, 102(3): 463-472. DOI:10.1093/aob/mcn111 |
| [23] | SÁNCHEZ J M, FERRERO V, NAVARRO L. Quantifying reciprocity in distylous and tristylous plant populations[J]. Plant Biol, 2013, 15(3): 616-620. DOI:10.1111/j.1438-8677.2012.00720.x |
| [24] |
WANG H Q, XU Z, QI J. A Comparative study on morphological variation of four species in Elymus L.[J].
Chin J Grassland, 2009, 31(3): 30-35. 王海清, 徐柱, 祁娟. 披碱草属四种植物主要形态特征的变异性比较[J]. 中国草地学报, 2009, 31(3): 30-35. |
| [25] | SHAO J W, ZHANG X P, ZHANG Z X, et al. Effects of population size on reproductive success of the endangered and endemic species Primula merrilliana[J]. J Integr Plant Biol, 2008, 50(9): 1151-1160. DOI:10.1111/j.1744-7909.2008.00655.x |
| [26] |
LI D X, REN Z X, WU Z K, et al. Variation in floral traits of distylous Primula poissonii (Primulaceae) along geographic gradients[J].
Biodiv Sci, 2015, 23(6): 747-758. 李海东, 任宗昕, 吴之坤, 等. 二型花柱植物海仙花报春花部性状随地理梯度的变异[J]. 生物多样性, 2015, 23(6): 747-758. DOI:10.17520/biods.2015171 |
| [27] | KELLER B, de VOS J M, CONTI E. Decrease of sexual organ reciprocity between heterostylous primrose species, with possible functional and evolutionary implications[J]. Ann Bot, 2012, 110(6): 1233-1244. DOI:10.1093/aob/mcs199 |
| [28] | HAMPE A, PETIT R J. Conserving biodiversity under climate change:The rear edge matters[J]. Ecol Lett, 2005, 8(5): 461-467. DOI:10.1111/j.1461-0248.2005.00739.x |
| [29] | ROSSUM F V, VEKEMANS X, GRATIA E, et al. A comparative study of allozyme variation of peripheral and central populations of Silene nutans L. (Caryophyllaceae) from western Europe:Implications for conservation[J]. Plant Syst Evol, 2003, 242(1/2/3/4): 49-61. DOI:10.1007/s00606-003-0049-3 |
| [30] | OSBORNE M, SHARP A, MONZINGO J, et al. Genetic analysis suggests high conservation value of peripheral populations of Chihua-hau chub (Gila nigrescens)[J]. Conserv Genet, 2012, 13(5): 1317-1328. DOI:10.1007/s10592-012-0374-6 |
 2018, Vol. 26
2018, Vol. 26


