羯布罗香(Dipterocarpus turbinatus Gaertn. F.)别名油树、龙脑香等,是龙脑香科(Dipterocarpaceae)常绿大乔木,为云南培育大径材的珍贵用材树种[1]。其树干能分泌树脂,是提制龙脑、冰片和芳香油的原料[2],同时也可作药用,具有清火解毒、杀虫止痒、凉血止血的功效[2]。羯布罗香是典型的热带雨林树种,其种子不耐干燥和低温[3],属顽拗性种子,常规方法只能保存3~4个月。超低温保存是长期、稳定、有效保存顽拗性种子的最适方法[4],本研究以羯布罗香种子为材料,运用不同的冷冻方式,对种胚进行液氮超低温保存,探讨液氮冷冻过程中种子发芽率、α-淀粉酶、脱氢酶、过氧化氢酶、过氧化物酶活性、丙二醛含量等生理生化指标变化的内在变化规律;并通过显微观察液氮处理的种子结构变化,探究超低温冷冻对种子结构的影响,为羯布罗香种质资源保护提供技术基础。
1 材料和方法 1.1 材料成熟的羯布罗香(Dipterocarpus turbinatus Gaertn. F.)种子采自云南省西双版纳南药园,由国家南药基因资源库提供,初始含水量为60%,生活力100%,发芽率为90%,将种子含水量降至45%左右密封保存于4℃冰箱中备用。试验材料为含水量45%的羯布罗香种胚块。
1.2 种子含水量测定将种子放于盛有硅胶的干燥器中干燥6 h,采用《国家农作物种子检验规程——水分测定》中的高温烘干法测定种子含水量。
1.3 种胚超低温冷冻采用快速冷冻、玻璃化冷冻和缓慢冷冻3种方法对含水量45%的羯布罗香种胚进行液氮超低温保存试验。快速冷冻是将种胚块放入冻存管中直接投入液氮中保存;玻璃化冷冻是将含有种胚的种子块放入装载液LS (含2 mol L–1甘油+0.4 mol L–1蔗糖的MS液体培养基)中,室温浸润20 min后,倒掉LS,添加玻璃化冷冻保护剂PVS2 (含30%甘油+ 15%乙二醇+15%二甲亚砜+0.4 mol L–1蔗糖),置于冰上处理30 min,倒出PVS2,添加新鲜的PVS2 (0℃), 迅速投入液氮罐中保存。缓慢冷冻是将PVS2 (25℃)浸润的种胚块置于4℃冰箱中,0.5 h后取出,立即放入-20℃冰柜中1 h,然后迅速投入液氮中。
1.4 解冻和生活力测定分别取出液氮冻存1、5、14 d的种胚块,用40℃水浴解冻2 min。将玻璃化冷冻和缓慢冷冻处理的种胚用洗涤液US (含1.2 mol L–1蔗糖的MS培养液)洗涤3次,每次5 min,再用无菌水洗涤2次, 每次10 min。然后采用2, 3, 5-三苯基氯化四氮唑(TTC)测定法检测其生活力,用1%的TTC于28℃黑暗放置4 h。
1.5 生理生化指标测定取对照组(未冷冻处理)和最佳冷冻组的种子各1.0 g,分别提取酶液,冷藏备用。参照刘子凡[5]的3, 5-二硝基水杨酸比色法(DNS法)测定α-淀粉酶活性、TTC法测脱氢酶活性、紫外分光光度法测过氧化氢酶(CAT)活性、愈创木酚法测过氧化物酶(POD)活性。丙二醛(MDA)含量采用硫代巴比妥酸法[6]测定。
1.6 显微观察取出种胚制备石蜡切片,先用FAA固定液固定24 h,然后依次用70%酒精、80%酒精、90%酒精、纯酒精、纯酒精各脱水2 h,再用50%酒精、50%二甲苯、二甲苯、二甲苯各处理1 h,埋蜡,切片,用二甲苯、二甲苯、纯酒精、纯酒精、95%酒精、85%酒精顺序脱蜡各5 min,依次用1%番红溶液染色16 h、70%酒精5 min、85%酒精5 min、0.5%固绿溶液9~13 s、95%酒精5 min;最后分别用纯酒精脱水30 s、纯酒精1~2 min、二甲苯30 s、二甲苯5~30 min。封胶制成永久切片,显微观察。
1.7 数据分析采用SAS 9.3软件中的ANOVA方法对数据进行多重比较分析,以P < 0.01表示差异极显著,P < 0.05为差异显著。
2 结果和分析 2.1 含水量和冷藏时间对种子生活力的影响杨德军等[3]在常温下袋藏种子30 d的发芽率降至30%以下,干燥后储藏40 d以上的发芽率几乎为0。本试验对初始含水量为60.57%的羯布罗香种子进行梯度脱水,获得含水量分别为50.35%、44.23%、40.50%、35.43%、30.23%和25%的种子。含水量44%以上的种子生活力均为100%;含水量为40%时, 种子生活力降至80%;随着含水量的继续下降,种子生活力也继续降低;当含水量为25%时,种子生活力已低于30%。
羯布罗香种子极易发芽,将初始含水量的种子置于15℃种子柜中,仍继续发芽。将含水量高于45%的种子储藏于4℃冰箱中,30 d后生活力降至30%以下;将含水量45%的种子储藏于4℃冰箱中90 d,其生活力仍有70%,但120 d后生活力降至10%左右。可见,羯布罗香种子的安全储藏含水量为45%左右。
2.2 超低温冷冻对种子生活力的影响由表 1可见,羯布罗香种子液氮冻存1 d后, 玻璃化冷冻的种子生活力最高,缓慢冷冻法和快速冷冻的种子生活力均为75%;种胚冻存5 d,种子生活力都下降,其中玻璃化冷冻的种子生活力下降了44%;种胚冻存14 d后,玻璃化冷冻和缓慢冷冻的种子生活力分别急剧下降至26.10%和15.27%,而快速冷冻的种子生活力较冻存5 d的无显著差异, 仍有60%。这可能是因为冷冻保护剂PVS2对种胚造成了伤害。依此可判断,羯布罗香种子超低温保存最适方法为快速冷冻法。
| 表 1 不同冷冻方式下羯布罗香的种子生活力(%) Table 1 Seed vigor (%) of Dipterocarpus turbinatus with different freezing method |
液氮冷冻对羯布罗香种胚结构产生影响,且不同冷冻方式引起种胚结构变化的程度不同。未经液氮冷冻的种胚胚根细胞呈圆形,排列整齐、结构完整(图 1: A, B);胚轴细胞排列整齐、内含物分布均匀(图 1: C);胚乳细胞排列较整齐,淀粉粒靠近细胞壁、分布较均匀(图 1: D)。玻璃化冷冻和缓慢冷冻的种胚胚根细胞排列松散,细胞形状为方形(图 1: E, F, I, J);胚轴出现空洞区域、细胞排列混乱(图 1: E, I, G, K),细胞质凝结成团或呈碎片状(图 1: G, K);胚乳细胞中淀粉粒数量明显增多,分散分布在细胞内(图 1: H, L)。而快速冷冻后的种胚胚根细胞呈圆形,排列紧密(图 1: M, N),胚轴部分细胞原生质体浓缩、质壁分离(图 1: O),胚乳细胞淀粉粒分布均匀(图 1: P)。可见,玻璃化冷冻和缓慢冷冻后的种胚结构发生较大变化,而快速冷冻的种胚结构与对照相近,这可能是冷冻保护液对种胚造成了部分损伤。这表明快速冷冻是羯布罗香种胚超低温保存的最佳方式。
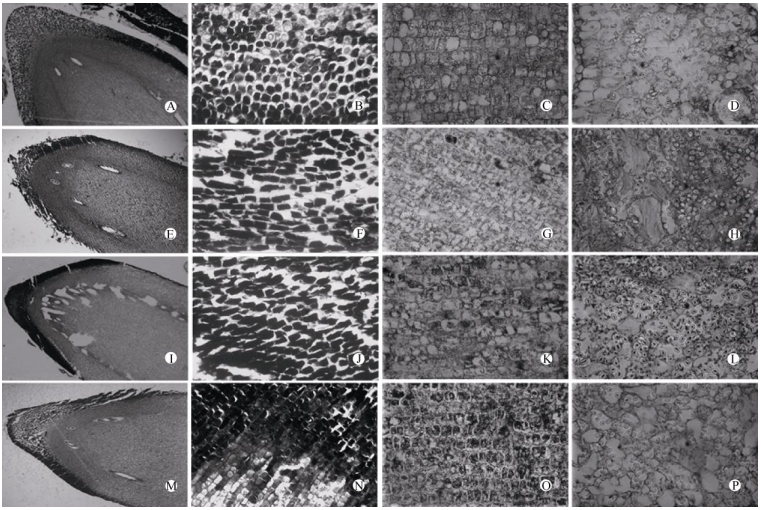
|
图 1 超低温冷冻对羯布罗香种子结构的影响。A~D:对照; E~H:玻璃化冷冻; I~L:缓慢冷冻; M~P:快速冷冻; A, B, E, F, I, J, M, N:胚根; C, G, K, O:胚轴; D, H, L, P:胚乳。 Fig. 1 Effect of cryopreservation on seed structure of Dipterocarpus turbinatus. A-D: Control; E-H: Vitrification; I-L: Slow freezing; M-P: Quick freezing; A, B, E, F, I, J, M, N: Radicle; C, G, K, O: Hypocotyl; D, H, L, P: Endosperm. |
从表 2可见,种胚经过液氮快速冷冻保存14 d后的生理生化指标均发生变化,其中过氧化物酶、过氧化氢酶和脱氢酶活性均急剧下降,这可能是快速冷冻使羯布罗香种胚受到损伤,引起种胚中活性氧水平升高,从而使酶的抗氧化能力减弱,酶活性急剧下降;而α-淀粉酶活性却大幅度提升,表明液氮冷冻对羯布罗香种子萌发有促进作用。液氮冷冻前后的丙二醛含量无显著变化,说明液氮冷冻对羯布罗香种子丙二醛含量影响不大。
| 表 2 超低温保存对羯布罗香种子生理生化指标的影响 Table 2 Effect of cryopreservation on physiological and biochemical indexes of Dipterocarpus turbinatus seeds |
种子含水量的高低是决定顽拗性种子生活力和贮藏寿命的关键因素[7],成熟龙眼(Dimocarpus longan)种子含水量约为42.5%,当含水量降至20%以下时,即丧失发芽能力,且在自然脱水状态下只能保存8 d[8]。胡椒(Piper nigrum)和咖啡(Coffea arabica)种子分别自然贮藏60和90 d,含水量降至10.91%和9.81%时,将几乎完全丧失发芽力[9]。而自然含水量下的羯布罗香种子室温储藏30 d的发芽率小于30%,且适宜含水量的种子在低温(4℃)贮藏120 d后,生活力降至10%以下。因此,羯布罗香种子不适宜于常规的种子长期贮藏方法(包括低温低湿库),需要探索适宜的长期保存法。
超低温保存法被认为是长期稳定保存顽拗性种子的最佳方法,在种子超低温保存过程中,冷冻方式是影响其种子活力的关键因素。缓慢冷冻法, 可以使细胞内水分有充分的时间流到细胞外结冰,从而使细胞内水分含量减少至最低限度,达到良好的脱水效果,适合于液泡化程度较高的植物材料[10-11]。快速冷冻时温度下降极快,可使材料迅速通过形成冰晶的临界温度,细胞内来不及形成冰晶,从而减少在降温过程中的细胞伤害[11],较适合于低含水量的材料。玻璃化冷冻法可使材料直接进入玻璃态,此法应用广泛,但仍要注意玻璃化保护剂对材料的毒害作用[12]。高良姜(Alpinia officinarum)种子超低温保存的最适方式为玻璃化冷冻法[13;白木香(Aqui- laria sinensis)种子超低温保存的最适方式为快速冷冻法[14];降香黄檀(Dalbergia odorifera)种子的最适冷冻方式为玻璃化冷冻法[15];益智(Alpinia oxyphylla)种子最适冷冻方式为快速冷冻法[16]。本试验采用3种冷冻方式对羯布罗香种子进行超低温保存,通过生活力检测和切片显微观察,结果表明, 羯布罗香种子的最适冷冻方式为快速冷冻法。
POD、CAT和脱氢酶是植物种子中重要的抗逆酶,其活性强弱与植物种子的超低温耐性有着重要相关性[17]。其中,POD可在种子萌发过程中清除细胞内脂质过氧化产生的毒害,其活性大小可用来衡量种子活力[18];CAT的主要作用是分解细胞内多余的H2O2,减轻其对膜脂的伤害[19];脱氢酶活性的强弱与种子活力的强弱有关,且与种子的萌发呈正相关。本试验中,液氮超低温冷冻后,羯布罗香种子的POD、CAT和脱氢酶活性都下降,说明液氮冷冻使得种子抗氧化能力和活力减弱了,这与生活力检测结果是一致的。α-淀粉酶是将种子内的淀粉分解为可吸收利用的小分子物质,其活性的高低对种子萌发生长过程中的能量和各种中间产物的供应有很大影响[20],是种子顺利萌发的重要生理基础[21]。本试验中,液氮冷冻的羯布罗香种子的α-淀粉酶活性显著提高,这与陈红等[20]对贵州酥李(Prunus salicina ‘Suli’)种子超低温保存的研究结果一致。丙二醛是膜质过氧化产物之一,会抑制细胞保护酶的活性,降低抗氧化物的含量[19],其含量可以衡量种子的受损程度[22]。本试验结果表明,超低温冷冻对羯布罗香种子丙二醛含量无显著影响,说明超低温快速冷冻未对种胚造成严重损失,这与切片显微观察结果是一致的。
| [1] |
WANG Y, QIU Q, YANG D J, et al. Technique for Dipterocarpus trubinatus' introduced cultivation and growth process of its plantation[J].
For Invent Plan, 2010, 35(1): 135-138. 王艳, 邱琼, 杨德军, 等. 羯布罗香引种栽培技术及其人工林生长过程研究[J]. 林业调查规划, 2010, 35(1): 135-138. DOI:10.3969/j.issn.1671-3168.2010.01.035 |
| [2] |
ZHOU L, HUANG Z Y, HUANG J P. The "God mollis":Diptero-carpus trubinatus[J].
Garden, 2013, 1(2): 66-67. 周亮, 黄紫云, 黄建平. 傣家的"神油树":羯布罗香[J]. 园林, 2013, 1(2): 66-67. DOI:10.3969/j.issn.1000-0283.2013.02.017 |
| [3] |
YANG D J, QIU Q, WEN J, et al. The cultivation technology in hilly area and sapling growth of Dipterocarpus trubinatus[J].
China For Sci Technol, 2008, 22(3): 79-82. 杨德军, 邱琼, 文进, 等. 羯布罗香山地栽培技术及幼林生长规律[J]. 林业科技开发, 2008, 22(3): 79-82. DOI:10.3969/j.issn.1000-8101.2008.03.025 |
| [4] | ROBERTS E H. Problems of long-term storage of seed and pollen for genetic resources conservation[M]//FRANKEL O H, HAWKES J G. Crop Genetic Resources for Today and Tomorrow. London: Cambridge University Press, 1975: 269-294. |
| [5] |
LIU Z F.
Seed Science:A Laboratory Manual[M]. Beijing: Chemical Industry Press, 2011: 62-104.
刘子凡. 种子学实验指南[M]. 北京: 化学工业出版社, 2011: 62-104. |
| [6] |
ZHANG H R.
The Principle and Method of Biochemistry Experiment[M]. Yinchuan: Ningxia People's Publishing Press, 1999: 59-63.
张慧茹. 生物化学试验原理和方法[M]. 银川: 宁夏人民出版社, 1999: 59-63. |
| [7] |
FU J R, SONG S Q.
Biology of Recalcitrant Seeds[M]. Beijing: China Science Culture Press, 2004: 60-61.
傅家瑞, 宋松泉. 顽拗性种子生物学[M]. 北京: 中国科学文化出版社, 2004: 60-61. |
| [8] |
TIAN X M, LI H L, HE Y, et al. Research progress on recalcitrant seeds storage of tropical crops[J].
Chin J Trop Agric, 2014, 34(8): 52-58. 田新民, 李洪立, 何云, 等. 热带作物顽拗型种子保存研究进展[J]. 热带农业科学, 2014, 34(8): 52-58. DOI:10.3969/j.issn.1009-2196.2014.08.011 |
| [9] |
YANG H G. Characteristics of germination of Piper nigrum and Coffea canephora seeds stored at an ambient temperature[J].
Chin J Trop Agric, 2006, 26(6): 7-9, 12. 杨华庚. 胡椒和咖啡2种中间性种子的萌发特性研究[J]. 热带农业科学, 2006, 26(6): 7-9, 12. DOI:10.3969/j.issn.1009-2196.2006.06.003 |
| [10] |
YE F, XIA S, MEI X G. Studies on factors in cryopreservation of Taxus callus[J].
J Wuhan Bot Res, 2001, 19(4): 327-331. 叶芳, 夏胜, 梅兴国. 红豆杉愈伤组织超低温保存有关因素的研究[J]. 武汉植物学研究, 2001, 19(4): 327-331. DOI:10.3969/j.issn.2095-0837.2001.04.008 |
| [11] |
CHENG Z Y. Physiological and biochemical and structure charac-teristics of chrysanthemum shoot tips during cryopreservation[D]. Nanjing: Nanjing Agricultural University, 2006: 3-4.
程志英. 菊花(Dendranthema morifolium)茎尖超低温处理过程中的相关生理生化与结构变化[D]. 南京: 南京农业大学, 2006: 3-4. |
| [12] |
SHI R, WANG F, WANG J. Advances in vitrification cryopreservation technology[J].
N Hort, 2011(24): 231-235. 石茹, 王芳, 王舰. 玻璃化法超低温保存技术及其研究进展[J]. 北方园艺, 2011(24): 231-235. |
| [13] |
ZENG L, HE M J, ZHENG X L, et al. Study on cryopreservation of Alpinia officinarum Hance seeds[J].
Chin Agric Sci Bull, 2014, 30(28): 164-148. 曾琳, 何明军, 郑希龙, 等. 高良姜种子超低温保存研究[J]. 中国农学通报, 2014, 30(28): 164-148. |
| [14] |
LIU J M, XU Z Q, XU H H, et al. Study on cryopreservation of seeds of Aquilaria sinensis (Lour.) Gilg[J].
J Guangzhou Univ Trad Chin Med, 2007, 24(5): 414-415. 刘军民, 徐梓勤, 徐鸿华, 等. 白木香种子的超低温保存研究[J]. 广州中医药大学学报, 2007, 24(5): 414-415. DOI:10.3969/j.issn.1007-3213.2007.05.017 |
| [15] |
ZENG L, HE M J, WEI J H, et al. Cryopreservation study on seeds and embryos in Dalbergia odorifera T. Chen[J].
China J Chin Mat Med, 2014, 39(12): 2263-2266. 曾琳, 何明军, 魏建和, 等. 降香黄檀种子和离体胚超低温保存研究[J]. 中国中药杂志, 2014, 39(12): 2263-2266. DOI:10.4268/cjcmm20141222 |
| [16] |
ZENG L, WU Y, HE M J, et al. Physiological and biochemical characteristics of Alpinia oxyphylla seeds after cryopreservation[J/OL]. Guihaia, 2017: 1-12[2017-06-13]. http://kns.cnki.net/kcms/detail/45.1134.Q.20170613.1758.002.html. doi: 10.11931/guihaia.gxzw201704031.
曾琳, 吴怡, 何明军, 等. 超低温冷冻对益智种子生理生化特性的影响[J]. 广西植物, 2017: 1-12[2017-06-13]. http://kns.cnki.net/kcms/detail/45.1134.Q.20170613.1758.002.html. doi: 10.11931/guihaia.gxzw201704031 |
| [17] |
SONG H, CAO B, WANG L. Physiological and biochemical charac-teristics of Iris ensata seeds after cryopreservation[J].
J NE For Univ, 2016, 44(4): 44-47. 宋红, 曹柏, 王玲. 超低温保存对玉蝉花种子生理生化特性的影响[J]. 东北林业大学学报, 2016, 44(4): 44-47. |
| [18] |
GAO R Q, ZHANG C Q.
Seed Biology[M]. Beijing: China Science and Technology Press, 2009: 201-202.
高荣岐, 张春庆. 种子生物学[M]. 北京: 中国科学技术出版社, 2009: 201-202. |
| [19] |
QIAN H G. Study on seed germination characteristics and seed vigor changes of three elm species[D]. Yangling: Northwest Agricultural and Forestry University, 2009: 7-9.
钱红格. 三种榆属树种种子萌发特性及活力变化的研究[D]. 杨凌: 西北农林科技大学, 2009: 7-9. |
| [20] |
CHEN H, HAN X Y. Influence on physiological and biochemical characteristics of crisp plum seeds after cryopreservation[J].
Tianjin Agric Sci, 2013, 19(5): 1-4. 陈红, 韩晓莹. 超低温保存对贵州酥李种子生理生化特性的影响[J]. 天津农业科学, 2013, 19(5): 1-4. |
| [21] |
ZHAO Y J, WANG T. Analysis of the relationship between α-amylase and germinating rate of rice seeds during the process of seed germi-nation[J].
Chin Bull Bot, 2001, 18(2): 226-230. 赵玉锦, 王台. 水稻种子萌发过程中α-淀粉酶与萌发速率关系的分析[J]. 植物学通报, 2001, 18(2): 226-230. |
| [22] |
TANG Z J, SONG M. Physiological and biochemical analysis of artificially aged Chinese cabbage[Brassica campestris L. ssp. Pekin-ensis (Lour.) Olsson][J].
Acta Hort Sin, 1999, 26(5): 319-322. 唐祖君, 宋明. 大白菜种子人工老化及劣变的生理生化分析[J]. 园艺学报, 1999, 26(5): 319-322. |
 2018, Vol. 26
2018, Vol. 26


