2. 深圳园林股份有限公司, 广东 深圳 518021
2. Shenzhen Landscape Company Limited, Shenzhen 518021, Guangdong, China
近年来, 随着城市化进程的推进, 城市中的绿地越来越少, “热岛效应”日趋严重, 屋顶作为建筑的“第五立面”逐渐被人们所重视。屋顶绿化随之变为缓解城市建筑面积与绿地面积之间矛盾的重要方式。屋顶因光照强、温差大、空气流动大等特殊的环境立地条件, 导致目前应用于屋顶绿化大面积推广的植物少之又少, 开展屋顶绿化植物的筛选研究对屋顶绿化的工程应用及养护管理有重要意义。
鸭跖草科(Commelinaceae)植物叶片肉质较厚, 耐热性、耐旱性、耐贫瘠能力及分蘖繁殖能力较强, 这些特征都显示鸭跖草科植物是潜在可用于屋顶绿化种植的植物[1]。假紫万年青(Belosynapsis ciliata)为鸭跖草科假紫万年青属植物, 多年生草本, 其根状茎细长而横走, 节上有短鞘, 茎纤细, 节上生根, 分枝或不分枝。在我国主要分布在福建、广东、海南、台湾、云南等地[2], 是当前潜在可开发应用的新型屋顶绿化植物。
光照是植物生长发育的关键因子和限制因子, 对植物的形态结构、生长发育和生理生化等具有重要作用, 植物主要通过形态和生理变化来适应不同的光环境[3]。形态可塑性是植物体通过改变生物量分配和形态来实现适应, 是同一基因型对不同环境条件表现出的不同表型特性, 具有重要的生态和进化意义[4-8]。叶绿素荧光效应是植物对环境变化的生理响应, 其日变化反映了植物对生境光强变化的一系列重要生理调节过程。近年来已被广泛用于植物生长的光合机理、逆境生理等研究领域[9-15]。
根据野外调查, 假紫万年青的生境分布较广, 既能在阳光充足的阳生地生长, 又能在荫生环境生长, 且在不同生境表现出较显著的可塑性, 目前对于假紫万年青植物在不同光照下形态可塑性与叶绿素荧光参数的研究还未见报道。本文采用遮阳网遮光处理假紫万年青, 探讨不同光照强度对形态特征的影响和叶绿素荧光参数的变化, 为其在屋顶绿化的应用推广提供技术支持。
1 材料和方法 1.1 材料试验材料假紫万年青(Belosynapsis ciliata)采自广东花都区花东镇狮前村七溪地(23°06′42.92″ N, 113°16′31.49″ E)。试验地点位于广东省广州市仲恺农业工程学院校园内, 该地区属于南亚热带典型的季风海洋性气候, 年平均气温20.0℃~22.0℃, 年平均降水量为1 738 mm, 平均相对湿度77%。7月平均温度27.9℃, 1月平均温度4.2℃, 年均温16.1℃。
1.2 试验设计2015年10月9日选取生长一致的假紫万年青茎段(长约5~6 cm, 含3个节), 分别插入育苗盆盘(长5 cm, 宽5 cm)中。移栽20 d后, 采用黑色遮阳网棚进行梯度遮荫, 遮阳网距离育苗盆30~35 cm, 设置5个遮阴处理:全光照(无遮光, 对照)、一层、二层、三层和四层遮阳网遮阴, 光照强度分别是100%自然全光照(natural sunlight, NS)、35.1%NS、15.2%NS、5.6%NS和2.2%NS。试验期间的水分控制采用自然和人工补水, 每隔3或4 d浇水1次, 浇水的同时转动育苗盆, 使植物受光照均匀。
1.3 方法植株形态和生物量的测定 分别在遮阴处理2和5周后, 每个处理随机选取20株植株, 测量自然高度、绝对长度(匍匐茎长度)、主茎(匍匐茎)节数、分枝数、分枝长度、第3节的茎粗。分离植株各部位, 在105℃烘箱杀青30 min, 于85℃烘干至恒量后, 称量, 计算各部位的生物量。
叶绿素含量的测定 选取健康叶片, 采用乙醇丙酮混合液浸提法[16]提取, 在避光条件下浸提直至叶片完全变白, 用紫外分光光度计测定。按Lich- tenthaler公式计算叶绿素含量。每个处理取4株植株, 每株2次重复, 共8次重复, 取平均值。
叶绿素荧光测定 选在遮阴处理第五周的晴天, 用美国OPTI-sciences OS-30P+快速植物胁迫测量仪连续测定3 d, 时间分别为8:00-8:30 (简称8:00, 下同)、10:00-10:30 (10:00)、12:00-12:30 (12:00)、14:00-14:30 (14:00)及16:00-16:30 (16:00), 记录各时段的初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、PSII原初光能转换效率(Fv/Fm)以及PSⅡ潜在光化学活性(Fv/Fo)。测定前叶片均先暗适应20 min, 每处理测20片叶, 计算连续3 d共60片叶的平均值。
1.4 数据处理采用Microsoft Excel 2010软件对数据进行处理和绘图。采用SPSS 21.0统计分析软件进行One- Way ANOVA分析。
2 结果和分析 2.1 形态特征的变化由表 1可见, 不同遮光强度下, 假紫万年青的形态特征变化差异较大。处理15 d时, 随着遮光强度的增加, 株高逐渐增大, 差异极显著(P < 0.01), 说明高光照下假紫万年青趋向于匍匐性生长, 而光照逐渐减弱则趋于直立生长。处理35 d时, 35.2%NS遮阴的株高比对照低, 可能是假紫万年青具有匍匐近地生长特性。而5.6%NS和2.2%NS遮阴35 d的株高比15 d的低, 说明长时间遮光, 直立生长的主茎因重力原因出现下弯, 导致株高降低。
| 表 1 不同光照强度下假紫万年青的形态特征 Table 1 Morphological characteristics of Belosynapsis ciliata under different light intensities |
茎长、节数、茎粗和分枝数随着光照强度的增加基本呈现逐渐减小趋势。处理15 d后, 除茎长在35.1%NS和5.6%NS遮光间差异显著(P < 0.05)外, 其他处理间均没有显著差异; 处理35 d后, 对照、35.1%NS和15.2%NS遮光的茎长与5.6%NS和2.2%NS遮光的有明显差异。处理15 d后, 5.6%NS和2.2%NS遮光的主茎节数与对照、35.1%NS处理的差异达显著水平。处理35d时, 对照和35.1%NS处理的节数明显高于其他处理(P < 0.05)。从表 1可见, 35.1%NS遮光生长15和35 d的茎长和节数最高, 对照的分枝数最高。2.2%NS遮光生长15 d的节间最长, 明显长于其他处理(P < 0.05)。生长35 d后, 各处理生长35 d的节间长差异均不显著, 说明遮光对节间长的影响不显著。随着遮光强度的增加, 侧枝数明显减少。35.1%NS遮光的分枝长度最长。
2.2 叶绿素含量的变化假紫万年青叶片的叶绿素含量随遮光强度的增强呈现先升高后下降的趋势(表 2), 15.2%NS遮光处理的叶绿素a和叶绿素b含量最高, 且显著高于对照(P < 0.05), 叶绿素a+b和叶绿素a/b与对照的差异均不显著。2.2%NS处理的叶绿素a、叶绿素b、叶绿素a+b和叶绿素a/b均显著低于全光照的。
| 表 2 不同光照下假紫万年青叶片叶绿素含量(n = 6) Table 2 Chlorophyll contents of Belosynapsis ciliata under different shading conditions (n = 6) |
由图 1可见, 从早晨8:00到下午16:00, 假紫万年青的初始荧光(Fo)、最大荧光(Fm)和可变荧光(Fv)的变化呈“S”型曲线, Fo最小值出现在10:00, 最大值出现在14:00。在35.1%NS、15.2%NS和5.6%NS遮光下Fv的最小值在早晨8:00, 最大值出现在14:00, 而2.2%NS处理的最小值在10:00。Fm的最大值出现在14:00, 对照、35.1%NS和5.6%NS处理的Fm最小值出现在早晨8:00, 而15.2%NS和2.2%NS处理的最小值出现在10:00。

|
图 1 不同光照强度对假紫万年青Fo、Fv和Fm的影响 Fig. 1 Effects of different light intensities on chlorophyll fluorescence parameters Fo, Fv and Fm of Belosynapsis ciliata |
Fv/Fm可代表光系统Ⅱ(PSⅡ)光化学的最大效率。从图 2可见, 各处理的Fv/Fm在8:00至12:00均是先上升后下降, 35.1%NS遮光处理在12:00后趋于稳定, 对照和5.6%NS遮光处理在12:00至14:00发生略微变化, 在16:00时又明显上升, 15.2%NS和2.2%NS遮光处理在12:00至16:00呈现先上升后下降的变化趋势。35.1%NS遮光处理的Fv/Fm均高于其他处理, 说明其有利于假紫万年青维持较高的PSⅡ光化学最大效率。
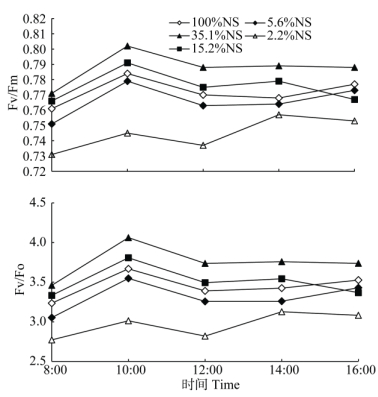
|
图 2 不同光照强度对假紫万年青Fv/Fm、Fv/Fo的影响 Fig. 2 Effects of different light intensities on Fv/Fm, Fv/Fo of Belosynapsis ciliata |
形态可塑性是植物竞争能力和适应的重要决定因子之一, 不同光照强度对植物形态和生理产生的变化可能是植物本身对不同光照做出的可塑性反应[5-6, 17-19]。弱光会在一定程度上改变植物的形态特征和生物量分配格局, 导致植物茎杆弯曲, 株高、茎粗和总生物量等减小, 甚至导致植株无法正常生长[7]。本文结果表明, 遮阴使假紫万年青的茎长、叶绿素含量增加, 这与袁春明等[20]对藤本植物的表型可塑性研究以及Leshan等[21]对加拿大一枝黄花(Solidago canadensis)的研究结果相似, 显示植物在遮阴时, 为了能获得更大的光资源, 通过增加植株高度和增长节间长度; 同时利用提高叶绿素浓度的方式来提高光能利用率, 更有利于积累光合产物以满足植物生长发育的需求, 维持植株的健康和竞争力[21]。假紫万年青的分枝数、茎粗、节数随光照强度的减弱呈减少的趋势, 这与陶建平等[22]对苦瓜(Momordica charantia)的研究结果相似, 说明弱光会在一定程度上改变植物的形态特征和生物量分配格局, 在功能的资源分配协调上对某一个环节投入的增加势必导致对其他投入的减少[23]。
绿色植物通过光合作用合成有机物并储存能量, 主要是依靠叶绿素和光反应酶来捕获和利用光能, 合成光合产物, 其中叶绿素是吸收光能的主要物质, 在遮光条件下, 植物通过增加单位面积或单位质量的叶绿素含量来吸收更多的光能[24-28]。本文中, 假紫万年青叶片的叶绿素含量和叶绿素a/b随着光照强度降低表现为先升高后下降的变化趋势。2.2%NS遮光处理的叶绿素含量及叶绿素a/b值均显著低于全光照的, 且以15.2%NS遮光处理的最高, 叶绿素总量甚至显著高于对照。这说明假紫万年青在一定的弱光下, 为更好地利用环境光能, 增加叶绿素含量以对生长进行补偿, 但在过度遮阴时, 叶绿素的生物合成途径受阻, 2.2%NS遮光处理的叶绿素含量最低。
不同光照强度对植物光合作用的影响可通过叶绿素荧光参数反映出来[29]。Fv/Fm是光合作用的敏感指标, Fv/Fm降低是植物光合作用受到光抑制的显著特征。研究表明, Fv/Fm为0.75~0.85表明光能在PSII系统中能实现有效转换[25, 30, 32-36]。同时, 叶绿素b是捕光叶绿素-蛋白质的主要成分, 其浓度随遮光强度增加而增加, 而Fv/Fm值与捕光叶绿素-蛋白质呈负相关关系[25, 30-31, 36-37]。本研究结果表明, 叶绿素b含量与Fv/Fm呈负相关关系, 叶绿素荧光参数中初始荧光Fo以5.6%NS处理的最高, 而其余参数均是以35.1%NS遮光的最高, 且假紫万年青的Fv/Fm随遮光程度增加而降低, 为0.75~0.8, 说明一定的弱光(35.1%NS)有利于假紫万年青的光合作用, 但光照强度继续下降又会对光合作用产生抑制。
表型可塑性是一种调整植物形态和生理方面的现象, 植物利用可塑性增强其获得限制性资源的能力, 是作为一种在不同环境和获得必要资源时保守的资源利用策略[38-40]。假紫万年青在遮阴条件下形态和光合特性表现出较高的可塑性, 高表型可塑性提高了对不同环境的耐受性, 说明假紫万年青能较好的适应环境的变化。由于假紫万年青在高光照下能匍匐近地生长, 而筛选草坪式屋顶绿化植物时需要植物能匍匐成毯生长, 抗风, 粗放管理等, 因此在屋顶这种高光条件下, 假紫万年青可以作为屋顶绿化植物开发的优良种质材料。遮阴试验表明, 在高光照下假紫万年青匍匐近地生长, 随着光照逐渐减弱趋于直立生长。因此, 在屋顶绿化种植的初期可采用适度的遮阴(35.1%NS)使其更好的生长, 加速成坪, 降低管理成本。本研究为假紫万年青的可塑性研究提供了基础数据, 也为其在屋顶绿化应用提供技术支持。
| [1] |
Tang C. Studies on the selection of plants and substrates of roof greening of lawn-style in Guangzhou[D]. Guangzhou: Zhongkai University of Agriculture Engineering, 2013: 7-8.
汤聪. 广州地区草坪式屋顶绿化植物筛选及栽培基质研究[D]. 广州: 仲恺农业工程学院, 2013: 7-8. |
| [2] |
WU G F, MA W L, HONG D Y, et al.
Flora Reipublicae Popularis Sinicae, Tomus 13(3)[M]. Beijing: Science Press, 1997: 106.
吴国芳, 马玮梁, 洪德元, 等. 中国植物志, 第13卷第3分册[M]. 北京: 科学出版社, 1997: 106. |
| [3] | ALPERT P, SIMMS E L. Relative advantages of plasticity and fixity in different environments:when is it good for a plant to adjust?[J]. Evol Ecol, 2002, 16(3): 285-297. DOI:10.1023/A:1019684612767 |
| [4] |
ZHANG W Y, WANG B S, LI M G, et al. The effects of light intensity on growth and morphology in Mikania micrnatha seedlings[J].
Sun Yatsen Univ Forum, 2002, 22(1): 222-226. 张炜银, 王伯荪, 李鸣光, 等. 不同光照强度对薇甘菊幼苗生长和形态的影响[J]. 中山大学学报论丛, 2002, 22(1): 222-226. DOI:10.3969/j.issn.1674-3202.2002.01.070 |
| [5] | SULTAN S E. Phenotypic plasticity in plants:a case study in ecological development[J]. Evol Dev, 2003, 5(1): 25-33. DOI:10.1046/j.1525-142X.2003.03005.x |
| [6] | RICHARDS C L, BOSSDORF O, MUTH N Z, et al. Jack of all trades, master of some? On the role of phenotypic plasticity in plant invasions[J]. Ecol Lett, 2006, 9(8): 981-993. DOI:10.1111/j.1461-0248.2006.00950.x |
| [7] |
WANG R, SUN B, LI J D, et al. Effects of light intensity on the phenotypic plasticity of invasive species Ambrosia trifida[J].
Chin J Appl Ecol, 2012, 23(7): 1797-1802. 王蕊, 孙备, 李建东, 等. 不同光强对入侵种三裂叶豚草表型可塑性的影响[J]. 应用生态学报, 2012, 23(7): 1797-1802. DOI:10.13287/j.1001-9332.2012.0206 |
| [8] |
ZHANG Z Y, ZHANG Z J, PAN X Y. Phenotypic plasticity of Alternanthera philoxeroides in response to shading:Introduced vs. native populations[J].
Biodiv Sci, 2015, 23(1): 18-22. 张紫妍, 张致杰, 潘晓云. 喜旱莲子草对遮荫的可塑性反应:入侵地与原产地种群的比较[J]. 生物多样性, 2015, 23(1): 18-22. DOI:10.17520/biods.2014065 |
| [9] |
YOU Y, YE Y Z. Effect of plant hormones on Fv/Fo and Fv/Fm in Dioscorea zingiberensis leaves[J].
J Anhui Agric Sci, 2007, 35(19): 5701-5702, 5724. 尤扬, 叶永忠. 植物激素对黄姜叶片Fv/Fo和Fv/Fm的影响[J]. 安徽农业科学, 2007, 35(19): 5701-5702, 5724. DOI:10.3969/j.issn.1004-3918.2007.06.014 |
| [10] |
GUI K Y, WEN L J, LI Y L, et al. Effects of different illumination on Scindapsus aureus phenotypic plasticity[J].
J Anhui Agric Sci, 2009, 37(21): 9956-9960. 桂克印, 文亮晶, 李炎林, 等. 不同光照处理对绿萝表型可塑性的影响[J]. 安徽农业科学, 2009, 37(21): 9956-9960. DOI:10.3969/j.issn.0517-6611.2009.21.055 |
| [11] |
WANG Y Y, ZHANG H J, YANG X W, et al. Phenotypic plasticity of Alternanthera philoxeroides under different light intensities[J].
Chin Hort Abstr, 2012, 28(1): 17-18. 王英英, 张惠娟, 杨小维, 等. 不同光照强度下空心莲子草形态可塑性研究[J]. 中国园艺文摘, 2012, 28(1): 17-18. DOI:10.3969/j.issn.1672-0873.2012.01.009 |
| [12] |
WU G L, SUN Y, SHEN G Z, et al. Diurnal changes of net photo-synthetic rate and chlorophyll fluorescence parameters of Cymbidium hybrid nobuko under different light intensities[J].
J Zhejiang Univ (Agric Life Sci), 2009, 35(6): 607-612. 吴根良, 孙瑶, 沈国正, 等. 不同光照条件下大花蕙兰净光合速率和叶绿素荧光参数的日变化[J]. 浙江大学学报(农业与生命科学版), 2009, 35(6): 607-612. DOI:10.3785/j.issn.1008-9209.2009.06.003 |
| [13] |
CHENG H T, FAN Z W, HUANG Q Q, et al. Ecophysiology of Mikania micrantha H. B. K under different light conditions[J].
Chin J Trop Crops, 2012, 33(3): 523-528. 程汉亭, 范志伟, 黄乔乔, 等. 薇甘菊在不同光环境下的生理生态研究[J]. 热带作物学报, 2012, 33(3): 523-528. DOI:10.3969/j.issn.1000-2561.2012.03.024 |
| [14] |
YE L H, HUANG X L, YI L S, et al. Diurnal changes of chlorophyll fluorescence parameters of three ornamental and floral plants[J].
Hunan For Sci Technol, 2013, 40(1): 32-35, 72. 叶龙华, 黄香兰, 易立飒, 等. 三种花卉植物的叶绿素荧光参数日变化研究[J]. 湖南林业科技, 2013, 40(1): 32-35, 72. DOI:10.3969/j.issn.1003-5710.2013.01.009 |
| [15] | BASSETT I E, PAYNTER Q, BEGGS J R. Effect of artificial shading on growth and competitiveness of Alternanthera philoxeroides (alli-gator weed)[J]. N Z J Agric Res, 2011, 54(4): 251-260. DOI:10.1080/00288233.2011.599396 |
| [16] |
ZHANG X Z. Determination of chlorophyll content in plant:A method of mixture of acetone and ethanol[J].
Liaoning Agric Sci, 1986(3): 26-28. 张宪政. 植物叶绿素含量测定——丙酮乙醇混合液法[J]. 辽宁农业科学, 1986(3): 26-28. |
| [17] | LISCUM E, STOWE-EVANS E L. Phototropism:A "simple" physio-logical response modulated by multiple interacting photosensory-response pathways[J]. Photochem Photobiol, 2000, 72(3): 273-282. DOI:10.1562/0031-8655(2000)0720273PASPRM2.0.CO2 |
| [18] | LUSK C H, REICH P B, MONTGOMERY R A, et al. Why are ever-green leaves so contrary about shade?[J]. Trends Ecol Evol, 2008, 23(6): 299-303. DOI:10.1016/j.tree.2008.02.006 |
| [19] | GUO Y H, YUAN C, TANG L, et al. Responses of clonal growth and photosynthesis in Amomum villosum to different light environments[J]. Photosynthetica, 2016, 54(3): 396-404. DOI:10.1007/s11099-016-0194-x |
| [20] | YUAN C M, WU T, GENG Y F, et al. Phenotypic plasticity of lianas in response to altered light environment[J]. Ecol Res, 2016, 31(3): 375-384. DOI:10.1007/s11284-016-1343-1 |
| [21] | DU L S, LIU H Y, YAN M, et al. Individual plasticity of the shade response of the invasive Solidago canadensis in China[J]. PLoS One, 2017, 12(1): e0170049 DOI:10.1371/journal.pone.0170049 |
| [22] |
TAO J P, ZHONG Z C. Effects of light on morphological plasticity and biomass allocation of Momordica charantia[J].
Chin J Appl Ecol, 2003, 14(3): 336-340. 陶建平, 钟章成. 光照对苦瓜形态可塑性及生物量配置的影响[J]. 应用生态学报, 2003, 14(3): 336-340. DOI:10.13287/j.1001-9332.2003.0076 |
| [23] |
YANG Y F, ZHU T C.
Plant Ecology[M]. 2nd ed. Beijing: Higher Education Press, 2011: 185-214.
杨允菲, 祝廷成. 植物生态学[M]. 第2版. 北京: 高等教育出版社, 2011: 185-214. |
| [24] | RODRÍGUEZ-LÓPEZ N F, MARTINS S C V, CAVATTE P C, et al. Morphological and physiological acclimations of coffee seedlings to growth over a range of fixed or changing light supplies[J]. Environ Exp Bot, 2014, 102: 1-10. DOI:10.1016/j.envexpbot.2014.01.008 |
| [25] | CATONI R, GRANATA M U, SARTORI F, et al. Corylus avellana responsiveness to light variations:Morphological, anatomical, and physiological leaf trait plasticity[J]. Photosynthetica, 2015, 53(1): 35-46. DOI:10.1007/s11099-015-0078-5 |
| [26] | PIRES M V, ALMEIDA A A F, FIGUEIREDO A L, et al. Photo-synthetic characteristics of ornamental passion flowers grown under different light intensities[J]. Photosynthetica, 2011, 49(4): 593-602. DOI:10.1007/s11099-011-0075-2 |
| [27] | MAXWELL K, JOHNSON G N. Chlorophyll fluorescence:A practical guide[J]. J Exp Bot, 2000, 51(345): 659-668. DOI:10.1093/jexbot/51.345.659 |
| [28] |
WANG Y, WEI X L. Advance on the effects of different light environ-ments on growth, physiological biochemistry and morpho-structure of plant[J].
J Mountain Agric Biol, 2010, 29(4): 353-359, 370. 王艺, 韦小丽. 不同光照对植物生长、生理生化和形态结构影响的研究进展[J]. 山地农业生物学报, 2010, 29(4): 353-359, 370. DOI:10.3969/j.issn.1008-0457.2010.04.017 |
| [29] |
XIAO T T, LIU G L, ZHANG X, et al. Effects of different light intensity on seedling growth and leaf color change of Acer palmatum seedlings[J].
Jiangsu Agric Sci, 2016, 44(3): 220-223. 肖婷婷, 刘广林, 张鑫, 等. 不同光照度对美国红枫幼苗生长和叶色变化的影响[J]. 江苏农业科学, 2016, 44(3): 220-223. DOI:10.15889/j.issn.1002-1302.2016.03.061 |
| [30] | DAI Y J, SHEN Z G, LIU Y, et al. Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence, and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J]. Environ Exp Bot, 2009, 65(2/3): 177-182. DOI:10.1016/j.envexpbot.2008.12.008 |
| [31] | HUANG D, WU L, CHEN J R, et al. Morphological plasticity, photosynthesis and chlorophyll fluorescence of Athyrium pachy-phlebium at different shade levels[J]. Photosynthetica, 2011, 49(4): 611-618. DOI:10.1007/s11099-011-0076-1 |
| [32] | FAVARETTO V F, MARTINEZ C A, Soriani H H, et al. Differential responses of antioxidant enzymes in pioneer and late-successional tropical tree species grown under sun and shade conditions[J]. Environ Exp Bot, 2011, 70(1): 20-28. DOI:10.1016/j.envexpbot.2010.06.003 |
| [33] | CAMPOS H, TREJO C, PE A-VALDIVIA C B, et al. Photosynthetic acclimation to drought stress in Agave salmiana Otto ex Salm-Dyck seedlings is largely dependent on thermal dissipation and enhanced electron flux to photosystem I[J]. Photosynth Res, 2014, 122(1): 23-39. DOI:10.1007/s11120-014-0008-6 |
| [34] | LIU S L, YANG R J, RRN B, et al. Differences in photosynthetic capacity, chlorophyll fluorescence, and antioxidant system between invasive Alnus formosana and its native congener in response to different irradiance levels[J]. Botany, 2016, 94(12): 1087-1101. DOI:10.1139/cjb-2016-0026 |
| [35] | BAKER N R. Chlorophyll fluorescence:A probe of photosynthesis in vivo[J]. Annu Rev Plant Biol, 2008, 59: 89-113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [36] | WALTERS R G. Towards an understanding of photosynthetic accli-mation[J]. J Exp Bot, 2005, 56(411): 435-447. DOI:10.1093/jxb/eri060 |
| [37] | KOIKE T, KITAO M, MARUYAMA Y, et al. Leaf morphology and photosynthetic adjustments among deciduous broad-leaved trees within the vertical canopy profile[J]. Tree Physiol, 2001, 21(12/13): 951-958. DOI:10.1093/treephys/21.12-13.951 |
| [38] | GONG H D, WANG H, JIAO D Y, et al. Phenotypic plasticity of seedlings of five tropical tree species in response to different light and nutrient availability[J]. Trop Ecol, 2016, 57(4): 727-737. |
| [39] | WANG C Y, XIAO H G, LIU J, et al. Differences in leaf functional traits between red and green leaves of two evergreen shrubs Photinia×fraseri and Osmanthus fragrans[J]. J For Res, 2017, 28(3): 473-479. DOI:10.1007/s11676-016-0346-7 |
| [40] | ROILOA S R, RETUERTO R, CAMPOY J G, et al. Division of labor brings greater benefits to clones of Carpobrotus edulis in the non-native range:Eevidence for rapid adaptive evolution[J]. Front Plant Sci, 2016, 7: 349 DOI:10.3389/fpls.2016.00349 |
 2018, Vol. 26
2018, Vol. 26


