2. 三明学院资源与化工学院, 福建 三明 365004;
3. 福建省林业科学研究院, 福州 350012
2. School of Resources and Chemical Engineering, Sanming University, Sanming 365004, Fujian, China;
3. Fujian Academy of Forestry, Fuzhou 350012, China
盐分是影响植物生长与分布的重要环境因子之一。盐胁迫下,植物细胞内离子平衡被破坏,各条代谢途径产生大量的活性氧(ROS),对细胞膜脂和蛋白质等生物大分子造成损伤,最终使膜的完整性受到破坏,导致一系列生理代谢紊乱[1]。在遭受盐胁迫时,植物常常通过抗氧化系统中的酶类和非酶类抗氧化物质之间的协同作用来抵御盐胁迫引起的氧化胁迫[2]。耐盐植物长期生活在高浓度盐环境中,在进化中形成了较强的抗氧化能力以有效清除ROS的伤害,对盐胁迫环境有较强的适应能力。红树植物是生长于热带亚热带海岸潮间带的典型木本耐盐植物,具有较强的耐盐性[3]。因此研究红树植物抗氧化系统在抵御盐胁迫中的作用具有重要意义。
目前,关于抗氧化系统在红树植物耐盐中的作用已有一些研究报道。拉关木(Laguncularia race- mosa)和无瓣海桑(Sonneratia apetala)在盐胁迫下体内多种抗氧化酶活性均随盐浓度的升高而增加,但耐盐性更强的拉关木增加幅度更高[4]。在盐胁迫下, 桐花树(Aegiceras corniculatum)[5]和海滨木槿(Hibi- scus hamabo)[6]叶片中过氧化氢(H2O2)含量和抗坏血酸过氧化物酶(APX)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽还原酶(GR)、超氧化物歧化酶(SOD)等抗氧化酶活性均升高,而丙二醛(MDA)含量却没有变化,表明抗氧化酶通过及时清除ROS减轻其对膜脂的伤害。秋茄(Kandelia candel)是福建乃至全国最普遍的一种红树植物,是红树植物人工造林的主要物种。盐分是影响秋茄幼苗成活的主要因素之一[7]。目前,关于盐胁迫引起秋茄根系抗氧化系统的研究较少[8-9],缺乏从抗氧化酶和抗氧化剂两个方面的综合研究。根是植物逆境反应中最为敏感的部位,已有研究表明,根系在短期(1~7 d)胁迫下就会表现显著的生理响应[10]。本文以秋茄幼苗为供试材料,通过测定不同浓度、不同时间NaCl处理的根系活性氧含量、抗氧化酶活性和抗氧化物含量等生理生化指标的变化,探索秋茄根系抗氧化系统在耐盐中的生理响应,揭示其耐盐特性,为提高红树植物秋茄育苗成活率和扩大红树植物分布提供理论依据。
1 材料和方法 1.1 材料和处理供试的秋茄胚轴采自福建省漳州市漳江口红树林自然保护区。挑选大小与成熟度相近、无损伤和病虫害、生活力强的胚轴植于45 cm×35 cm×25 cm的塑料盆中并加入Hogland营养液沙培,每盆种植20棵,每天傍晚用自来水补充散失的水分。每3 d更换1次营养液。待植株长至4叶后,用含有不同浓度NaCl [0 (对照)、200、400、600 mmol L–1]的Hoagland营养液浇灌秋茄幼苗,每天傍晚补充损失的水分。分别在处理1、3、5和7 d后采集秋茄幼苗根系,每个处理取20株苗,自来水清洗2次,再用蒸馏水洗涤2次,剪取全部根系,滤纸吸干表面水分并混匀,按每份2 g左右用锡箔纸包裹置液氮冷冻,后放–80℃冰箱保存,进行各项指标的测定。
1.2 试验方法超氧阴离子(
所有生理生化指标测定均设3次重复。数据采用SPSS 19.0软件进行方差分析,应用最小显著差法(LSD)进行多重比较。应用Microsoft Excel 2007软件进行图表绘制。
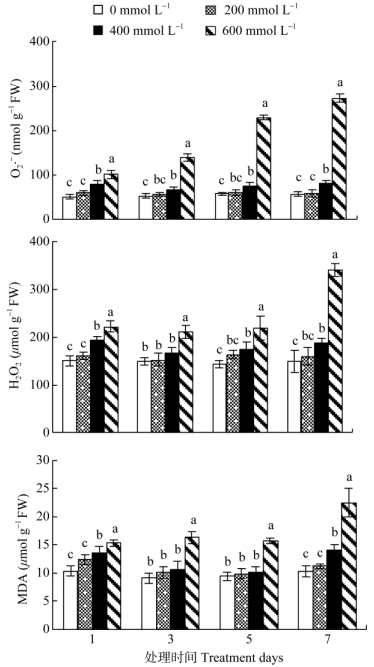
2 结果和分析 2.1 ROS和MDA含量的变化大量研究表明,盐胁迫会使植物体内自由基大量积累,引起膜脂过氧化,从而破坏细胞的完整性及其功能,最终使植物受害[15]。NaCl胁迫对秋茄根系中ROS (
|
图 1 NaCl胁迫对秋茄根系中ROS与MDA含量的影响。同一时间下柱子上不同字母表示差异显著(P < 0.05)。下图同。 Fig. 1 Effect of NaCl stress on ROS and MDA contents in Kandelia candel roots. Different letters upon column at the same time indicate significant difference at 0.05 level. The same is the following figures. |
MDA含量是衡量逆境下植物细胞膜脂过氧化程度的常用指标[17]。秋茄根系中MDA含量随NaCl浓度的增加总体呈上升趋势。除了中浓度处理1 d外,低浓度和中浓度胁迫短时间处理的MDA含量与对照均不存在显著变化;而高浓度胁迫处理的MDA含量均显著高于对照,处理7 d的MDA含量是对照的2.18倍。这表明,中低浓度或短时间盐胁迫对秋茄根系膜脂过氧化伤害较小,而高浓度胁迫给根系细胞膜脂带来严重的过氧化伤害。
2.2 抗氧化酶活性的变化盐胁迫对秋茄根系中抗氧化酶的活性产生影响(图 2),与对照相比,胁迫处理1 d,随NaCl浓度的增加,SOD活性下降,中浓度和高浓度处理的SOD活性分别下降了27.9%和42.0%,差异显著; 胁迫处理3和5 d,SOD活性随NaCl浓度的增加而显著升高;胁迫处理7 d,随着NaCl浓度的增加,SOD的活性先升高后下降,即低浓度和中浓度处理的SOD活性显著升高,而高浓度处理的活性显著降低。SOD是细胞中将

|
图 2 NaCl胁迫对秋茄根系中抗氧化酶活性的影响 Fig. 2 Effect of NaCl stress on antioxidant enzyme activities in Kandelia candel roots |
从图 2可以看出,相比于对照,低浓度胁迫处理1 d的POD活性无明显差异,而中浓度和高浓度处理的活性显著下降了18.0%和15.0%;胁迫处理3、5和7 d的POD活性随着NaCl浓度的增加呈先升高后降低的趋势,均显著高于对照,即中浓度胁迫处理的POD活性最高。虽然高浓度胁迫处理也使POD活性提高,但低于中浓度胁迫处理,这不利于有效地清除高浓度胁迫所导致的ROS大量累积。
从图 2可以看出,与对照相比,胁迫处理1 d的CAT活性随着NaCl浓度的升高而降低;胁迫处理3、5和7 d的CAT活性变化趋势与POD的类似,也是随着NaCl浓度的升高呈先升高后降低的趋势,即中浓度胁迫处理的CAT活性最高。但值得注意的是,高浓度胁迫处理7 d的CAT活性显著降低。这表明CAT活性受盐度的影响较大,在高浓度盐胁迫下其活性随处理时间的延长而持续降低。
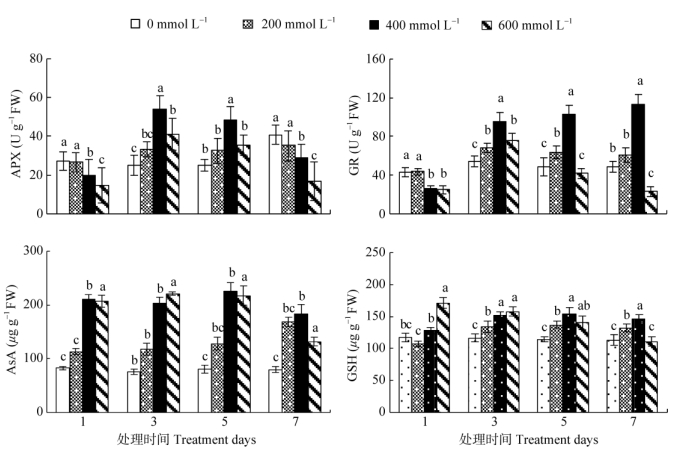
2.3 对AsA-GSH循环的影响AsA-GSH循环是植物体内清除ROS的重要代谢途径,包括APX、GR等抗氧化酶和AsA、GSH等抗氧化剂[18]。与对照相比(图 3),胁迫处理1 d, 随NaCl浓度的增加,APX活性呈下降趋势;胁迫处理3、5 d,APX活性随NaCl浓度的增加呈先升高后降低的趋势;胁迫处理7 d的APX活性变化趋势与处理1 d的相同。低浓度胁迫处理不同时间的APX活性与对照间无显著差异;当NaCl浓度为400 mmol L–1时,APX活性随处理时间的延长表现出先升后降的变化趋势,处理3 d的活性最高(是对照的2.17倍);高浓度胁迫处理的APX活性也表现为先升后降的变化趋势,但与中浓度胁迫处理不同的是,除处理3 d时升高外,其余处理时间均低于对照。这表明APX活性对NaCl浓度较为敏感,随NaCl浓度的升高,其活性迅速下降,当高浓度胁迫处理7 d的活性降至最低。
|
图 3 NaCl胁迫对秋茄根系中AsA-GSH循环的影响 Fig. 3 Effect of NaCl stress on AsA-GSH cycle in Kandelia candel roots |
从图 3可以看出,与对照相比,胁迫处理1 d的GR活性随NaCl浓度的增加先变化不大然后降低;胁迫处理3、5、7 d,GR活性随着NaCl浓度的增加均表现出先升后降的变化趋势,而且中低浓度胁迫处理的GR活性均显著高于对照,以400 mmol L–1 NaCl浓度处理5 d的最高,为对照的2.12倍,但高浓度胁迫处理7 d时GR活性下降了112.1%,表明中低浓度胁迫处理可激活GR的活性,但是高浓度胁迫处理会抑制GR的活性。
AsA含量总体上随着NaCl浓度的升高而增加(图 3)。与低浓度和高浓度胁迫处理相比,中浓度胁迫处理下的AsA含量比对照增加的幅度最大,尤其是在胁迫处理5 d的AsA含量达到峰值(是对照的2.78倍);低浓度胁迫处理的AsA含量随处理时间的延长而不断升高,而高浓度胁迫处理的则相反。这些结果表明,AsA在低浓度胁迫下可以诱导合成, 且在较长时间内其含量可以维持在较高的水平,但长时间高浓度胁迫不利于AsA的合成。GSH是AsA- GSH循环中另一个重要的抗氧化剂,可以直接与ROS自由基反应以清除ROS[18]。在低浓度和中浓度胁迫处理下,GSH含量随处理时间的延长呈上升趋势(图 3),且都显著高于对照;而高浓度胁迫的GSH含量随着处理时间的延长呈下降趋势, 处理7 d的GSH含量与对照无显著差异。这说明, 当NaCl大于400 mmol L–1时,随着胁迫时间的延长,秋茄根系中GSH的产生不断减少,不利于生长。
3 讨论众所周知,盐胁迫打破了植物体内ROS产生和清除的动态平衡,导致ROS大量积累,超过了植物的耐受阈值,破坏细胞膜脂、蛋白、核酸等大分子物质,最终造成细胞功能紊乱而引起伤害[19]。MDA是活性氧对细胞膜脂过氧化伤害的最终产物之一,其含量变化可以反映出组织受氧化胁迫的伤害程度。大量研究结果表明,在盐胁迫条件下,植物膜透性和MDA含量均随盐浓度的增加而提高[20-21]。秋茄幼苗在中低浓度(200和400 mmol L–1 NaCl)短期胁迫下,根系内ROS (
植物体内的抗氧化系统含有多种抗氧化酶,可以保护细胞膜结构的完整性,稳定膜的透性。已有研究表明,盐生植物在遭受盐胁迫时,SOD、POD和CAT等抗氧化酶的活性明显增强[6, 24]。SOD属于金属酶类,是生物体中普遍存在的一种抗氧化酶, 在抗氧化酶体系中处在核心地位。SOD可以通过歧化反应将
AsA-GSH循环是植物抗氧化系统的重要组成部分。植物体内产生的H2O2会被AsA-GSH循环中的重要抗氧化剂AsA和GSH所直接清除[29]。APX以AsA为底物,可将H2O2转变成H2O,以达到清除的目的,而且GSH可以直接与ROS自由基反应转变为GSSG,GSSG可以在GR的催化反应下被NADPH还原为GSH,进入下一轮循环,这样可以实现对自由基的持续清除,以提高抗逆性。有研究表明,酸枣(Ziziphus acidojujuba)实生苗在NaCl胁迫下,根和叶片中AsA和GSH含量显著增加,APX活性随NaCl浓度的增加而逐渐下降,GR活性在根中变化不明显,而在叶片中随NaCl浓度的增加而升高[18, 30]。NaCl胁迫处理引起盐生植物黄花补血草(Limonium aureum)幼苗叶片中GR活性的增强, 50 mmol L–1 NaCl胁迫处理的AsA和GSH含量均显著增加,而150 mmol L–1 NaCl胁迫处理的AsA含量仍继续增加,但GSH含量却明显下降[31];在NaCl胁迫处理下,葡萄(Vitis vinifera)叶片中AsA与GSH含量显著下降,而APX、GR等的活性却显著升高[32]。与前人的研究类似,本研究也表明,NaCl胁迫处理不同时间,秋茄根系中AsA和GSH含量总体上均显著高于对照,而APX和GR活性整体上表现出先升高后降低的变化趋势,中低浓度胁迫处理下的活性均显著高于对照,这说明秋茄根系可以通过AsA-GSH循环系统中AsA和GSH的循环来清除ROS,从而提高耐盐能力。
综上所述,秋茄根系在中低浓度胁迫(200和400 mmol L–1 NaCl)处理下可以通过提高抗氧化系统活性来提升ROS的清除效率,维持细胞内ROS的动态平衡,避免NaCl胁迫对细胞的伤害。虽然高浓度(600 mmol L–1 NaCl)胁迫造成秋茄根系ROS的急剧增加,但是在短时间(少于5 d)内,秋茄可以通过自身较强的抗氧化系统减轻ROS造成的伤害。因此,本研究认为红树植物秋茄幼苗可以在中低浓度下正常生长,并能抵御短时间的高浓度胁迫。本文所设置的0、200、400、600 mmol L–1 NaCl相当于海水的0‰、11.6‰、23.4‰、35.1‰的盐度,这与谭芳林等[7]的盐度设计相类似,研究结果也可以作为指导秋茄幼苗滩涂种植的实验参考依据。
| [1] | ZHU J K. Plant salt tolerance[J]. Trends Plant Sci, 2001, 6(2): 66-71. DOI:10.1016/S1360-1385(00)01838-0 |
| [2] | DEINLEIN U, STEPHAN A B, HORIE T, et al. Plant salt-tolerance mechanisms[J]. Trends Plant Sci, 2014, 19(6): 371-379. DOI:10.1016/j.tplants.2014.02.001 |
| [3] |
LIN P.
Mangrove Ecosystem in China[M]. Beijing: Science Press, 1997: 297-316.
林鹏. 中国红树林生态系[M]. 北京: 科学出版社, 1997: 297-316. |
| [4] |
CHEN J, LI N Y, LIU Q, et al. Antioxidant defense and photosynthesis for non-indigenous mangrove species Sonneratia apetala and Laguncu-laria racemosa under NaCl stress[J].
Chin J Plant Ecol, 2013, 37(5): 443-453. 陈坚, 李妮亚, 刘强, 等. NaCl处理下两种引进红树的光合及抗氧化防御能力[J]. 植物生态学报, 2013, 37(5): 443-453. DOI:10.3724/SP.J.1258.2013.00046 |
| [5] | PARIDA A K, DAS A B, SANADA Y, et al. Effects of salinity on biochemical components of the mangrove, Aegiceras corniculatum[J]. Aquat Bot, 2004, 80(2): 77-87. DOI:10.1016/j.aquabot.2004.07.005 |
| [6] |
BO P F, SUN X L, SUN T H, et al. Antioxidative system and osmotic regulation in seedlings of annual Hibiscus hamabo Sieb. et Zucc. under salt stress[J].
Acta Bot Boreali-Occid Sin, 2008, 28(1): 113-118. 薄鹏飞, 孙秀玲, 孙同虎, 等. NaCl胁迫对海滨木槿抗氧化系统和渗透调节的影响[J]. 西北植物学报, 2008, 28(1): 113-118. DOI:10.3321/j.issn:1000-4025.2008.01.021 |
| [7] |
TAN F L, YOU H M, HUANG L, et al. Physiological adaptability of Kandelia candel seedlings to salt-water stress[J].
Chin J Trop Crops, 2014, 35(11): 2179-2184. 谭芳林, 游惠明, 黄丽, 等. 秋茄幼苗对盐度-淹水双胁迫的生理适应[J]. 热带作物学报, 2014, 35(11): 2179-2184. DOI:10.3969/j.issn.1000-2561.2014.11.014 |
| [8] |
MA J H, ZHENG H L, ZHANG C G, et al. Effects of salinity on protein, H2O2 content and lipid peroxidation in Kandelia candel and Aegiceras coniculatum seedlings[J].
J Xiamen Univ (Nat Sci), 2002, 41(3): 354-358. 马建华, 郑海雷, 张春光, 等. 盐度对秋茄和桐花树幼苗蛋白质、H2O2及脂质过氧化作用的影响[J]. 厦门大学学报(自然科学版), 2002, 41(3): 354-358. DOI:10.3321/j.issn:0438-0479.2002.03.020 |
| [9] |
HUANG W, LIN X F, LI G Y, et al. Effect of salinity on some physiological characteristics of Kandelia candel[J].
Nat Sci J Hainan Univ, 2002, 20(4): 328-331. 黄薇, 林栖凤, 李冠一, 等. 盐分对红树植物秋茄某些生理特性的影响[J]. 海南大学学报(自然科学版), 2002, 20(4): 328-331. DOI:10.3969/j.issn.1004-1729.2002.04.009 |
| [10] | ROZEMA J, SCHAT H. Salt tolerance of halophytes, research ques-tions reviewed in the perspective of saline agriculture[J]. Environ Exp Bot, 2013, 92: 83-95. DOI:10.1016/j.envexpbot.2012.08.004 |
| [11] |
LI H S.
Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 164-168.
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版, 2000: 164-168. |
| [12] |
LI L.
Experiment Guidance in Plant Physiology Module[M]. Beijing: Science Press, 2009: 80-85.
李玲. 植物生理学模块实验指导[M]. 北京: 科学出版社, 2009: 80-85. |
| [13] | HALLIWELL B, FOYER C H. Properties and physiological function of a glutathione reductase purified from spinach leaves by affinity chromatography[J]. Planta, 1978, 139(1): 9-17. DOI:10.1007/BF00390803 |
| [14] | LAW M Y, CHARLES S A, HALLIWELL B. Glutathione and ascorbic acid in spinach (Spinacia oleracea) chloroplasts:The effect of hydrogen peroxide and of paraquat[J]. Biochem J, 1983, 210(3): 899-903. DOI:10.1042/bj2100899 |
| [15] | BLOKHINA O, VIROLAINEN E, FAGERSTEDT K V. Antioxidants, oxidative damage and oxygen deprivation stress:A review[J]. Ann Bot, 2003, 91(2): 179-194. DOI:10.1093/aob/mcf118 |
| [16] | MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends Plant Sci, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
| [17] |
WANG Y X, SUN G R, WANG J B, et al. Relationships among MDA content, plasma membrane permeability and the chlorophyll fluore-scence parameters of Puccinellia tenuiflora seedlings under NaCl stress[J].
Acta Ecol Sin, 2006, 26(1): 122-129. 汪月霞, 孙国荣, 王建波, 等. NaCl胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J]. 生态学报, 2006, 26(1): 122-129. |
| [18] |
LÜ X M, YANG Y F, LU X Y, et al. Effects of CaCl2 on the AsA-GSH cycle of sour jujube seedlings under NaCl stress[J].
Acta Hort Sin, 2017, 44(5): 953-962. 吕新民, 杨怡帆, 鲁晓燕, 等. CaCl2对NaCl胁迫下酸枣苗AsA-GSH循环的影响[J]. 园艺学报, 2017, 44(5): 953-962. DOI:10.16420/j.issn.0513-353x.2016-0786 |
| [19] |
WANG X F, GAO W Q, LIU J F, et al. Plant defensive strategies and environment-driven mechanisms[J].
Chin J Ecol, 2015, 34(12): 3542-3552. 王小菲, 高文强, 刘建锋, 等. 植物防御策略及其环境驱动机制[J]. 生态学杂志, 2015, 34(12): 3542-3552. |
| [20] | HU L X, LI H Y, PANG H C, et al. Responses of antioxidant gene, protein and enzymes to salinity stress in two genotypes of perennial ryegrass (Lolium perenne) differing in salt tolerance[J]. J Plant Physiol, 2012, 169(2): 146-156. DOI:10.1016/j.jplph.2011.08.020 |
| [21] | YANG Y L, SHI R X, WEI X L, et al. Effect of salinity on antioxidant enzymes in calli of the halophyte Nitraria tangutorum Bobr[J]. Plant Cell Tiss Org Cult, 2010, 102(3): 387-395. DOI:10.1007/s11240-010-9745-1 |
| [22] | WANG L X, PAN D Z, LV X J, et al. A multilevel investigation to discover why Kandelia candel thrives in high salinity[J]. Plant Cell Environ, 2016, 39(11): 2486-2497. DOI:10.1111/pce.12804 |
| [23] |
LIN P, WANG W Q. Changes in the caloric values of Kandelia candel seedlings under salt stress[J].
Acta Phytoecol Sin, 1999, 23(5): 466-470. 林鹏, 王文卿. 盐胁迫下红树植物秋茄(Kandelia candel)热值变化的研究[J]. 植物生态学报, 1999, 23(5): 466-470. |
| [24] |
SA R N, CHEN G L. Effect of exogenous spermidine on antioxidant enzyme system in leaves of Nitraria sibirica Pall. seedlings under salt stress[J].
Acta Bot Boreali-Occid Sin, 2013, 33(2): 352-356. 萨日娜, 陈贵林. 外源亚精胺对盐胁迫下白刺幼苗叶片抗氧化酶系统的影响[J]. 西北植物学报, 2013, 33(2): 352-356. DOI:10.3969/j.issn.1000-4025.2013.02.022 |
| [25] | AGARWAL S, PANDEY V. Antioxidant enzyme responses to NaCl stress in Cassia angustifolia[J]. Biol Plant, 2004, 48(4): 555-560. DOI:10.1023/B:BIOP.0000047152.07878.e7 |
| [26] | NOCTOR G, FOYER C H. Ascorbate and glutathione:Keeping active oxygen under control[J]. Annu Rev Plant Physiol Plant Mol Biol, 1998, 49: 249-279. DOI:10.1146/annurev.arplant.49.1.249 |
| [27] | DUNFORD H B, STILLMAN J S. On the function and mechanism of action of peroxidases[J]. Coord Chem Rev, 1976, 19(3): 187-251. DOI:10.1016/S0010-8545(00)80316-1 |
| [28] |
WANG W Q, LIN P. Study on the membrane lipid peroxidation of the leaves of Kandelia candel seedlings to long-term and short-term salinity[J].
Acta Oceanol Sin, 2000, 22(3): 49-54. 王文卿, 林鹏. 不同盐胁迫时间下秋茄幼苗叶片膜脂过氧化作用的研究[J]. 海洋学报, 2000, 22(3): 49-54. DOI:10.3321/j.issn:0253-4193.2000.03.007 |
| [29] | WANG L, PAN D, LI J, et al. Proteomic analysis of changes in the Kandelia candel chloroplast proteins reveals pathways associated with salt tolerance[J]. Plant Sci, 2015, 231: 159-172. DOI:10.1016/j.plantsci.2014.11.013 |
| [30] | SORKHEH K, SHIRAN B, ROUHI V, et al. Salt stress induction of some key antioxidant enzymes and metabolites in eight Iranian wild almond species[J]. Acta Physiol Plant, 2012, 34(1): 203-213. DOI:10.1007/s11738-011-0819-4 |
| [31] |
LÜ X M, YANG Y F, LU X Y, et al. Effects of NaCl stress on the AsA-GSH cycle in sour jujube seedlings[J].
Plant Physiol J, 2016, 52(5): 736-744. 吕新民, 杨怡帆, 鲁晓燕, 等. NaCl胁迫对酸枣幼苗AsA-GSH循环的影响[J]. 植物生理学报, 2016, 52(5): 736-744. DOI:10.13592/j.cnki.ppj.2015.0706 |
| [32] |
YANG Y L, MA T, L L R, et al. Effects of salinity stress on ascorbate-glutathione cycle in the leaves of Limonium aureum (L.) Hill seedlings[J].
J NW Norm Univ (Nat Sci), 2016, 52(3): 84-89. 杨颖丽, 马婷, 吕丽荣, 等. 盐胁迫对黄花补血草幼苗叶片抗坏血酸-谷胱甘肽循环的影响[J]. 西北师范大学学报(自然科学版), 2016, 52(3): 84-89. DOI:10.16783/j.cnki.nwnuz.2016.03.016 |
| [33] |
ZHAO B L, LIU P, WANG W J, et al. Effects of 5-aminolevulinic acid on the AsA-GSH cycle in grape leaves under salt stress[J].
Plant Physiol J, 2015, 51(3): 385-390. 赵宝龙, 刘鹏, 王文静, 等. 5-氨基乙酰丙酸(ALA)对盐胁迫下葡萄叶片中AsA-GSH循环的影响[J]. 植物生理学报, 2015, 51(3): 385-390. DOI:10.13592/j.cnki.ppj.2015.0082 |
 2018, Vol. 26
2018, Vol. 26


