2. 海南科技职业学院药食同源植物资源海南省重点实验室, 海口 571126
2. Key Laboratory of Medicinal and Edible Plants Resources of Hainan Province, Hainan Institute of Science and Technology, Haikou 571126, China
番荔枝科(Annonaceae)植物的根、茎和果实大多都具有很好的药用价值,在治疗风湿骨痛,疮毒和抗肿瘤等方面有独特功效[1]。现代药理活性研究表明,该科植物具有显著的抗肿瘤﹑抗菌﹑抗氧化以及抗炎镇痛等药理活性作用[2]。皂帽花属(Dasymaschalon)植物,为灌木或小乔木,全世界有16种,分布于热带亚洲。我国有3种,主要分布在云南、广东、广西和海南等地。研究表明,皂帽花属植物主要含生物碱、萜类、黄酮、番荔枝内脂和环己烯等成分,其中部分化合物展现出了良好的抗肿瘤、抗菌、抗炎、抗病毒生物活性[3-6]。
喙果皂帽花(Dasymaschalon rostratum Merr.)又名白叶皂帽花,为平均高度8 m的乔木,主要分布在我国广东、广西、云南、西藏和海南等地,常生于海拔500~1 000 m的山地密林中或山谷溪旁疏林中[7]。本实验室前期研究表明,皂帽花提取物具有良好抗肿瘤、抗菌和抗HIV活性[8-10]。为进一步研究喙果皂帽花中具有优良生物活性的化学成分,我们首次对喙果皂帽花根进行化学成分研究,从中分离鉴定了8个化合物。所有化合物均为首次从该植物中分离得到,并测定了所有化合物的抗菌活性。
1 材料和方法 1.1 仪器和材料Bruker AV-400MHz核磁共振仪(瑞士Bruker公司);Agilent 1260半制备液相色谱(美国Agilent科技有限公司);Finnigan-MAT-95-MS质谱仪(德国Finnigan公司);TopPetter可调式移液器(北京大龙兴创实验仪器有限公司);96孔板;锥形瓶;酒精灯;超净工作台;酶标仪(ELx800);接种针;高温灭菌锅;培养皿;恒温振荡器;培养基恒温培养箱。
Sephadex LH-20葡聚糖LH-20凝胶(Amersham Blosclences公司);100~200、200~300目柱层析用硅胶(青岛海洋化工厂分厂);分析纯石油醚、乙酸乙酯、氯仿、丙酮、甲醇、乙醇;色谱纯甲醇、乙腈。
供试细菌:四联球菌(Micrococcus tetragenus, ATCC 13623)、蜡状芽孢杆菌(Bacillus cereus, ATCC 14579)、枯草芽孢杆菌(B. subtilis, ATCC 9372)、白色葡萄球菌(Staphylococcus albus, ATCC 8799)和大肠杆菌(Escherichia coli, ATCC 25922),所有菌株均由中国海洋大学王长云教授馈赠。
材料于2017年1月采集于海南省昌江霸王岭国家森林公园,经海南师范大学生命科学学院钟琼芯教授鉴定为番荔枝科皂帽花属植物喙果皂帽花(Dasymaschalon rostratum Merr.)植物的根,标本保存于海南师范大学热带药用植物化学教育部重点实验室标本室。
1.2 提取和分离喙果皂帽花根4.96 kg,阴干粉碎后,用90%乙醇25 L浸泡3次,每次7 d,合并浸泡液,提取物用3 L水分散,依次采用石油醚、乙酸乙酯等体积充分萃取,合并浓缩得对应石油醚萃取部位37.8 g、乙酸乙酯萃取部位37.1 g。乙酸乙酯萃取部位经正相硅胶柱色谱分离,用石油醚-乙酸乙酯[20:1, 10:1, 5:1, 3:1, 1:1 (V/V, 下同)]梯度洗脱,而后用氯仿-甲醇(100:0, 20:1, 10:1, 4:1, 0:100)梯度洗脱得到12个馏分(Fr.1~Fr.12)。Fr.7经硅胶柱色谱石油醚-乙酸乙酯(9:1~1:9)梯度洗脱,收集流份,薄层色谱检查,合并为8个亚组份(F7-1~ F7-9)。F7-3经凝胶柱色谱分离,三氯甲烷-甲醇(1:1)洗脱,得化合物8 (14 mg)。F7-4经高效液相色谱制备,用乙腈-水(12:88)为流动相,流速3 mL min-1, 得化合物7 (6 mg)。F7-6经凝胶柱色谱分离,三氯甲烷-甲醇(1:1)洗脱,收集流份,薄层色谱检查, 合并为4个亚组分(F7-6-1~F7-6-4),F7-6-2经高效液相色谱制备,用乙腈-水(62:38)为流动相,流速3 mL min-1,得化合物1 (18 mg)。F7-7经高效液相色谱制备,用乙腈-水(40:60)为流动相,流速为3 mL min-1,得化合物2 (5 mg)和3 (8 mg)。F7-8经凝胶柱色谱分离,三氯甲烷-甲醇(1:1)洗脱,收集流份,薄层色谱检查,合并为3个亚组分(F7-8-1~ F7-8-3),F7-8-3经高效液相色谱制备,用乙腈-水(28:72)为流动相,流速为3 mL min-1,得化合物4 (42 mg)、5 (23 mg)和6 (12 mg)。化合物1~8结构见图 1。
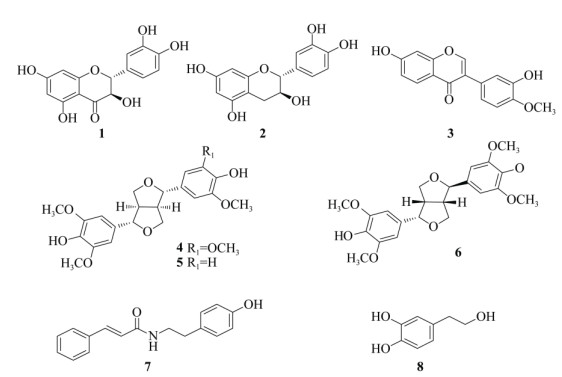
|
图 1 化合物1~8的化学结构 Fig. 1 Structures of compounds 1–8 |
(+)-花旗松素[(+)-taxifolin, 1] 淡黄色针晶(CH3OH),ESI-MS m/z: 305 [M + H]+。1H NMR (CD3OD, 400 MHz): δ 6.96 (1H, d, J = 2.0 Hz, H-2ʹ), 6.84 (1H, dd, J = 2.0, 8.0 Hz, H-6ʹ), 6.80 (1H, d, J = 8.0 Hz, H-5ʹ), 5.91 (1H, d, J = 2.0 Hz, H-6), 5.88 (1H, d, J = 2.0 Hz, H-8), 4.92 (1H, d, J = 11.6 Hz, H-2), 4.50 (1H, d, J = 11.6 Hz, H-3); 13C NMR (CD3OD, 100 MHz): δ 85.1 (C-2), 73.7 (C-3), 198.3 (C-4), 165.3 (C-5), 97.4 (C-6), 169.0 (C-7), 96.3 (C-8), 164.5 (C-9), 101.8 (C-10), 129.9 (C-1ʹ), 116.1 (C-2ʹ), 146.3 (C-3ʹ), 147.1 (C-4ʹ), 115.9 (C-5ʹ), 120.9 (C-6ʹ)。以上波谱数据与文献[11]报道基本一致,故鉴定为(+)-花旗松素。
(+)-儿茶素[(+)-catechin, 2] 白色粉末, ESI-MS m/z: 291 [M + H]+。1H NMR (DMSO-d6, 400 MHz): δ 6.71 (1H, d, J = 1.6 Hz, H-2ʹ), 6.68 (1H, d, J = 8.0 Hz, H-5ʹ), 6.59 (1H, dd, J = 1.6, 8.0 Hz, H-6ʹ), 5.88 (1H, d, J = 2.4 Hz, H-8), 5.68 (1H, d, J = 2.4 Hz, H-6), 4.48 (1H, d, J = 7.6 Hz, H-2), 3.81 (1H, m, H-3), 2.65 (1H, dd, J = 5.6, 16.4 Hz, H-4a), 2.34 (1H, dd, J = 8.4, 16.4 Hz, H-4b); 13C NMR (DMSO-d6, 100 MHz): δ 81.0 (C-2), 66.4 (C-3), 27.9 (C-4), 145.0 (C-5), 93.9 (C-6), 156.2 (C-7), 95.2 (C-8), 156.5 (C-9), 99.1 (C-10), 130.6 (C-1ʹ), 115.2 (C-2ʹ), 145.0 (C-3ʹ), 155.4 (C-4ʹ), 118.5 (C-5ʹ), 114.6 (C-6ʹ)。以上波谱数据与文献[12]报道基本一致,故鉴定为(+)-儿茶素。
毛蕊异黄酮(calycosin, 3) 白色粉末, ESI-MS m/z: 285 [M + H]+。1H NMR (Acetone-d6, 400 MHz): δ 8.14 (1H, s, H-2), 8.05 (1H, d, J = 8.8 Hz, H-5), 7.16 (1H, d, J = 2.0 Hz, H-2ʹ), 7.06 (1H, dd, J = 2.0, 8.4 Hz, H-6 ʹ), 7.00 (1H, dd, J = 2.4, 8.8 Hz, H-6), 6.98 (1H, d, J = 8.4 Hz, H-5ʹ), 6.89 (1H, d, J = 2.4 Hz, H-8), 3.87 (3H, s, OCH3); 13C NMR (Acetone-d6, 100 MHz): δ 153.4 (C-2), 125.0 (C-3), 175.6 (C-4), 128.4 (C-5), 115.9 (C-6), 163.7 (C-7), 103.2 (C-8), 158.8 (C-9), 118.4 (C-10), 126.4 (C-1ʹ), 116.9 (C-2ʹ), 147.1 (C-3ʹ), 148.3 (C-4ʹ), 112.2 (C-5ʹ), 121.1 (C-6ʹ), 56.3 (OCH3)。以上波谱数据与文献[13]报道基本一致,故鉴定为毛蕊异黄酮。
(-)-丁香树脂酚[(-)-syringaresinol, 4] 无色针状晶体(CH3OH),ESI-MS m/z: 419 [M + H]+。1H NMR (Acetone-d6, 400 MHz): δ 6.68 (4H, s, H-2, 2ʹ, 6, 6ʹ), 4.66 (2H, d, J = 4.4 Hz, H-7, 7ʹ), 4.23 (2H, dd, J = 6.8, 8.8 Hz, H-9a, 9ʹa), 3.84 (2H, d, J = 3.6 Hz, H-9b, 9ʹb), 3.83 (12H, s, OCH3×4), 3.10 (2H, m, H-8, 8ʹ); 13C NMR (Acetone-d6, 100 MHz): δ 133.2 (C-1, 1ʹ), 104.4 (C-2, 2ʹ, 6, 6ʹ), 148.7 (C-3, 3ʹ, 5, 5ʹ), 136.2 (C-4, 4ʹ), 86.8 (C-7, 7ʹ), 55.3 (C-8, 8ʹ), 72.3 (C-9, 9ʹ), 56.6 (OCH3×4)。以上波谱数据与文献[14]报道基本一致,故鉴定为(-)-丁香树脂酚。
(-)-皮树脂醇[(-)-medioresinol, 5] 白色粉末,ESI-MS m/z: 389 [M + H]+。1H NMR (Acetone-d6, 400 MHz): δ 6.98 (1H, d, J = 1.6 Hz, H-2), 6.83 (1H, dd, J = 1.6, 8.0 Hz, H-6), 6.78 (1H, d, J = 8.0 Hz, H-5), 6.68 (2H, s, H-2ʹ, 6ʹ), 4.67 (2H, d, J = 4.4 Hz, H-7, 7ʹ), 4.20 (2H, m, H-9), 3.84 (3H, s, OCH3-3), 3.82 (6H, s, OCH3-3ʹ, 5ʹ), 3.80 (2H, m, H-9ʹ), 3.08 (2H, m, H-8, 8ʹ); 13C NMR (Acetone-d6, 100 MHz): δ 134.2 (C-1), 110.6 (C-2), 148.3 (C-3), 146.9 (C-4), 115.5 (C-5), 119.6 (C-6), 133.2 (C-1ʹ), 104.4 (C-2ʹ, 6ʹ), 148.7 (C-3ʹ, 5ʹ), 136.2 (C-4ʹ), 86.6 (C-7), 86.8 (C-7ʹ), 55.2 (C-8), 55.3 (C-8ʹ), 72.2 (C-9), 72.3 (C-9ʹ), 56.2 (OCH3-3), 56.6 (OCH3-3ʹ, 5ʹ)。以上波谱数据与文献[15]报道基本一致,故鉴定为(-)-皮树脂醇。
lirioresinol A (6) 淡黄色粉末,ESI-MS m/z: 419 [M + H]+。1H NMR (Acetone-d6, 400 MHz): δ 6.69 (4H, s, H-2, 2ʹ, 6, 6ʹ), 4.82 (1H, d, J = 6.0 Hz, H-7), 4.35 (1H, d, J = 6.8 Hz, H-7ʹ), 4.13 (1H, d, J = 9.6 Hz, H-9a), 3.83 (6H, s, OCH3-3, 3ʹ), 3.82 (6H, s, OCH3-5, 5ʹ), 3.78 (1H, d, J = 2.8 Hz, H-9ʹa), 3.45 (2H, m, H-9b, 9ʹb), 3.22 (2H, m, H-8, 8ʹ); 13C NMR (Acetone-d6, 100 MHz): δ 130.4 (C-1), 104.0 (C-2, 6), 148.6 (C-3, 5), 133.3 (C-4), 82.8 (C-7), 50.8 (C-8), 70.2 (C-9), 136.3 (C-1ʹ), 104.4 (C-2ʹ, 6ʹ), 148.7 (C-3ʹ, 5ʹ), 136.2 (C-4ʹ), 88.7 (C-7ʹ), 55.7 (C-8ʹ), 71.5 (C-9ʹ), 56.6 (OCH3-3, 3ʹ, 5, 5ʹ)。以上波谱数据与文献[16]报道基本一致,故鉴定为lirioresinol A。
N-反式肉桂酸酰对羟基苯乙胺(N-trans-cinnamoyltyramine, 7) 白色粉末,ESI-MS m/z: 268 [M + H]+。1H NMR (CD3OD, 400 MHz): δ 7.54 (3H, m, H-3ʹ, 4ʹ, 5ʹ), 7.37 (3H, m, H-2ʹ, 6ʹ, 7ʹ), 7.06 (2H, d, J = 8.4 Hz, H-2, 6), 6.72 (2H, d, J = 8.4 Hz, H-3, 5), 6.58 (1H, d, J = 16.0 Hz, H-8ʹ), 3.47 (2H, t, J = 7.2, 14.8 Hz, H-8), 2.76 (2H, t, J = 7.6, 14.8 Hz, H-7); 13C NMR (CD3OD, 100 MHz): δ 131.3 (C-1), 130.7 (C-2, 6), 116.3 (C-3, 5), 157.0 (C-4), 35.8 (C-7), 42.6 (C-8), 168.6 (C-9), 136.3 (C-1ʹ), 128.8 (C-2ʹ, 6ʹ), 130.0 (C-3ʹ, 5ʹ), 130.8 (C-4ʹ), 141.6 (C-7ʹ), 121.9 (C-8ʹ)。以上波谱数据与文献[17]报道基本一致,故鉴定为N-反式肉桂酸酰对羟基苯乙胺。
羟基酪醇(hydroxytyrosol, 8) 棕色油状, ESI-MS m/z: 155 [M + H]+。1H NMR (DMSO-d6, 400 MHz): δ 6.60 (1H, d, J = 8.0 Hz, H-5), 6.57 (1H, d, J = 2.0 Hz, H-2), 6.42 (1H, dd, J = 2.0, 8.0 Hz, H-6), 3.49 (2H, t, J = 7.2, 14.8 Hz, H-8), 2.53 (2H, t, J = 7.2, 12.4 Hz, H-7); 13C NMR (DMSO-d6, 100 MHz): δ 130.2 (C-1), 115.4 (C-2), 145.0 (C-3), 143.4 (C-4), 116.3 (C-5), 119.5 (C-6), 38.6 (C-7), 62.7 (C-8)。以上波谱数据与文献[18]报道基本一致,故鉴定为羟基酪醇。
1.4 抗菌活性采用微量稀释法[19]测定化合物1~8对四联球菌、蜡状芽孢杆菌、枯草芽孢杆菌、白色葡萄球菌和大肠杆菌等5株菌的抗菌活性,阳性对照为环丙沙星,阴性对照为DMSO。结果表明,所有化合物对5种测试菌株均无明显抑制作用。
2 结果和讨论本研究采用多种分离方法结合光谱波谱鉴定技术,从喙果皂帽花根中分离得到8个化合物,分别是花旗松素(1)、(+)-儿茶素(2)、毛蕊异黄酮(3)、(-)-丁香树脂酚(4)、(-)-皮树脂醇(5)、lirio-resinol A (6)、N-反式肉桂酸酰对羟基苯乙胺(7)和羟基酪醇(8),化合物1~8均为首次从该植物中分离得到。化合物1~8对四联球菌、蜡状芽孢杆菌、枯草芽孢杆菌、白色葡萄球菌和大肠杆菌5种菌均无明显抑制作用。
花旗松素(1)对Moloney鼠白血球增多症病毒反转录酶表现出极高的抑制效应[20]。(+)-儿茶素(2)可以抑制皮肤、肺、肝、小肠、结肠、膀胱癌等的发生[21]。毛蕊异黄酮(3)低浓度( < 16 mol L–1)可以促进ER阳性的乳腺癌MCF-7细胞增殖,并且能够减少细胞早期凋亡率的发生,高浓度可抑制MCF-7和T-47D细胞生长[22]。羟基酪醇(8)具有的强抗氧化能力,既可以高效地清除内源性和外源性的自由基与氧化物,又可以抑制不饱和脂肪酸的氧化,作为一种优良抗氧化活性的酚类化合物已被广泛应用在诸多领域[23]。
本研究丰富了喙果皂帽花的化学成分组成,为喙果皂帽花药用的进一步开发与利用提供了科学依据。
| [1] |
HU C M, WU J H. Progress in study of flavonoids from Annonaceae and biological activities of these compounds[J].
China J Chin Mat Med, 2007, 32(9): 765-770. 胡春梅, 吴久鸿. 番荔枝科植物之黄酮类化合物及其生物活性研究进展[J]. 中国中药杂志, 2007, 32(9): 765-770. DOI:10.3321/j.issn:1001-5302.2007.09.001 |
| [2] |
YANG S L, YU J G, XU L Z. Chemical constituents of annonaceae plants and their antitumor activities[J].
Acta Acad Med Sin, 2000, 22(4): 376-382. 杨世林, 余竞光, 徐丽珍. 番荔枝科植物化学成分及其抗肿瘤活性[J]. 中国医学科学院学报, 2000, 22(4): 376-382. |
| [3] | LIU Y L, HO D K, CASSADY J M, et al. Dasytrichone, a novel flavone from Dasymaschalon trichophorum with cancer chemopre-ventive potential[J]. Nat Prod Lett, 1992, 1(3): 161-165. DOI:10.1080/10575639208048906 |
| [4] | SINZ A, MATUSCH R, SANTISUK T, et al. Flavonol glycosides from Dasymaschalon sootepense[J]. Phytochemistry, 1998, 47(7): 1393-1396. DOI:10.1016/S0031-9422(97)00719-X |
| [5] | PRAWAT U, CHAIRERK O, LENTHAS R, et al. Two new cycloar-tane-type triterpenoids and one new flavanone from the leaves of Dasymaschalon dasymaschalum and their biological activity[J]. Phytochem Lett, 2013, 6(2): 286-290. DOI:10.1016/j.phytol.2013.03.002 |
| [6] | HONGTHONG S, KUHAKARN C, JAIPETCH T, et al. Polyoxy-genated cyclohexene derivatives isolated from Dasymaschalon soote-pense and their biological activities[J]. Fitoterapia, 2015, 106: 158-166. DOI:10.1016/j.fitote.2015.09.001 |
| [7] |
Deletis Florae Reipublicae Popularis Sinicae Agendae Academiae Sinicae Edita.
Flora Reipublicae Popularis Sinicae, Tomus 2[M]. Beijing: Science Press, 1959: 30.
中国科学院中国植物志编辑委员会. 中国植物志, 第2卷[M]. 北京: 科学出版社, 1959: 30. |
| [8] |
LI X B, CHEN G Y, SONG X P, et al. Composition and antitumor activities of essential oil from the fruits of Dasymaschalon tricho-phorum[J].
J Chin Med Mat, 2013, 36(11): 1786-1788. 李小宝, 陈光英, 宋小平, 等. 皂帽花果实挥发油成分及抗肿瘤活性研究[J]. 中药材, 2013, 36(11): 1786-1788. DOI:10.13863/j.issn1001-4454.2013.11.038 |
| [9] |
SONG H W, SONG X M, HAN C R, et al. GC-MS analysis and bioactivity of essential oil from Dasymaschalon rostratum[J].
Chin J Exp Trad Med Form, 2013, 19(16): 132-136. 宋煌旺, 宋鑫明, 韩长日, 等. 喙果皂帽花挥发油GC-MS分析及活性研究[J]. 中国实验方剂学杂志, 2013, 19(16): 132-136. DOI:10.11653/syfj2013160132 |
| [10] |
Research and Technology Co., Ltd., Indiana University, Hainan Normal University. Extracts of Medicinal Plant and Uses Thereof:CN, CN102724990A[P]. 2012-10-10.
印第安纳大学研究及科技有限公司, 海南师范大学. 药用植物的提取物及其应用: 中国, CN102724990A[P]. 2012-10-10. |
| [11] | ABDULLAH N H, SALIM F, AHMAD R. Chemical constituents of malaysian U. cordata var. ferruginea and their in vitro α-glucosidase inhibitory activities[J/OL]. Molecules, 2016, 21(5):525. doi:10.3390/molecules21050525. |
| [12] | HOU A J, LIU Y Z, YANG H, et al. Hydrolyzable tannins and related polyphenols from Eucalyptus globulus[J]. J Asian Nat Prod Res, 2000, 2(3): 205-212. DOI:10.1080/10286020008039912 |
| [13] | KULESH N I, VASILEVSKAYA N A, VESELOVA M V, et al. Minor polyphenols from Maackia amurensis wood[J]. Chem Nat Compd, 2008, 44(6): 712-714. DOI:10.1007/s10600-009-9195-3 |
| [14] |
LI X R, LUO Y H, HE J, et al. Phenolic constituents and antioxidant activity of Eleocharis tuberosa peels[J].
Nat Prod Res Dev, 2013, 25(12): 1615-1620. 李行任, 罗杨合, 何隽, 等. 荸荠皮酚性成分及其抗氧化活性研究[J]. 天然产物研究与开发, 2013, 25(12): 1615-1620. DOI:10.16333/j.1001-6880.2013.12.010 |
| [15] |
JIANG Y P, LIU Y F, GUO Q L, et al. Lignanoids from an aqueous extract of the roots of Codonopsis pilosula[J].
Acta Pharm Sin, 2016, 51(4): 616-625. 蒋跃平, 刘玉凤, 郭庆兰, 等. 党参水提取物中的木脂素类化学成分[J]. 药学学报, 2016, 51(4): 616-625. DOI:10.16438/j.0513-4870.2015-0874 |
| [16] |
XU M M, DUAN Y H, XIAO H H, et al. Lignans isolated from stems of Sambucus williamsii and their proliferation effects on UMR106 cells[J].
China J Chin Mat Med, 2014, 39(14): 2684-2688. 许蒙蒙, 段营辉, 肖辉辉, 等. 接骨木中的木脂素类化学成分及其对UMR106细胞增殖作用的影响[J]. 中国中药杂志, 2014, 39(14): 2684-2688. DOI:10.4268/cjcmm20141418 |
| [17] |
YANG G Z, ZHAO S, LI Y C. Studies on the chemical constituents of Lycianthes biflora[J].
Acta Pharm Sin, 2002, 37(6): 437-439. 杨光忠, 赵松, 李援朝. 红丝线化学成分的研究[J]. 药学学报, 2002, 37(6): 437-439. DOI:10.3321/j.issn:0513-4870.2002.06.010 |
| [18] | PARK C H, KIM K H, LEE I K, et al. Phenolic constituents of Acorus gramineus[J]. Arch Pharm Res, 2011, 34(8): 1289-1296. DOI:10.1007/s12272-011-0808-6 |
| [19] |
ZHANG Y X, ZHU D M, ZHOU L, et al. Comparison of the in vitro antibacterial activity of 15 cephalosporins[J].
Chin J Anti-biol, 1983(1): 16-23. 张永信, 朱德妹, 周乐, 等. 15种头孢菌素体外抗菌活性的比较[J]. 抗生素, 1983(1): 16-23. DOI:10.13461/j.cnki.cja.000550 |
| [20] | CHU S C, HSIEH Y S, LIN J Y. Inhibitory effects of flavonoids on moloney murine leukemia virus reverse transcriptase activity[J]. J Nat Prod, 1992, 55(2): 179-183. DOI:10.1021/np50080a005 |
| [21] | KHAN N, MUKHTAR H. Multitargeted therapy of cancer by green tea polyphenols[J]. Cancer Lett, 2008, 269(2): 269-280. DOI:10.1016/j.canlet.2008.04.014 |
| [22] | CHEN J, LIU L T, HOU R L, et al. Calycosin promotes proliferation of estrogen receptor-positive cells via estrogen receptors and ERK1/2 activation in vitro and in vivo[J]. Cancer Lett, 2011, 308(2): 144-151. DOI:10.1016/j.canlet.2011.04.022 |
| [23] | PARKINSON L, CICERALE S. The health benefiting mechanisms of virgin olive oil phenolic compounds[J/OL]. Molecules, 2016, 21(12):1734. doi:10.3390/molecules21121734. |
 2018, Vol. 26
2018, Vol. 26


