2. 中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室, 昆明 650201;
3. 安徽中医药大学药学院, 合肥 230031
2. State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China;
3. Department of Pharmacology, Anhui University of Traditional Chinese Medicine, Hefei 230031, China
桂花(Osmanthus fragrans)为木犀科(Oleaceae)木犀属植物,产于中国西南部等地。桂花味辛,以花、果实及根入药,有研究表明[1],桂花能够疏肝理气、祛痰止咳等。本文作者前期在对其花、果实、根化学成分的研究基础上[2-4],进一步对桂花叶的成分进行探讨,旨在发现具有生理活性的化学成分,为完善木犀科植物的药用价值奠定基础。
从桂花叶醇提溶液中共分离出了13个化合物(图 1),分别鉴定为香橙素(1)、染料木黄酮(2)、lupinalbin A (3)、齐墩果酸甲酯(4)、3-羰基齐墩果酸(5)、fouquierol (6)、19α-羟基-3-O-乙酰熊果酸(7)、白桦脂醇(8)、豆甾-3, 5-二烯-7-酮(9)、刺五加酮(10)、对羟基苯乙酮(11)、3, 16α-二羟基-对映贝壳杉烷(12)和trigoflavidone A (13)。所有化合物均为首次从桂花叶中分离得到。本文报道这些化合物的分离鉴定和对肿瘤细胞的抑制作用。
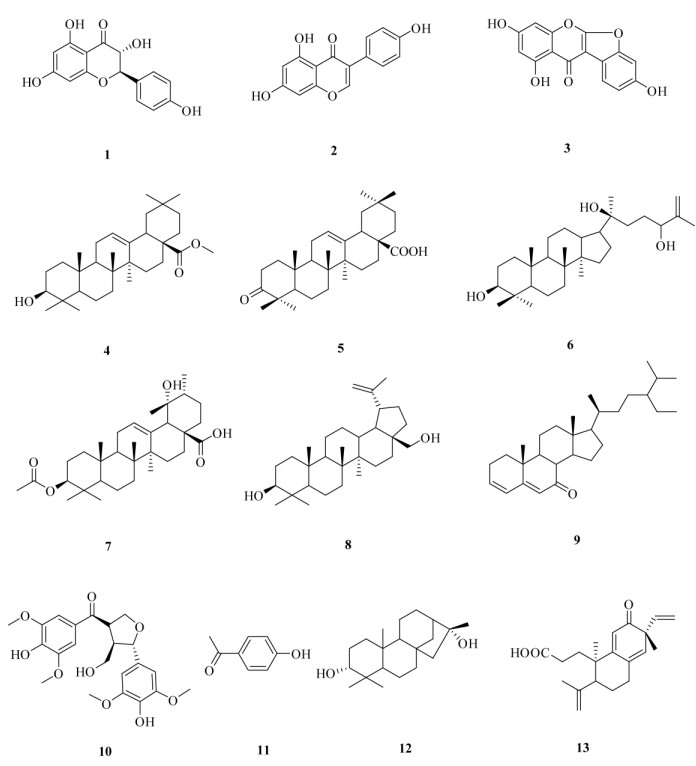
|
图 1 化合物1~13的结构 Fig. 1 Structures of compounds 1-13 |
桂花(Osmanthus fragrans)叶采自安徽合肥,由安徽中医药大学张国升教授鉴定。Hela (宫颈癌细胞), HepG2 (人肝癌细胞), 4T1 (小鼠乳腺癌细胞)和A549 (人肺癌细胞)(中国科学技术大学生命科学院,中国科学院软物质化学重点实验室提供)。H22小鼠(携带肝癌细胞的BALB/c小鼠)、BALB/c小鼠,清洁级,6~7周(中国科学技术大学生命科学院,实验动物中心提供); RPMI-1640培养液(碧云天生物技术有限公司);四甲基偶氮唑盐(MTT,碧云天生物技术有限公司); 环磷酰胺(江苏恒瑞医药股份有限公司);二甲基亚砜(DMSO, Sigma公司)。硅胶和薄层色谱硅胶均为青岛海洋化工厂生产。
1.2 仪器质谱由英国Micromass公司产VG Auto-Spec-3000质谱仪测定;1H、13C NMR用Bruker DRX-500 MHz超导核磁共振仪测定;制备型MPLC仪器为Büchi公司生产(Büchifraction collector C-660, Büchi pump module C-605 and manager C-615);HPLC为Agilent 1100,Zorbax SB-C-18 column (4.6 mm× 150 mm, 5 μm);Sephadex LH-20为瑞士Amershan Biosciences公司生产;酶标板分析仪(BXS01-ELx-800,美国宝特酶标仪);熔点由科翔仪器仪表有限公司生产的HR-3C型显微熔点仪测定。
1.3 提取和分离桂花叶干燥粉末约4.0 kg,用95%乙醇浸提, 减压浓缩至无醇味,加水悬浮,分别用石油醚、氯仿、乙酸乙酯和正丁醇依次萃取,浓缩得石油醚部分55.0 g、氯仿部分63.0 g、乙酸乙酯部分112.0 g和正丁醇部分158.0 g。
氯仿萃取部分经硅胶柱色谱[石油醚-丙酮9:1~5:5,石油醚-乙酸乙酯8:2~5:5,(V/V, 下同)]溶剂,进行梯度洗脱,分别得到化合物4 (19.0 mg)、8 (23.8 mg)、12 (16.9 mg)和13 (19.3 mg)。乙酸乙酯萃取部分经硅胶柱色谱(氯仿-甲醇10: 0~50:50),得6个部分(Fr.1~Fr. 6),Fr.2浓缩得浅黄色浸膏,通过反复硅胶柱分离(氯仿-甲醇9:1~ 5:5, 石油醚-丙酮9:1~5:5),经中压制备(MPLC) (30%~100%乙腈,流速为1 mL min–1),同时用Sephadex LH-20凝胶柱(氯仿-甲醇1:1)纯化,得化合物5 (14.9 mg)、11 (22.7 mg)和2 (30.3 mg);Fr.3经减压浓缩得棕色浸膏,反复经硅胶色谱(氯仿-甲醇9:1~6:4),最后用Sephadex LH-20凝胶柱(甲醇)纯化,得化合物6 (25.4 mg)和3 (27.5 mg);Fr.4经减压浓缩得深褐色浸膏,依次经中压制备(MPLC) (30%~100%乙腈,流速为1 mL min–1),反复硅胶色谱(石油醚-乙酸乙酯8:2~4:6,氯仿-甲醇9:1~ 5:5,氯仿-丙酮9:1~4:6),用Sephadex LH-20凝胶柱(氯仿-甲醇1:1)纯化,得化合物1 (20.5 mg)、7 (17.7 mg)、10 (28.6 mg)和9 (21.5 mg)。
1.4 结构鉴定化合物1 针状结晶(甲醇);1H NMR (500 MHz, CD3OD): δ 5.00 (1H, d, J = 12.3 Hz, H-2), 4.57 (1H, d, J = 11.5 Hz, H-3), 5.90 (1H, d, J = 1.8 Hz, H-6), 5.91 (1H, d, J = 2.1 Hz, H-8), 7.36 (2H, d, J = 8.6,H-2′, 6′), 6.85 (2H, d, J = 8.6 Hz, H-3′, 5′);13C NMR (125 MHz, CD3OD): δ 85.1 (C-2), 73.7 (C-3), 198.7 (C-4), 165.4 (C-5), 97.5 (C-6), 168.8 (C-7), 96.6 (C-8), 164.6 (C-9), 102.0 (C-10), 129.2 (C-1′), 130.6 (C-2′, 6′), 116.4 (C-3′, 5′), 159.3 (C-4′)。以上数据与文献[5]报道的数据一致, 确定该化合物为香橙素。
化合物2 黄色针晶(丙酮);EI-MS m/z:270 [M]+, 241, 213, 197。1H NMR (500 MHz, CD3COCD3): δ 13.00 (OH-4′), 6.31 (1H, d, J = 2.2 Hz, H-6), 6.44 (1H, d, J = 1.9 Hz, H-8), 7.44 (2H, dd, J = 2.2, 6.2 Hz, H-2′, 6′), 6.91 (2H, dd, J = 2.5, 6.7 Hz, H-3′, 5′); 13C NMR (125 MHz, CD3COCD3): δ 154.2 (C-2), 124.2 (C-3), 181.4 (C-4), 163.7 (C-5), 99.9 (C-6), 164.8 (C-7), 94.6 (C-8), 159.1 (C-9), 106.4 (C-10), 123.3 (C-1′), 131.3 (C-2′), 116.1 (C-3′), 158.3 (C-4′), 116.1 (C-5′), 131.4 (C-6′)。以上数据与文献[6]报道的数据一致,确定该化合物为染料木黄酮。
化合物3 白色粉末(甲醇);EI-MS m/z: 284 [M]+, 255, 228, 214。1H NMR (500 MHz, DMSO-d6): δ 6.32 (1H, d, J = 2.3 Hz, H-6), 6.56 (1H, d, J = 2.2 Hz, H-8), 7.05 (1H, d, J = 2.1 Hz, H-3′),6.95 (1H, dd, J = 8.3, 1.9 Hz, H-5′), 7.74 (1H, d, J = 8.1 Hz, H-6′)。13C NMR (125 MHz, DMSO-d6): δ 165.2 (C-2), 100.2 (C-3), 179.1 (C-4), 163.6 (C-5), 100.6 (C-6), 164.6 (C-7), 96.4 (C-8), 155.6 (C-9), 104.2 (C-10), 114.2 (C-1′), 151.2 (C-2′), 98.4 (C-3′), 157.3 (C-4′), 115.2 (C-5′), 122.5 (C-6′)。以上数据与文献[7]报道的数据一致,确定该化合物为lupinalbin A。
化合物4 白色粉末(氯仿);mp 257℃~ 259℃。ESI-MS m/z:493 [M + Na]+。1H NMR (CDCl3, 500 MHz): δ 4.22 (1H, m, H-3), 5.16 (1H, br s, H-12), 0.82, 0.90, 0.91, 0.92, 1.01, 1.02, 1.17 (each 3H, s, H-23~27, 29, 30), 3.64 (3H, s, 28-OCH3); 13C NMR (CDCl3, 125 MHz): δ 39.0 (C-1), 28.1 (C-2), 78.8 (C-3), 38.6 (C-4), 55.6 (C-5), 18.9 (C-6), 33.1 (C-7), 39.3 (C-8), 47.2 (C-9), 37.2 (C-10), 23.5 (C-11), 122.3 (C-12), 144.6 (C-13), 41.9 (C-14), 28.7 (C-15), 23.8 (C-16), 46.8 (C-17), 42.1 (C-18), 46.2 (C-19), 30.8 (C-20), 33.6 (C-21), 31.7 (C-22), 28.4 (C-23), 16.3 (C-24), 15.1 (C-25), 17.3 (C-26), 25.9 (C-27), 178.1 (C-28), 33.1 (C-29), 23.6 (C-30), 54.9 (COOCH3)。以上数据与文献[8]报道的数据一致,确定该化合物为齐墩果酸甲酯。
化合物5 白色粉末(氯仿),mp 288℃~ 291℃; ESI-MS m/z: 477 [M + Na]+。1H NMR (CDCl3, 500 MHz): δ 5.20 (1H, br s, H-12), 2.81 (1H, dd, J = 13.3, 4.1 Hz, H-18), 0.71, 0.79, 0.90, 0.93, 1.03, 1.05, 1.41 (each 3H, s, H-23~27, 29, 30); 13C NMR (CDCl3, 125 MHz): δ 39.0 (C-1), 34.0 (C-2), 217.7 (C-3), 47.4 (C-4), 55.5 (C-5), 19.3 (C-6), 32.1 (C-7), 39.1 (C-8), 46.5 (C-9), 37.0 (C-10), 23.0 (C-11), 122.5 (C-12), 143.6 (C-13), 41.8 (C-14), 27.8 (C-15), 23.6 (C-16), 46.3 (C-17), 41.1 (C-18), 46.2 (C-19), 31.0 (C-20), 33.8 (C-21), 32.4 (C-22), 26.5 (C-23), 21.2 (C-24), 15.1 (C-25), 17.2 (C-26), 26.1 (C-27), 183.6 (C-28), 32.3 (C-29), 23.9 (C-30)。以上数据与文献[9]报道的数据一致,确定该化合物为3-羰基齐墩果酸。
化合物6 白色粉末(氯仿);mp 193℃~ 194℃;ESI-MS m/z:483 [M + Na]+。1H NMR (CDCl3, 500 MHz): δ 3.21 (1H, m, H-3), 1.76 (1H, m, H-17), 1.00 (3H, s, H-18), 0.92 (3H, s, H-19), 1.11 (3H, s, H-21), 4.06 (1H, m, H-24), 4.97 (1H, br s, H-26a), 4.83 (1H, m, H-26b), 1.71 (3H, s, H-27), 0.99 (3H, s, H-28), 0.81 (3H, s, H-29), 0.90 (3H, s, H-30); 13C NMR (CDCl3, 125 MHz): δ 39.0 (C-1), 27.3 (C-2), 79.1 (C-3), 38.7 (C-4), 55.5 (C-5), 18.1 (C-6), 35.0 (C-7), 40.0 (C-8), 50.8 (C-9), 37.1 (C-10), 21.3 (C-11), 24.6 (C-12), 42.1 (C-13), 50.4 (C-14), 31.2 (C-15), 27.4 (C-16), 50.2 (C-17), 15.7 (C-18), 16.3 (C-19), 75.0 (C-20), 25.4 (C-21), 36.2 (C-22), 29.9 (C-23), 76.1 (C-24), 147.7 (C-25), 111.0 (C-26), 18.1 (C-27), 28.3 (C-28), 15.4 (C-29), 16.5 (C-30)。以上数据与文献[10]报道的数据一致,确定该化合物为fouquierol。
化合物7 白色粉末(氯仿),mp 218℃~ 221℃。ESI-MS m/z: 537 [M + Na]+。1H NMR (CDCl3, 500 MHz): δ 4.52 (1H, m, H-3), 5.30 (1H, br s, H-12), 2.57 (1H, s, H-18), 0.67, 0.86, 0.99, 1.17, 1.24, 1.25 (each 3H, s, H-23~27, 29), 0.81 (1H, d, J = 7.3 Hz, H-30), 2.05 (3H, s, CH3CO-); 13C NMR (CDCl3, 125 MHz): δ 38.5 (C-1), 23.5 (C-2), 80.6 (C-3), 37.9 (C-4), 55.1 (C-5), 18.2 (C-6), 32.6 (C-7), 40.2 (C-8), 47.1 (C-9), 37.3 (C-10), 23.8 (C-11), 128.9 (C-12), 138.1 (C-13), 41.0 (C-14), 28.3 (C-15), 25.6 (C-16), 47.9 (C-17), 53.0 (C-18), 73.2 (C-19), 41.4 (C-20), 25.5 (C-21), 37.2 (C-22), 28.2 (C-23), 16.6 (C-24), 15.0 (C-25), 17.2 (C-26), 24.3 (C-27), 183.2 (C-28), 27.1 (C-29), 16.0 (C-30), 21.1 (CH3CO), 171.2 (CH3CO)。以上数据与文献[11]报道的数据一致,确定该化合物为19α-羟基-3-O-乙酰熊果酸。
化合物8 白色粉末(氯仿);mp 251℃~ 253℃。ESI-MS m/z: 465 [M + Na]+。1H NMR (CDCl3, 500 MHz): δ 3.16 (1H, d, J = 11.3 Hz, H-3), 2.32 (1H, m, H-19), 0.75, 0.80, 0.99, 1.01, 1.07 (each 3H, s, H-23~27), 3.77 (1H, d, J = 10.1 Hz, H-28a),3.25 (1H, d, J = 10.1 Hz, H-28b), 4.71 (1H, br s, H-29a), 4.58 (1H, br s, H-29b), 1.63 (3H, s, H-30); 13C NMR (CDCl3, 125 MHz): δ 39.2 (C-1), 27.5 (C-2), 78.7 (C-3), 39.1 (C-4), 55.5 (C-5), 18.2 (C-6), 34.3 (C-7), 40.6 (C-8), 50.5 (C-9), 37.2 (C-10), 20.6 (C-11), 25.1 (C-12), 37.3 (C-13), 42.4 (C-14), 27.5 (C-15), 28.6 (C-16), 47.4 (C-17), 47.5 (C-18), 48.4 (C-19), 150.4 (C-20), 29.6 (C-21), 34.2 (C-22), 28.3 (C-23), 15.6 (C-24), 15.6 (C-25), 16.4 (C-26), 14.7 (C-27), 60.8 (C-28), 109.6 (C-29), 19.3 (C-30)。以上数据与文献[12]报道的数据一致,确定该化合物为白桦脂醇。
化合物9 白色粉末(氯仿);1H NMR (500 MHz, CDCl3): δ 6.28 (1H, m, H-3), 6.17 (1H, d, J = 9.5 Hz, H-4), 5.65 (1H, s, H-6), 0.70 (3H, s, H-18), 1.18 (3H, s, H-19), 0.94 (3H, d, J = 6.1 Hz, H-21), 0.83 (3H, d, J = 7.1 Hz, H-26), 0.81 (3H, d, J = 7.2 Hz, H-27), 0.81 (3H, t, J = 8.1 Hz, H-29); 13C NMR (125 MHz, CDCl3): δ 33.1 (C-1), 23.8 (C-2), 136.4 (C-3), 124.8 (C-4), 161.3 (C-5), 127.6 (C-6), 202.1 (C-7), 46.5 (C-8), 49.7 (C-9), 36.7 (C-10), 21.7 (C-11), 39.4 (C-12), 43.6 (C-13), 51.1 (C-14), 26.8 (C-15), 29.0 (C-16), 55.0 (C-17), 12.4 (C-18), 16.5 (C-19), 36.7 (C-20), 19.3 (C-21), 33.8 (C-22), 26.5 (C-23), 46.2 (C-24), 29.5 (C-25), 19.0 (C-26), 20.2 (C-27), 23.3 (C-28), 12.3 (C-29)。以上数据与文献[13]报道的数据一致, 确定该化合物为豆甾-3, 5-二烯-7-酮。
化合物10 黄色粉末(甲醇); ESI-MS m/z: 457 [M + Na]+, 1H NMR (CD3OD, 500 MHz): δ 7.40 (1H, s, H-2), 7.37 (1H, s, H-6), 4.25 (1H, m, H-8), 4.19 (1H, m, H-9), 6.73 (1H, s, H-6′), 4.66 (1H, d, J = 8.1 Hz, H-7′), 2.64 (1H, m, H-8′), 3.63 (1H, m, H-9′), 3.91 (6H, s, 3, 5-OCH3), 3.81 (6H, s, 3′, 5′-OCH3); 13C NMR (CD3OD, 125 MHz): δ 128.3 (C-1), 108.1 (C-2), 149.3 (C-3), 142.7 (C-4), 149.0 (C-5), 105.4 (C-6), 200.1 (C-7), 50.3 (C-8), 71.7 (C-9), 133.1 (C-1′), 105.4 (C-2′), 149.5 (C-3′), 136.5 (C-4′), 149.6 (C-5′), 105.4 (C-6′), 85.5 (C-7′), 55.0 (C-8′), 61.2 (C-9′), 57.1 (3, 5-OCH3), 56.7 (3′, 5′-OCH3)。以上数据与文献[14]报道的数据一致,确定该化合物为刺五加酮。
化合物11 白色针晶(甲醇); ESI-MS m/z: 137 [M + Na]+。1H NMR (DMSO-d6, 500 MHz): δ 10.53 (1H, s, OH-2), 7.80 (2H, d, J = 8.4 Hz, H-2, 6), 6.82 (2H, d, J = 8.1 Hz, H-3, 5), 2.52 (3H, s, COCH3); 13C NMR (DMSO-d6, 125 MHz): δ 128.2 (C-1), 130.6 (C-2, 6), 115.1 (C-3, 5), 162.0 (C-4), 196.0 (C-7), 26.4 (C-8)。以上数据与文献[15]报道的数据一致,确定该化合物为对羟基苯乙酮。
化合物12 白色细针晶(丙酮); 1H NMR (500 MHz, CD3COCD3): δ 3.23 (1H, d, J = 5.3 Hz, 3-OH), 3.01 (1H, s, 16-OH), 0.75 (2H, m, H-2), 3.06 (1H, dt, J = 5.3, 11.2 Hz, H-3), 0.81 (1H, m, H-9), 1.62 (2H, m, H-15), 1.10 (3H, s, H-17), 0.68 (3H, s, H-18), 0.84 (3H, s, H-19), 0.82 (3H, s, H-20); 13C NMR (125 MHz, CD3COCD3): δ 37.3 (t, C-1), 27.1 (C-2), 78.0 (C-3), 38.8 (C-4), 55.3 (C-5), 18.0 (C-6), 39.6 (C-7), 37.0 (C-8), 51.3 (C-9), 33.5 (C-10), 23.3 (C-11), 38.1 (C-12), 23.9 (C-13), 27.2 (C-14), 57.7 (C-15), 70.1 (C-16), 30.1 (C-17), 27.9 (C-18), 15.5 (C-19), 13.8 (C-20)。以上数据与文献[16]报道的数据一致,确定该化合物为3, 16α-二羟基-对映贝壳杉烷。
化合物13 白色晶体(甲醇);1H NMR (500 MHz, CD3COCD3): δ 5.68 (1H, s, H-11), 6.03 (1H, s, H-14), 5.91 (1H, m, H-15), 5.13 (1H, d, J = 2.1 Hz, H-16α), 4.90 (1H, d, J = 1.9 Hz, H-16β), 1.52 (3H, s, H-17), 5.22 (1H, m, H-18α), 5.22 (1H, m, H-18β), 1.31 (3H, s, H-19), 1.79 (3H, s, H-20); 13C NMR (125 MHz,CD3COCD3): δ 34.3 (C-1), 37.1 (C-2), 178.2 (C-3), 146.5 (C-4), 56.7 (C-5), 28.1 (C-6), 36.5 (C-7), 140.0 (C-8), 155.6 (C-9), 44.2 (C-10), 122.8 (C-11), 190.2 (C-12), 51.1 (C-13), 121.0 (C-14), 138.3 (C-15), 112.1 (C-16), 23.3 (C-17), 105.3 (C-18), 17.4 (C-19), 23.1 (C-20)。以上数据与文献[17]报道的数据一致,确定该化合物为trigoflavidone A。
1.5 化合物体外抗肿瘤活性试验[18]称取适量化合物1~13,二甲亚砜溶解(浓度小于培养液中最大体积分数的3‰),超声20 min,冰箱冷藏备用。采取MTT方法进行体外抗肿瘤活性试验。将对数生长期的Hela、HepG2、4T1和A549细胞,稀释成1×104 cells mL–1细胞悬液,接种至96孔板,每孔100 μL,置37℃,5%的CO2培养箱中培养24 h后,吸取孔中培养液,加入不同浓度的化合物,继续培养48 h,每组3个复孔。在检测前每孔加入5 mg mL–1 MTT 30 μL,孵育3 h。在酶联免疫检测仪上测定吸光度(A,490 nm波长)。其中,抑制率(%)=(1-OD试验组/OD对照组)×100%,计算各化合物对各肿瘤细胞的增殖抑制情况,得出50%肿瘤细胞增殖抑制率对应的各化合物浓度(IC50值)。采用SPSS 18.0软件进行数据的统计分析,数据以平均数±标准差(M±SD)表示,采用t检验,检验水准α=0.05, 以P < 0.05表示差异有统计学意义。化合物1~13对肿瘤细胞的抑制率和化合物2、3、10的IC50值见表 1。
| 表 1 化合物1~13对肿瘤细胞的抑制率和化合物2、3、10的IC50值 Table 1 Inhibition rate of compounds 1-13 to tumour cells and IC50 of compounds 2, 3 and 10 |
无菌条件下抽取接种5 d的H22小鼠腹水,PBS稀释至1×107 mL–1,种至BALB/c小鼠腹部皮下(每只100 μL),接种48 h后,随机分5组,即对照组(PBS,200 mL kg–1)、环磷酰胺(20 mg kg–1)、化合物2 (5 mg kg–1)组、化合物3 (5 mg kg–1)组、化合物10 (5 mg kg–1)组。灌胃给药,每次1日,连续给药10 d,在最后给药1 d后,处死小鼠,称取各组肿瘤质量。抑瘤率(%)=[1-(给药组平均肿瘤重量/对照组平均肿瘤重量)]×100%。试验数据采用SPSS 19.0软件进行分析。从表 2可见,化合物2、3、10和环磷酰胺处理的肿瘤质量的差异显著,化合物2、3、10的体内肿瘤抑制率分别为54.34%、39.05%和29.41%,均小于环磷酰胺的(67.23%)。
| 表 2 化合物2、3、10体内抗肿瘤活性 Table 2 Antineoplastic activities in vivo of compounds 2, 3 and 10 |
本研究利用硅胶柱、RP-18、Sephadex LH-20等多种材料对桂花叶醇提溶液进行分离纯化,分离得到13个化合物,分别为香橙素(1)、染料木黄酮(2)、lupinalbin A (3)、齐墩果酸甲酯(4)、3-羰基齐墩果酸(5)、fouquierol (6)、19α-羟基-3-O-乙酰熊果酸(7)、白桦脂醇(8)、豆甾-3, 5-二烯-7-酮(9)、刺五加酮(10)、对羟基苯乙酮(11)、3, 16α-二羟基-对映贝壳杉烷(12)和trigoflavidone A (13)。所有化合物均为首次从桂花叶中分离得到。此外,抗肿瘤活性研究表明,化合物2、3、10均有一定的抗肿瘤活性。
| [1] |
LIU L C, XIANG Q B. Research progress on Osmanthus genus[J].
J Nanjing For Univ (Nat Sci), 2003, 27(2): 84-88. 刘龙昌, 向其柏. 木犀属植物的研究进展[J]. 南京林业大学学报(自然科学版), 2003, 27(2): 84-88. DOI:10.3969/j.issn.1000-2006.2003.02.020 |
| [2] |
YIN W, LIU J Q, ZHANG G S. Chemical constituents of Osmanthus fragrans fruits[J].
China J Chin Mat Med, 2013, 38(24): 4329-4334. 尹伟, 刘金旗, 张国升. 桂花果实的化学成分研究[J]. 中国中药杂志, 2013, 38(24): 4329-4334. DOI:10.4268/cjcmm20132427 |
| [3] |
YIN W, SONG Z R, LIU J Q, et al. Chemical constituents of Osmanthus fragrans[J].
China J Chin Mat Med, 2015, 40(4): 679-685. 尹伟, 宋祖荣, 刘金旗, 等. 桂花的化学成分研究[J]. 中国中药杂志, 2015, 40(4): 679-685. DOI:10.4268/cjcmm20150420 |
| [4] |
YIN W, LIU J Q. The flavonoids of chemical constituents of Osmanthus fragrans roots[J].
J Chin Med Mat, 2016, 39(7): 1551-1554. 尹伟, 刘金旗. 桂花树根中黄酮类化学成分研究[J]. 中药材, 2016, 39(7): 1551-1554. DOI:10.13863/j.issn1001-4454.2016.07.024 |
| [5] | SHEN Z B, THEANDER O. Flavonoid glycosides from needles of Pinus massoniana[J]. Phytochemistry, 1985, 24(1): 155-158. DOI:10.1016/S0031-9422(00)80826-2 |
| [6] |
WANG J, FAN X, CEN Y Z. Studies on the antitumor constituents in Flemingia philippinensis Merr. et Rolfe[J].
Nat Prod Res Dev, 2013, 25(10): 1315-1319, 1361. 王娇, 范贤, 岑颖洲. 千斤拔的抗肿瘤活性成分研究[J]. 天然产物研究与开发, 2013, 25(10): 1315-1319, 1361. DOI:10.16333/j.1001-6880.2013.10.013 |
| [7] |
LI H, YANG M H, MA X J. Flavoniods from roots of Flemingia philippinensis[J].
China J Chin Mat Med, 2009, 34(6): 724-726. 李华, 杨美华, 马小军. 千斤拔黄酮类化学成分研究[J]. 中国中药杂志, 2009, 34(6): 724-726. DOI:10.3321/j.issn:1001-5302.2009.06.021 |
| [8] |
FU Y, BAI Y, DAWA Z M, et al. Chemical constituents of Incarvillea younghusbandii[J].
China J Chin Mat Med, 2010, 35(1): 58-62. 傅予, 白央, 达娃卓玛, 等. 藏波罗花的化学成分研究[J]. 中国中药杂志, 2010, 35(1): 58-62. DOI:10.4268/cjcmm20100112 |
| [9] |
DU J J, WU B F, YANG J, et al. Triterpenes constitutes in Serissa serissoides[J].
Lishizhen Med Mat Med Res, 2008, 19(2): 341-342. 都姣娇, 武冰峰, 杨娟, 等. 白马骨中三萜类成分研究[J]. 时珍国医国药, 2008, 19(2): 341-342. DOI:10.3969/j.issn.1008-0805.2008.02.042 |
| [10] | PAKHATHIRATHIEN C, KARALAI C, PONGLIMANONT C, et al. Dammarane triterpenes from the hypocotyls and fruits of Ceriops tagal[J]. J Nat Prod, 2005, 68(12): 1787-1789. DOI:10.1021/np0502793 |
| [11] |
WANG S X, YIN S, WU L J, et al. A study on the chemical constituents of Ligustrum lucidum Ait. (Ⅱ)[J].
J Shenyang Pharm Univ, 1995, 12(1): 25-28. 王素贤, 尹双, 吴立军, 等. 女贞子化学成分的研究(Ⅱ)[J]. 沈阳药科大学学报, 1995, 12(1): 25-28. DOI:10.14066/j.cnki.cn21-1349/r.1995.01.008 |
| [12] |
SUN J M, YANG J S. Studies on chemical constituents of Jasminum lanceolarium[J].
Chin Pharm J, 2007, 42(7): 489-491. 孙佳明, 杨峻山. 破骨风化学成分的研究[J]. 中国药学杂志, 2007, 42(7): 489-491. DOI:10.3321/j.issn:1001-2494.2007.07.003 |
| [13] | BALD A M, APERS S, de BRUVNE T E, et al. Steroids from Harrisonia abyssinica[J]. Planta Med, 2000, 66(1): 67-69. DOI:10.1055/s-2000-11120 |
| [14] |
WU L J, ZHENG J, JIANG B H, et al. Chemical constituents of the stems and leaves of Acanthopanax senticosus (Rupr. et Maxim.) harms[J].
Acta Pharm Sin, 1999, 34(4): 294-296. 吴立军, 郑健, 姜宝虹, 等. 刺五加茎叶化学成分[J]. 药学学报, 1999, 34(4): 294-296. DOI:10.3321/j.issn:0513-4870.1999.04.013 |
| [15] |
LI Y P, ZHOU Y Z, CHEN G, et al. Isolation and identification of phenols from Cynanchum paniculatum[J].
J Shenyang Pharm Univ, 2014, 31(6): 444-447. 李翼鹏, 周玉枝, 陈刚, 等. 徐长卿中酚类成分的分离与鉴定[J]. 沈阳药科大学学报, 2014, 31(6): 444-447. DOI:10.14066/j.cnki.cn21-1349/r.2014.06.005 |
| [16] |
HOU A J, JIANG B, YANG H, et al. Three new ent-kaurane diterpenoides from Isodon xerophilus[J].
Acta Bot Yunnan, 2000, 22(2): 197-200. 侯爱君, 姜北, 杨辉, 等. 旱生香茶菜中三个新的对映-贝壳杉烷型二萜[J]. 云南植物研究, 2000, 22(2): 197-200. DOI:10.3969/j.issn.2095-0845.2000.02.014 |
| [17] |
QIN Q C. Study on chemical compositions of an endemic medicinal plant in Guangxi:Trigonostemon lutescens[D]. Nanning:Guangxi University, 2014.
覃其昶. 广西特有药用植物黄花三宝木的化学成分研究[D]. 南宁: 广西大学, 2014. |
| [18] |
WU G H, WEI A H, CAI Y L, et al. Chemical constituents of Macro-thelypteris oligophlebia and their antitumor activity in vitro and in vivo[J].
Chin Pharm J, 2011, 46(5): 330-333. 吴光华, 魏安华, 蔡亚玲, 等. 针毛蕨的化学成分及其体内外抗肿瘤活性研究[J]. 中国药学杂志, 2011, 46(5): 330-333. |
| [19] | YANG J, WU L J, TASHINO S I, et al. Reactive oxygen species and nitric oxide regulate mitochondria-dependent apoptosis and autophagy in evodiamine-treated human cervix carcinoma HeLa cells[J]. Free Radic Res, 2008, 42(5): 492-504. DOI:10.1080/10715760802112791 |
 2018, Vol. 26
2018, Vol. 26


