1b. 中南林业科技大学, 林学院, 长沙 410018;
2. 广东常瑞林业有限公司, 广州 510900
1b. Forestry College, Central South University of Forestry and Technology, Changsha 410018, China;
2. Guangdong Changrui Forestry Co. Ltd., Guangzhou 510900, China
鸡血藤,别名大血藤、三叶鸡血藤, 是豆科(Leguminosae)密花豆属(Spatholobus)植物密花豆(S. suberectus Dunn.)的干燥藤茎[1], 自然分布在广东、云南、四川、广西等山地林间。由于鸡血藤越来越高的药用价值与经济价值使其用量大增,野生资源不能满足市场的需求,因此,大面积栽培鸡血藤逐步代替野生鸡血藤药材入药,但现阶段市场上流通的鸡血藤药材质量良莠不齐,市场价格波动,药材种植尚缺乏一套成熟的科学栽培体系,因而严重的制约了鸡血藤的生产与发展。
目前,对鸡血藤的研究主要集中于化学成分的分离鉴定[2-5]、繁殖与栽培[6-7]、药用价值[8-12]等方面,在施肥对鸡血藤黄酮类化合物代谢影响方面的研究还很少报道,在特定的土壤、气候等条件下, 施肥是影响鸡血藤品质的重要因素[13-14]。本文探讨了Zn、B配施条件下对鸡血藤黄酮类化合物积累的差异,旨在为鸡血藤规范化栽培中科学施Zn、B肥提供理论依据,从而扩大鸡血藤的种植规模,提高鸡血藤的经济效益。
1 材料和方法 1.1 试验地概况试验地设在广东省从化市鳌头镇(东经113°56′, 北纬23°34′),年均气温为21.2℃,年降水量2 176.3 mm, 年日照时数1 175.0 h,境内地势平坦,土层深厚、肥沃,土质较疏松,环境优美, 空气清新。鳌头镇横岭村种植基地是砂岩和变质岩为主的红壤丘陵地, 土壤偏酸性,pH 4~6。试验前经中南林业科技大学南方林业生态应用技术国家工程实验室测定, 土壤中含Zn 75.89 mg kg–1, Cu 3.49 mg kg–1, Pb 16.84 mg kg–1, Cd 0.05 mg kg–1和Cr 0.03 mg kg–1, 土壤环境质量符合中华人民共和国土壤环境质量标准(GB15618-1995)。
1.2 材料供试鸡血藤经中南林业科技大学生命科学与技术学院何钢教授鉴定为豆科密花豆属植物密花豆(Spatholobus suberectus Dunn.)。
试验于2017年3-5月在广州从化市鳌头镇鸡血藤试验试范区进行,采用叶面喷施,对所有试验树基施N、P、K的基础下施用微量元素Zn和B, 每株施基肥40 g尿素(含N 46%)、60 g过磷酸钙(含P2O5 14%)、30 g硫酸钾(含K2O 52%),三者均为中等水平,做基肥一次性施入。选用树势、栽培年限、栽培密度和管理基本一致的鸡血藤,在萌芽展叶期喷施ZnSO4和Na2B4O7·10H2O,分3次进行, 中间间隔10 d,叶面施肥,施肥方案如表 1。试验采用田间小区试验设计,3次重复,共30个小区。每个试验小区5株鸡血藤,小区面积约20 m2。
| 表 1 鸡血藤施Zn、B方案 Table 1 Fertilization design of Spatholobus suberectus |
施肥1个月后,对各处理鸡血藤的可溶性蛋白含量、PAL活性和总黄酮含量进行检测。
可溶性蛋白质的测定 采用考马斯亮兰G-250染色法[15]测定,以牛血清白蛋白做标准曲线。称取新鲜鸡血藤幼嫩叶片0.5 g,剪碎,置于预冷的研钵中,加入5 mL预冷的0.1 mol L–1 (pH 7.0)磷酸缓冲液,在冰浴下研磨成匀浆,室温下放置1 h充分提取,倒入离心管中,于1 073×g冰浴离心20 min, 取样品上清液0.1 mL,加入0.9 mL蒸馏水和5 mL 100 mg L–1考马斯亮兰G-250试剂,充分混合,放置2 min后于波长595 nm下进行比色测定,测量溶液在波长595 nm下的吸光度,并通过标准曲线(y= 0.0057x+0.00038,R2=0.999 1)计算蛋白质含量。
苯丙氨酸解氨酶(PAL)活性的测定 参照程水源等[16]的方法测定样品中的PAL活性。取出冰冻保存的样品,用滤纸吸干水份,并将样品剪碎混匀, 准确称取0.5 g,放入预冷的研钵中,加入5 mL 0.1 mol L–1 pH 8.8硼酸缓冲液(含巯基乙醇5 mmol L–1), 0.25 g聚乙烯吡咯烷酮(PVP),在冰浴中研成匀浆, 转移至离心管中,于6 708×g下离心20 min,上清液进行酶活性检测。取1 mL上清液加入反应管中,再分别加入2 mL 0.02 mol L–1的L-苯丙氨酸和2 mL蒸馏水,总体积为5 mL,对照不加底物,以1 mL蒸馏水代替。然后置于30℃恒温水浴中保温30 min, 加0.5 mL 6 mol L–1 HCI终止反应,以对照管为空白,在290 nm处测定吸光度值。以每分钟每克样品在290 nm处吸光度变化0.1所需酶量为1个单位。
总黄酮含量的测定 吸取鸡血藤醇溶性提取物于容量瓶中,参照《中华人民共和国药典》2015版铝盐在碱性条件下同黄酮生成红色络合物的比色法测定总黄酮,重复3次。主要包括样品提取(超声波提取)、标准曲线的制备(y=12.704x+0.0154, R2=0.999 0)和样品的测定。
1.4 数据分析试验数据采用Excel和SPSS 21.0软件进行处理和分析。
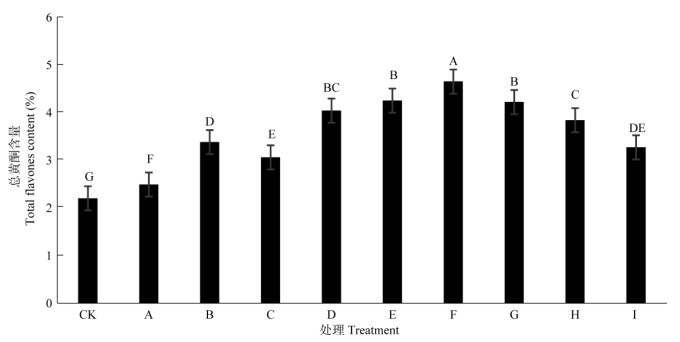
2 结果和分析 2.1 Zn、B配施对鸡血藤总黄酮含量的影响从图 1可见,不同施肥水平显著影响鸡血藤中总黄酮含量。方差分析表明,不同施肥处理间鸡血藤总黄酮含量的差异极显著(F=205.55,P=0.0001)。叶面喷施Zn、B肥处理的总黄酮含量表现为F>E> G>D>H>B>I>C>A,其中F处理,即25 mg L–1 ZnSO4+50 mg L–1 Na2B4O7·10H2O,鸡血藤总黄酮含量为4.65%,比CK提高了52.69%,且与其他施肥处理间达极显著差异(P < 0.01),表明施用25 mg L–1 ZnSO4+50 mg L–1 Na2B4O7·10H2O对总黄酮含量的提高有显著的促进作用。总体上,不同施肥处理均有效地提高了鸡血藤中总黄酮的含量,其中以F处理的效果最为显著。
|
图 1 施肥对鸡血藤总黄酮含量的影响。柱上不同小写和大写字母分别表示差异显著(P < 0.05)和极显著(P < 0.01)(Duncan法)。下图同。 Fig. 1 Effect of fertilizer on total flavone content of Spatholobus suberectus. Different small and capital letters upon column indicate significant differences at 0.05 and 0.01 levels by using Duncan method. The same is following Figures |
不同施肥处理鸡血藤的可溶性蛋白质含量存在差异(图 2)。方差分析表明,不同施肥处理间的可溶性蛋白质含量达极显著差异(F=16.043, P= 0.0001)。其中G处理,即50 mg L–1 ZnSO4+150 mg L–1 Na2B4O7·10H2O,可溶性蛋白质含量最高,达0.86%,比CK提高了47.19%;其次为F处理,即25 mg L–1 ZnSO4+50 mg L–1 Na2B4O7·10H2O,但G和F处理间的差异不显著(P>0.05)。总体来讲,各施肥处理均能促进鸡血藤可溶性蛋白质的合成,提高可溶性蛋白质含量。

|
图 2 施肥处理对鸡血藤可溶性蛋白质含量的影响 Fig. 2 Effect of fertilizer on soluble protein content of Spatholobus suberectus |
Zn、B肥配施的鸡血藤总黄酮含量变化呈双峰曲线,可溶性蛋白质含量表现为先升高后降低的变化趋势,且配施Zn、B肥处理的两者含量均高于CK。但H和I处理的总黄酮和可溶性蛋白质的合成均受到抑制(图 1, 2),可见高浓度的Zn、B肥配施不利于总黄酮和可溶性蛋白质的生物合成。不同施肥处理对可溶性蛋白质与总黄酮生物合成的促进作用是协同的,即促进可溶性蛋白质合成的同时,也能促进总黄酮的生物合成。
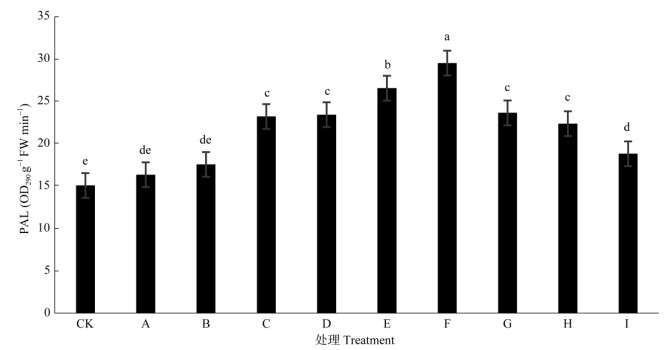
2.4 Zn、B配施对PAL活性的影响从图 3可知,不同施肥处理均有效地提高了鸡血藤的PAL活性。方差分析表明,不同施肥处理间鸡血藤PAL活性达极显著差异(F=28.911, P=0.000 1)。F处理的PAL活性最高,且与其他施肥处理间达极显著差异(P < 0.01),表明施用25 mg L–1 ZnSO4+50 mg L–1 Na2B4O7·10H2O对PAL活性的促进作用显著,浓度再升高时,PAL活性受到抑制,表现出下降趋势。
|
图 3 施肥处理对鸡血藤PAL活性的影响 Fig. 3 Effect of fertilizer on PAL activity of Spatholobus suberectus |
不同施肥处理的鸡血藤中PAL活性呈单峰曲线,而总黄酮含量呈现出升高-降低-升高-降低的变化趋势。B处理时总黄酮含量急剧积累,出现了第1个峰值,C处理时表现出降低的趋势,而当PAL活性在F处理下升高时,总黄酮含量也出现第2个峰值,在G、H和I处理时,总黄酮和PAL活性的合成均受到抑制,表现出持续下降趋势。可见,不同施肥处理,PAL活性的变化和总黄酮含量的变化整体上是同步,即PAL活性较强时,也能促进总黄酮的积累。
2.6 相关分析将鸡血藤中总黄酮和可溶性蛋白质含量、PAL活性进行相关分析(表 2),结果表明,鸡血藤中PAL活性、可溶性蛋白质合成和总黄酮含量之间成显著正相关性,可见,Zn、B配施对鸡血藤黄酮类化合物的影响主要通过两方面调控的,一方面通过调节黄酮类化合物次生代谢关键酶PAL活性而影响黄酮类化合物的合成,另一方面通过调集可溶性蛋白质的合成,影响植物生长,进而影响黄酮类化合物的形成。
| 表 2 鸡血藤中不同成分间相关分析 Table 2 Relationship among different constituents |
本研究结果表明,Zn、B配施能影响鸡血藤总黄酮的积累。适量Zn、B配施处理的鸡血藤总黄酮含量、可溶性蛋白质含量、PAL活性等均明显高于CK, 且与CK存在极显著差异(P < 0.01)。G施肥处理, 即施用50 mg L–1 ZnSO4+10 mg L–1 Na2B4O7·10H2O, 可溶性蛋白质含量最高,达到0.89%,比CK提高了47.19%,其次为F处理,但两者间差异不显著(P > 0.05)。适量的Zn、B配施能提高鸡血藤PAL活性,当施用25 mg L–1 ZnSO4+50 mg L–1 Na2B4O7·10H2O时总黄酮含量最高,达4.65%,比CK提高52.69%。
微量元素是植物体内碳、氮代谢的物质基础, 通过调节植物体内碳、氮代谢,影响植物体内的C/N,从而间接影响药用植物体黄酮类成分的合成与积累。本研究通过叶面喷施Zn、B肥后,为鸡血藤提供了充足的微量营养元素,显著改善了鸡血藤的品质。关于施微量元素对植物中黄酮类物质合成代谢的影响,目前存在一种观点,适当浓度的微量元素能够为植物提供充足的营养,促进有机物的合成,利于果实内糖、维生素的积累,以及促进次生代谢物黄酮类化合物的形成。微量元素对于酶活性的影响是双向的,大多数情况下,低浓度微量元素可以使酶的活性逐渐上升,高浓度微量元素则使酶活性降低[17],本研究结果也证实了这一点。
总黄酮是指黄酮类化合物,是一大类天然产物,广泛存在于植物界,是许多中草药的有效成分。鸡血藤中具有多种医疗保健物质,其中重要的一种是黄酮类化合物,主要包括黄酮类、异黄酮类、黄烷醇类、二氢黄酮醇类、查尔酮类化合物等[2-5]。鸡血藤中的黄酮类化合物具有良好的抗肿瘤生长作用,且表现出低毒特点,这可能与大豆苷元、芒柄花素、染料木素等黄酮类成分有关[10];查尔酮类成分具有一定的抗病毒效果[11];儿茶素活性成分能够加速骨髓细胞增殖,促进骨髓造血系统恢复作用[8, 12]。黄酮类物质是植物莽草酸代谢途径生成的次生代谢产物[14]。PAL是连接生物初级代谢和苯丙烷类代谢、催化苯丙烷类代谢的第一步反应酶,是一种诱导酶,矿质营养、温度、激素等环境信号均可以诱导PAL基因的表达[18-20]。本研究结果表明,Zn、B肥配施使PAL活性与总黄酮含量的变化趋势较一致,这也证实了PAL是苯丙烷类代谢的关键酶,这与王军妮等[21]的研究结果一致。另一方面,苯丙氨酸同时也是植物体蛋白质合成的前体物质,因而蛋白质同黄酮类成分的合成之间存在着竞争关系,本研究中鸡血藤的可溶性蛋白质含量和总黄酮含]量并不呈负相关关系,可能是因为可溶性蛋白质是植物生物体结构和功能重要的物质基础,参与植物的生长代谢,能够促进植物的生长,从而影响黄酮类化合物的合成。所以影响鸡血藤黄酮类化合物合成代谢的调控因子多样,调控机制复杂,需要进一步研究。
| [1] |
Chinese Pharmacopoeia Commission.
Pharmacopoeia of the People's Republic of China, Vol. 1[M]. Beijing: China Medical Science Press, 2015: 194.
国家药典委员会. 中华人民共和国药典, 一部[M]. 北京: 中国医药科技出版社, 2015: 194. |
| [2] |
TANG R N, QU X B, GUAN S H, et al. Chemical constituents of Spatholobus suberectus[J].
Chin J Nat Med, 2012, 10(1): 32-35. 唐任能, 曲晓波, 关树宏, 等. 鸡血藤的化学成分[J]. 中国天然药物, 2012, 10(1): 32-35. |
| [3] | LEE M H, LIN Y P, HSU F L, et al. Bioactive constituents of Spatholobus suberectus in regulating tyrosinase-related proteins and mRNA in HEMn cells[J]. Phytochemistry, 2006, 67(12): 1262-1270. DOI:10.1016/j.phytochem.2006.05.008 |
| [4] |
LI X Y, ZHOU L Y Z, LAI L C, et al. Comparison of HPLC fingerprint of flavonoid in dry and fresh Spatholobi caulis[J].
China J Exp Trad Med Formul, 2015, 21(20): 72-75. 李小莹, 周龙颖珍, 赖丽嫦, 等. 鸡血藤干、鲜品黄酮部位的高效液相指纹图谱比较[J]. 中国实验方剂学杂志, 2015, 21(20): 72-75. DOI:10.13422/j.cnki.syfjx.2015200072 |
| [5] |
ZHENG Y, LIU H, BAI Y J, et al. Five flavonoids from Spatholobus suberectus[J].
China J Chin Mat Med, 2008, 33(2): 152-154. 郑岩, 刘桦, 白焱晶, 等. 鸡血藤黄酮类化合物的研究[J]. 中国中药杂志, 2008, 33(2): 152-154. DOI:10.3321/j.issn:1001-5302.2008.02.011 |
| [6] |
RONG G T, HE G, NI S G, et al. Experiment of cutting seedling-raising of Millettia reticuiata Benth[J].
N Hort, 2016, 5(5): 171-174. 荣广天, 何钢, 倪尚格, 等. 鸡血藤的扦插育苗试验[J]. 北方园艺, 2016, 5(5): 171-174. DOI:10.11937/bfyy.201605045 |
| [7] |
XIE L S, HUANG Y F, LI J F. Breeding method of Spatholobus suberectus Dunn[J].
Xiandai Hort, 2014(11): 50 谢李崧, 黄玉芬, 黎军发. 鸡血藤繁育方法[J]. 现代园艺, 2014(11): 50 DOI:10.3969/j.issn.1006-4958.2014.11.032 |
| [8] |
QIN J X, HUANG S Y. Advances in pharmacologic action of Spatholobi caulis[J].
Lishizhen Med Mat Med Res, 2014, 25(1): 180-183. 秦建鲜, 黄锁义. 鸡血藤药理作用的研究进展[J]. 时珍国医国药, 2014, 25(1): 180-183. |
| [9] | CHEN M, JIA Z W, CHEN D F. Heteroclitin H, a new lignan from Kadsura heteroclite[J]. J Asian Nat Prod Res, 2006, 8(7): 643-648. DOI:10.1080/10286020500209053 |
| [10] |
NAN N, ZHANG G L, WANG X M. Progress of studies on anti-tumor effect with Suberect spatholobus stem[J].
China J Trad Chin Med Pharm, 2014, 29(8): 2563-2566. 南楠, 张甘霖, 王笑民. 鸡血藤抗肿瘤作用研究现状[J]. 中华中医药杂志, 2014, 29(8): 2563-2566. |
| [11] | PHRUTIVORAPONGKUL A, LIPIPUN V, RUANGRUNGSI N, et al. Studies on the chemical constituents of stem bark of Millettia leucantha:Isolation of new chalcones with cytotoxic, antiherpes simplex virus and antiinflammatory activities[J]. ChemInform, 2003, 34(31): 187-190. DOI:10.1002/chin.200331249 |
| [12] | WANG D X, LIU P, CHEN Y H, et al. Stimulating effect of catechin, an active component of Spatholobus suberectus Dunn., on bioactivity of hematopoietic growth factor[J]. Chin Med J, 2008, 121(8): 752-755. |
| [13] |
WANG W J, GUO X S. Effects of nitrogen, phosphorus, potassium and micronutrient fertilizers on the yield and quality of Huangshan Gongju[J].
Chin J Soil Sci, 2009, 40(2): 306-309. 王文军, 郭熙盛. 氮、磷、钾、锌、硼肥配施对黄山贡菊产量和品质的影响[J]. 土壤通报, 2009, 40(2): 306-309. |
| [14] |
LIU D H, GUO L P, HUANG L Q, et al. Effects of mineral nutrition on metabolism of flavonoids in medicinal plants[J].
China J Chin Mat Med, 2010, 35(18): 2367-2371. 刘大会, 郭兰萍, 黄璐琦, 等. 矿质营养对药用植物黄酮类成分合成的影响[J]. 中国中药杂志, 2010, 35(18): 2367-2371. DOI:10.4268/cjcmm20101801 |
| [15] |
WANG X K, HUANG J L.
Principles and Techniques of Plant Physiological and Biochemical Experiment[M]. 3rd ed. Beijing: Higher Education Press, 2015: 182-184.
王学奎, 黄见良. 植物生理生化实验原理与技术[M]. 第3版. 北京: 高等教育出版社, 2015: 182-184. |
| [16] |
CHENG S Y, CHEN K S, LIU W H, et al. Regulation and expression of the PAL in plant and its outlook[J].
J Fruit Sci, 2003, 20(5): 351-357. 程水源, 陈昆松, 刘卫红, 等. 植物苯丙氨酸解氨酶基因的表达调控与研究展望[J]. 果树学报, 2003, 20(5): 351-357. DOI:10.3969/j.issn.1009-9980.2003.05.004 |
| [17] |
FANG X, XIA Q. Effect of Zn on enzyme activities in animals and plants[J].
Prev Med Trib, 2014, 20(2): 127-129. 方旭, 夏嫱. 锌对动植物酶活性的影响[J]. 预防医学论坛, 2014, 20(2): 127-129. DOI:10.16406/j.pmt.issn.1672-9153.2014.02.001 |
| [18] | LEYVA A, JARILLO J A, SALINAS J, et al. Low temperature induces the accumulation of phenylalanine ammonia-lyase and chalcone synthase mRNAs of Arabidopsis thaliana in a light-dependent manner[J]. Plant Physiol, 1995, 108(1): 39-46. DOI:10.1104/pp.108.1.39 |
| [19] | NUGROHO L H, VERBERNE M C, VERPOORTE R. Activities of enzymes involved in the phenylpropanoid pathway in constitutively salicylic acid-producing tobacco plants[J]. Plant Physiol Biochem, 2002, 40(9): 755-760. DOI:10.1016/S0981-9428(02)01437-7 |
| [20] | SONG B Q, XIONG J, FANG C X, et al. Allelopathic enhancement and differential gene expression in rice under low nitrogen treatment[J]. J Chem Ecol, 2008, 34(5): 688-695. DOI:10.1007/s10886-008-9455-x |
| [21] |
WANG J N. Study on the regulation of flavonoids metabolism in mulberry[D]. Taian: Shandong Agricultural University, 2008: 24-46.
王军妮. 桑树黄酮类化合物代谢调控研究[D]. 泰安: 山东农业大学, 2008: 24-46. |
 2018, Vol. 26
2018, Vol. 26



