1b. 重庆市中药研究院, 中心实验室, 重庆 400065;
2. 重庆市中药良种选育与评价工程技术研究中心, 重庆 400065;
3. 中国中医科学院中药资源中心重庆分中心, 重庆 400065
1b. Central Laboratory, Chongqing Academy of Chinese Materia Medica, Chongqing 400065, China;
2. Chongqing Engineering Research Center for Fine Variety Breeding Techniques of Chinese Materia Medica, Chongqing 400065, China;
3. Chongqing Subcenter of National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Science, Chongqing 400065, China
青蒿(Artemisia annua L.)又名黄花蒿, 是菊科(Asteraceae)一年生药用草本植物, 具有清热解暑, 除蒸,截疟的功效。用于暑邪发热,阴虚发热,夜热早凉,骨蒸劳热,疟疾寒热,湿热黄疸等症。其提取物青蒿素对脑疟疾和氯喹疟疾具有高效低毒的抗疟性能, WHO已经认定复方青蒿素成药为目前最安全有效的抗疟药。目前青蒿素虽然能人工合成, 但成本很高, 未能产业化,主要从青蒿植物中提取。青蒿原料主要来自人工栽培,因生产中长期大量施用化肥,导致土壤酸化,环境污染,亟待寻找绿色环保无农残的肥料进行替代。
植物内生菌(Endophyte)是指在其生活史的一定阶段或者全部阶段生活于健康植物组织和器官内部的真菌或者细菌。有研究表明,内生菌及其代谢产物具有拮抗、促生长、抗肿瘤等多种活性[1-4]。本研究分离青蒿内生菌,旨在得到对青蒿有促生长作用的真菌菌株。迄今为止,青蒿内生菌的研究主要集中在抗癌、抗氧化、抗病原菌和促青蒿素产生等方面[5]。对其宿主促生作用方面的研究还很少。
本研究对青蒿内生真菌进行了分离和分子鉴定,得到一株深绿木霉(Trichoderma atroviride),大量研究表明[6-9],深绿木霉是一个多功能的有益真菌,可用于促进植物生长、抗病、产活性物质等众多领域。因此本文开展了深绿木霉对青蒿促生作用的研究,为研发青蒿专用菌肥,减少化肥施用提供科学依据。
1 材料和方法 1.1 供试材料8月从重庆市中药研究院植物园(以下简称植物园,海拔400 m,北纬29.35°,东经106.33°)人工栽培青蒿选取10株健壮无病虫害的植株,剪下侧枝, 采回后立即进行内生菌分离。
PDA固体培养基、PDB液体培养基参照陈世通等[10]的方法制备。
TaKaRa 9164和RR178试剂盒购自宝生物公司。PCR仪(S1000 Thermal Cycler)和凝胶成像仪(Gel Doc XR)均为美国BIO-RAD产品,电泳仪(DYY-6C型)和电泳槽(DYCP-31F)均为北京六一产品。
1.2 内生真菌的分离和纯化青蒿一级侧枝剪成3 cm长小段,用洗衣粉水洗涤2 min,流水冲洗40 min,再用75%乙醇洗涤1 min,1‰升汞消毒5 min后用无菌水洗涤4次。取最后1次洗涤的洗液数滴于PDA固体培养基涂布,共接种3皿,作为对照。青蒿材料用无菌滤纸吸干后,再次将茎段剪成0.5 cm长小段后接种于PDA固体培养基上,所有样品和对照于25℃黑暗培养5~10 d后,挑取样品周围长出的真菌菌丝转接入PDA平板培养基中纯化,经多次纯化直至获得纯菌落。
1.3 内生真菌分子鉴定及深绿木霉形态鉴定内生真菌分子鉴定 采用TaKaRa 9164和RR178试剂盒对分离出的内生真菌进行基因组DNA提取和对26S rDNA D1/D2区域序列进行PCR扩增。真菌基因组DNA提取:挑取少量菌丝体于1.5 mL EP管,加入TaKaRa 9164真菌裂解液50 μL,80℃水浴15 min, 离心,取上清液。PCR反应体系(总体积50 μL)包括:20 μL ddH2O, 25 μL PCR premix (TaKaRa), 4 μL真菌DNA模板, D1/D2正反向引物(TaKaRa)各0.5 μL。PCR扩增程序:94℃ 5 min,94℃30 s,55℃30 s,72℃1 min,循环30次;72℃延伸10 min。扩增产物经琼脂糖凝胶电泳检测后送华大基因公司测序。
深绿木霉形态鉴定 对经分子鉴定为深绿木霉的菌株进行菌落形态观察,光学显微镜观察以进一步证实其种属。
1.4 DNA序列分析及系统发育树构建登陆NCBI (http://www.ncbi.nlm.nih.gov/)利用BLAST将测序获得的各菌株ITS序列与GenBank中的已知序列进行比对,查找相似性最高的菌种, 确定分离菌株的分类地位。并用MEGA 5.0软件按照邻接法(neighbour-joining, N-J),自展数(bootstrap)为1 000,构建系统进化树。
1.5 深绿木霉发酵液对青蒿的促生作用研究深绿木霉发酵液制备 将4℃低温保存的菌活化后接种到PDA固体培养基上,置于25℃培养箱培养,间歇照光使其产生分生孢子。加入无菌水配制分生孢子悬浮液,用血球计数板计数,无菌水稀释,最终浓度为1×108 mL–1。取1 mL悬浮液于100 mL PDB液体培养基(250 mL三角瓶),置于25℃, 140 r min–1的摇床中培养。约6~7 d后,取出培养物,纱布过滤去渣,得到发酵液。
发酵液对青蒿种子发芽和幼苗生长的影响 青蒿品种为#200,种子用1‰高锰酸钾消毒后,无菌水清洗数次,放入垫滤纸的平皿,每皿100粒, 每处理3皿,加入不同稀释倍数的发酵液(原液、5×、10×、30×) 15 mL,以清水为对照。于25℃, 光照12 h,光强度21.58 μmol m–2s–1下培养,每天观察发芽情况,计算发芽率、发芽势和发芽指数。所得幼苗移栽育苗格中,每格1株,每处理60株,30 d后统计生长发育指标。
发酵液对青蒿幼苗生长的影响 青蒿品种为#200,3月中下旬将种子播于育苗格中,苗长至1 cm高时间苗,每格留苗1株。待青蒿幼苗高至2 cm时用深绿木霉发酵液(原液、3×、5×)浇灌,以清水为对照,每苗20 mL,分4次浇灌,两天浇灌完毕,防止一次性浇灌发酵液外漏影响效果。每处理40株,30 d后统计生长发育指标。
1.6 深绿木霉菌丝体对青蒿幼苗生长的影响4月中旬青蒿(品种#200)幼苗高至2 cm时施用菌丝体。设置3个菌丝体用量,分别是每株0.5、2和5 g,从青蒿幼苗根际打洞施入,盖土。对照浇清水每株5 mL,每处理55株,30 d左右统计生长发育指标。
6月再播种4个青蒿品种(#54、#23、#200和#160), 7月初苗高至2 cm时施用菌丝体,每株5 g,以每株5 mL的清水浇灌为对照,每处理30株,30 d后测量青蒿苗地上部分鲜重。
6月播种的青蒿(品种#200)在7月初苗高至2 cm时施用菌丝体,共设6个处理,分别为每株2.5、5、7.5、10 g和每株氮磷钾复合肥100 mg,以每株5 mL清水为对照,每处理70株。30 d后测量青蒿幼苗地上部分鲜重。
8月播种的青蒿(品种#200)在9月初苗高至2 cm时,每株施用深绿木霉发酵菌丝体5 g、氮磷钾复合肥100 mg,以每株5 mL清水为对照。每处理75株,30 d后测量青蒿苗地上部分鲜重。
1.7 数据的统计分析用SPSS 20.0软件对数据进行多重比较分析, P < 0.05为显著水平,P < 0.01为极显著水平。
2 结果和分析 2.1 青蒿内生真菌的分离和鉴定结果从青蒿侧枝中共分离出内生真菌23株,经分子鉴定出16种(表 1)。
| 表 1 青蒿内生真菌分子鉴定结果及类群组成 Table 1 Molecular identification and composition of endophytic fungi from Artemisia annua |
从表 1可见,从青蒿侧枝中分离出的内生菌中, 炭疽菌属(Colletotrichum)是优势属, 共有3种5株, 包括博宁炭疽菌(C. boninense)、茶树炭疽菌(C. fructicola)、卡斯特炭疽菌(C. karstii)。从图 1可见, 青蒿侧枝内生菌的形态多种多样。23株真菌中有5株仅鉴定到属, 1株鉴定到纲,说明这6株有可能包含尚未发现的新种。
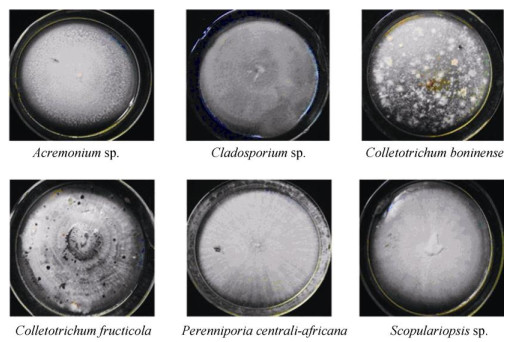
|
图 1 部分青蒿内生真菌菌落 Fig. 1 Part of endophytic fungi from Artemisia annua |
从图 2可见,深绿木霉菌株气生菌丝白色,絮状。菌落正面白色,背面无色。产孢簇开始是白色,后逐渐变黄绿色,成熟的产孢簇深绿色。菌落有较浓可可味。菌丝有隔,树状分枝,直径2.0~2.8 μm。分生孢子单细胞,亚球形至卵圆形,绿色,大小为3.0~5.0 μm。根据其形态及特殊的可可气味进一步证实其为深绿木霉菌株。
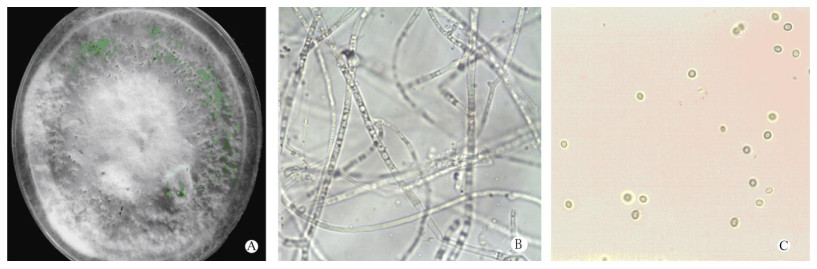
|
图 2 深绿木霉。A:菌落; B:菌丝; C:分生孢子。 Fig. 2 Trichoderma atroviride. A: Colony; B: Mycelium; C: Conidium. |
根据分子鉴定结果,选取17个近缘种的菌株,与分离所得内生真菌菌株构建系统发育树。从图 3可见,5株内生真菌与鸡枞菌(Termitomyces cartilaginous)聚为一支;4株内生真菌与冬生多孔菌(Polyporus brumalis)和中非多年卧孔菌(Perenniporia centrali-africana)聚为一支;3株内生真菌与茶树炭疽菌(Colletotrichum fructicola)聚为一支;3株内生真菌与博宁炭疽菌(C. boninense)聚为一支;其余8个菌株分别与其他菌聚为8个小支。
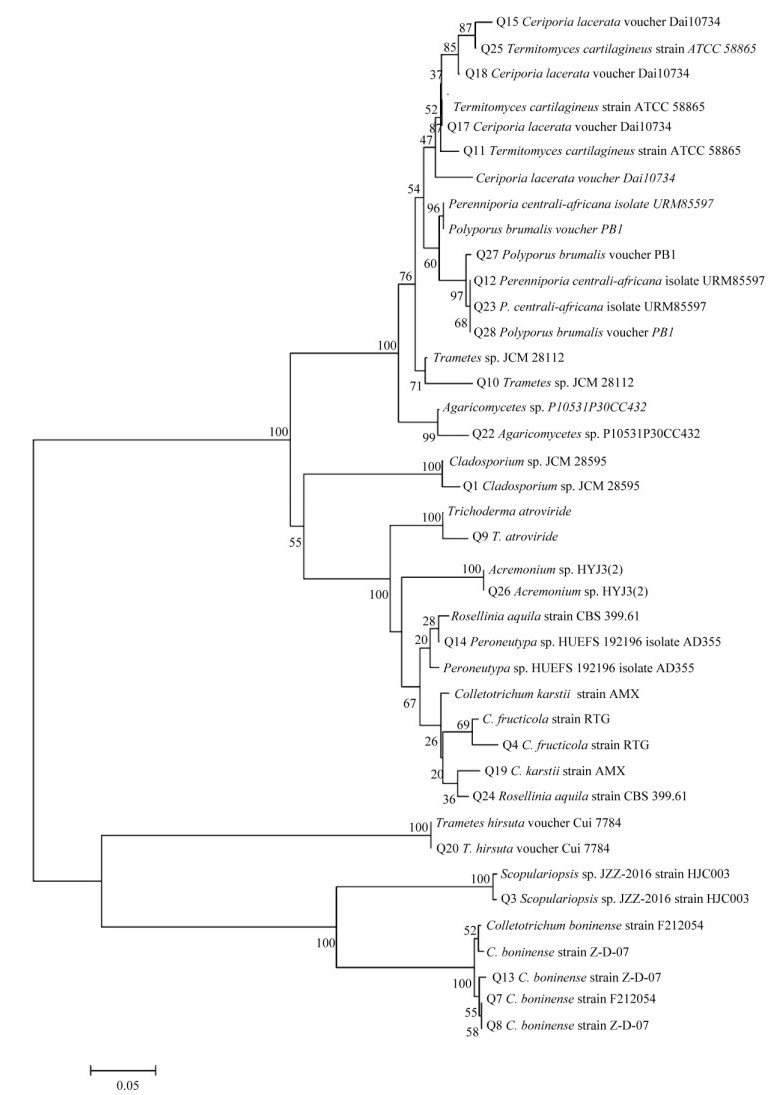
|
图 3 基于26S r DNA D1/D2序列的聚类分析 Fig. 3 Phylogenetic analysis based on 26S rDNA D1/D2 sequences |
从表 2可见,深绿木霉发酵液原液显著降低青蒿种子的发芽率、发芽势、发芽指数(P < 0.05),与对照相比,发芽率、发芽势和发芽指数分别下降了31.06%、54.09%和35.62%,说明其对青蒿种子发芽具有强烈抑制作用。但发酵液经过稀释后,抑制作用就减弱,稀释5倍以上与清水对照的没有显著差异。
| 表 2 深绿木霉发酵液对青蒿种子发芽的影响 Table 2 Effect of Trichoderma atroviride fermentation broth on seed germination of Artemisia annua |
从表 3可以看出,不同稀释倍数的深绿木霉发酵液浸泡青蒿种子后,其幼苗的总鲜重、总干重、地下干重、地上鲜重、地下鲜重等在不同处理间没有显著差异;根长在处理间虽有显著差异,但与发酵液浓度没有线性关系;发酵液原液处理的幼苗株高显著比稀释5×、10×和对照低(P < 0.05),但和稀释30×的差异不显著;发酵液原液处理的幼苗地上干重和根粗显著高于稀释30×和对照的(P < 0.05), 其茎粗也显著高于稀释30×的(P < 0.05)。发酵液原液处理的种子苗与对照相比,株高减少15.27%,根粗增加了8.99%,地上干重增加了11.76%。可见发酵液浸泡种子后,不仅会影响种子发芽率,还对幼苗生长也有影响,有使青蒿苗变粗变矮的倾向,具有类似激素样作用。
| 表 3 深绿木霉发酵液浸泡种子对幼苗生长的影响 Table 3 Seedling growth of Artemisia annua after seeds soaked with Trichoderma atroviride fermentation broth |
从表 4可看出,用深绿木霉发酵液原液浇灌的幼苗根长显著低于其他稀释处理和对照(P < 0.05);发酵液原液和稀释3×浇灌的株高均显著低于其他处理(P < 0.05);发酵液稀释1×、3×、5×浇灌的地下鲜重显著低于对照(P < 0.05);发酵液稀释1×、5×浇灌的地下干重和总干重均显著低于对照和稀释3×的(P < 0.05)。发酵液原液浇灌的幼苗与对照相比, 根长减少了17.02%,株高减少了38.43%,地下鲜重减少了241%,地下干重减少了44.44%,总干重减少了24%。因此,深绿木霉发酵液对青蒿幼苗生长有显著的抑制作用,且对株高和根部生长以及干物质积累的抑制作用最明显。这说明深绿木霉发酵液会使青蒿幼苗植株矮化。
| 表 4 深绿木霉发酵液对青蒿幼苗生长的影响 Table 4 Effect of Trichoderma atroviride fermentation broth on seedling growth of Artemisia annua |
从表 5可见,在4-5月每株用深绿木霉液体发酵菌丝体5 g处理青蒿幼苗,其株高、地下鲜重、地上鲜重、地下干重、地上干重、茎粗、根粗、总鲜重、总干重均显著优于清水处理和0.5、2 g菌丝体处理的(P < 0.05)。每株青蒿用发酵菌丝体5 g处理的植株与清水对照相比,株高增加了22.73%,地下鲜重增加了33.72%,地上鲜重增加了17.58%, 地下干重增长46.67%,地上干重增长18.6%,茎粗增长11.48%,根粗增长16.81%,总鲜重增加了25.49%,总干重增长31.94%。可见每株青蒿用深绿木霉液体发酵菌丝体5 g处理对其地上部分、地下部分的生长和干物质积累均有显著的促进作用,且对地下部分的促进作用比地上部分更大。但是菌丝体需要达到一定施用量(5 g ind.–1)才能起到明显的促进作用。
| 表 5 深绿木霉液体发酵菌丝体对青蒿4 -5月幼苗生长的影响 Table 5 Effect of Trichoderma atroviride mycelium on seedling growth of Artemisia annua during April-May |
从表 6可见,4个青蒿品种在7月用每株5 g的发酵菌丝体处理,其地上部分鲜重均与对照无显著性差异(P>0.05)。7月不同用量菌丝体处理的青蒿幼苗地上部分鲜重和清水对照没有显著差异(P> 0.05),但均极显著低于复合肥处理(P < 0.01),每株2.5、5、7.5和10 g菌丝体处理的青蒿幼苗地上部分鲜重分别为(0.265±0.067)、(0.270±0.057)、(0.255± 0.069)和(0.263±0.105) g,而100 mg复合肥处理的为(0.685±0.274) g, 清水对照的为(0.259±0.105) g。9月每株施用5 g菌丝体, 青蒿幼苗的地上部分鲜重[(0.200±0.077) g]和清水对照[(0.267±0.113) g]无显著差异(P>0.05),但极显著低于复合肥处理的[(0.774±0.379) g] (P < 0.01)。这表明发酵菌丝体对青蒿幼苗生长没有显著的促进作用。
| 表 6 深绿木霉液体发酵菌丝体对不同品种青蒿幼苗地上部分鲜重的影响 Table 6 Effect of Trichoderma atroviride mycelium on seedling growth of different varieties Artemisia annua |
本研究结果表明,从青蒿侧枝中分离出23株内生真菌,以炭疽菌属真菌为优势, 其中少数是植物的致病菌。除深绿木霉外,其余内生真菌未见促生作用的研究报道[11-13],因此选用深绿木霉作为青蒿促生作用的研究对象。
张树武等[14-15]的研究表明,深绿木霉发酵液对白三叶草(Trifolium repens)、黑麦草(Lolium perenne)的种子发芽和幼苗生长具有促进作用。而本研究中,深绿木霉发酵液对青蒿种子发芽具有强烈抑制作用,且对其萌发后的幼苗生长也有负面影响。深绿木霉发酵液对青蒿幼苗的生长也有明显抑制作用,影响植株干物质积累,具有使植株矮化的倾向。我们曾用深绿木霉发酵液原液连续浇灌黄连(Coptis chinensis),导致植株死亡,但目前未见深绿木霉发酵液对青蒿生长的抑制乃至致死作用的研究报道。深绿木霉发酵液的主要成分有抗生素、纤维素酶和其他一些化学物质[16-19], 其成分和浓度受菌株基因型、活力、培养基成分、培养条件等多种因素影响。而本试验发酵液中是什么成分抑制青蒿种子发芽和幼苗生长,尚有待进一步研究。
深绿木霉菌对很多植物有促生长的作用。在4-5月施用深绿木霉发酵菌丝体对青蒿幼苗的生长有明显的促进作用,可以显著促进植株的伸长和干物质积累,且具有一定的剂量效应。但在7月和9月,即使菌丝体施用剂量达到每株10 g,其促生作用却不明显。本地5-6月是梅雨季节,气温适宜, 雨量丰沛,土壤温度和湿度都适合深绿木霉生长, 而7-8月是35℃ ~40℃的连晴高温,9月虽然气温有所下降,但雨量不多,因此7-9月土温高,土壤干燥,深绿木霉菌可能脱水死亡,失去活性。由此推断,深绿木霉菌丝体对青蒿苗的促生作用是由于其活菌在土壤内的生长代谢等活动引起的,而不是菌丝体本身含有的养分为青蒿苗提供营养。菌体生活力旺盛与否决定了促生效果是否显著。因此,为了保证菌体活力,深绿木霉的施用有季节限制,应在4-6月施用比较合适。所以深绿木霉适合作为青蒿的苗肥,此时土壤温湿度适合其生长;而如果施用于大田成株青蒿,应配合化肥,即在中温多雨的6月施用深绿木霉,在高温干燥的7月施用化肥, 这样菌肥和化肥优势互补,减少了化肥的用量。
为何深绿木霉在PDB培养基中的代谢产物会显著抑制青蒿生长,而在土壤中的代谢产物和代谢活动却会显著促进青蒿生长,这是个值得探讨的问题。这可能是同一种菌,在不同条件下,代谢途径、代谢产物不同,造成对同样的对象有不同的作用效果。
| [1] |
YAO G L, LI L, XING Y H, et al. Preliminary study on separation and antibacterial activity of endophytic fungi from Hainan Plicanthus birmensis (Steph.) R. M. Schust[J].
Chem Bioeng, 2016, 33(7): 52-54. 姚广龙, 李乐, 邢炎慧, 等. 海南全缘褶萼苔内生真菌的分离及抑菌活性的初步研究[J]. 化学与生物工程, 2016, 33(7): 52-54. DOI:10.3969/j.issn.1672-5425.2016.07.012 |
| [2] |
DAI J X, DU X N. Antimicrobial and anti-tumor activities of endophytes from Lycium barbarum of Ningxia[J].
Chin J Chin Mat Med, 2017, 42(11): 2072-2077. 代金霞, 杜晓宁. 宁夏枸杞内生菌的抗菌和抗肿瘤活性研究[J]. 中国中药杂志, 2017, 42(11): 2072-2077. DOI:10.19540/j.cnki.cjcmm.20170415.001 |
| [3] |
RUAN D S, ZENG J H, CHAO Y Q, et al. Role of endophytes in plant tolerance to heavy metal stress[J].
Microbiol China, 2016, 43(12): 2700-2706. 阮迪申, 曾加会, 晁元卿, 等. 重金属胁迫下内生菌对宿主植物的解毒机制[J]. 微生物学通报, 2016, 43(12): 2700-2706. DOI:10.13344/j.microbiol.china.160051 |
| [4] |
WANG Z Z, XU T, YUAN S S, et al. Identification of an endophytic actinomyce OsiRt-1 isolated from rice and its effect against rice blast disease[J].
Microbiol China, 2016, 43(5): 1009-1018. 王真真, 徐婷, 袁珊珊, 等. 水稻内生放线菌OsiRt-1的分离鉴定及对稻瘟病的防治作用[J]. 微生物学通报, 2016, 43(5): 1009-1018. |
| [5] |
SONG C Z, CHEN X W, CHEN D H. Research progress on endophytes in medicinal plant Artemisia annua[J].
Biotechnol Bull, 2016, 32(1): 1-7. 宋春竹, 陈昕雯, 陈东红. 药用植物黄花蒿内生菌的研究进展[J]. 生物技术通报, 2016, 32(1): 1-7. DOI:10.13560/j.cnki.biotech.bull.1985.2016.01.002 |
| [6] |
SUN J N, ZHANG T L, CHEN S W, et al. Clonging, function prediction of ABC transporter (TaPdr2) related to the degradation of dichlorvos in Trichoderma atroviride T23[J].
J Shanghai Jiaotong Univ (Agric Sci), 2016, 34(6): 1-8. 孙佳楠, 张泰龙, 陈硕闻, 等. 深绿木霉(Trichoderma atroviride) T23降解有机磷农药敌敌畏转运蛋白TaPdr2基因的克隆与功能预测分析[J]. 上海交通大学学报(农业科学版), 2016, 34(6): 1-8. DOI:10.3969/J.ISSN.1671-9962.2016.06.001 |
| [7] |
LIANG Q L, HAN L, ZHOU Q Y. Study on induced resistant of protein isolate from fermentation broth of Trichoderma atroviride T2[J].
Grassland Turf, 2016, 36(3): 28-34. 梁巧兰, 韩亮, 周其宇. 深绿木霉T2发酵液蛋白分离物诱导抗病作用研究[J]. 草原与草坪, 2016, 36(3): 28-34. DOI:10.13817/j.cnki.cyycp.2016.03.006 |
| [8] |
XU B L, YU J H. Mechanisms of Trichoderma Atroviride strain T2 antagonism against Bipolaris sorokiniana[J].
Acta Pratacul Sin, 2006(4): 71-75. 徐秉良, 郁继华. 深绿木霉菌株T2对草坪草叶枯病菌的拮抗作用及机制[J]. 草业学报, 2006(4): 71-75. |
| [9] |
LIANG Q L, WANG F, WEI L X, et al. Antagonistic mechanisms of Trichoderma Atroviride T2 strain against Phytophthora nicotianae[J].
Plant Protect, 2011, 37(6): 164-167, 205. 梁巧兰, 王芳, 魏列新, 等. 深绿木霉T2菌株对百合疫霉拮抗作用及机制[J]. 植物保护, 2011, 37(6): 164-167, 205. |
| [10] |
CHEN S T, BAI J B, PU M, et al. Single-spore crossing of Lentinula edodes and identification of hybrid strains using inter-simple sequence repeat (ISSR) markers[J].
Acta Edulis Fungi, 2013, 20(1): 1-8. 陈世通, 白建波, 蒲敏, 等. 香菇单孢杂交及杂交菌株分子鉴定[J]. 食用菌学报, 2013, 20(1): 1-8. DOI:10.3969/j.issn.1005-9873.2013.01.001 |
| [11] |
CHENG L J, XU B L, LIANG Q L. Impact of Trichoderma aureoviride on the germination rate of several species of forage seeds[J].
Grassl Turf, 2008(6): 28-31. 程玲娟, 徐秉良, 梁巧兰. 深绿木霉对几种牧草草种发芽率的影响[J]. 草原与草坪, 2008(6): 28-31. DOI:10.13817/j.cnki.cyycp.2008.06.007 |
| [12] | HICKS E, BIENKOWSKI D, BRAITHWAITE M, et al. Trichoderma strains suppress Rhizoctonia diseases and promote growth of potato[J]. Phytopathol Med, 2014, 53(3): 502-514. DOI:10.14601/Phytopathol_Mediterr-14476 |
| [13] | REGLIŃSKI T, RODENBURG N, TAYLOR J T, et al. Trichoderma atroviride promotes growth and enhances systemic resistance to Diplodia pinea in radiata pine (Pinus radiata) seedlings[J]. For Pathol, 2012, 42(1): 75-78. DOI:10.1111/j.1439-0329.2010.00710.x |
| [14] |
ZHANG S W, XU B L, CHENG L J, et al. Effects of Trichoderma aureoviride fermentation on the growth and physiological characteristics of Trifolium repens[J].
Acta Pratac Sci, 2015, 24(2): 161-167. 张树武, 徐秉良, 程玲娟, 等. 深绿木霉对白三叶草促生作用及生理生化特性的影响[J]. 草业学报, 2015, 24(2): 161-167. DOI:10.11686/cyxb20150218 |
| [15] |
ZHANG S W, XU B L, CHENG L J. Effects of fermentation medium of Trichoderma aureoviride on growth and physiological characteristics of ryegrass[J].
Agric Res Arid Areas, 2014, 32(2): 157-162. 张树武, 徐秉良, 程玲娟. 深绿木霉发酵液对黑麦草促生作用及生理生化特性的影响[J]. 干旱地区农业研究, 2014, 32(2): 157-162. DOI:10.7606/j.issn.1000-7601.2014.02.025 |
| [16] | OH S U, LEE S J, KIM J H, et al. Structural elucidation of new antibiotic peptides, atroviridins A, B and C from Trichoderma atroviride[J]. Tetrahed Lett, 2000, 41(1): 61-64. DOI:10.1016/S0040-4039(99)02000-6 |
| [17] | KOVÁCS K, MEGYERI L, SZAKACS G, et al. Trichoderma atroviride mutants with enhanced production of cellulase and β-glucosidase on pretreated willow[J]. Enzyme Microb Technol, 2008, 43(1): 48-55. DOI:10.1016/j.enzmictec.2008.02.006 |
| [18] | MING Q L, HAN T, LI W C, et al. Tanshinone ⅡA and tanshinone Ⅰ production by Trichoderma atroviride D16, an endophytic fungus in Salvia miltiorrhiza[J]. Phytomedicine, 2012, 19(3/4): 330-333. DOI:10.1016/j.phymed.2011.09.076 |
| [19] | ODA S, ISSHIKI K, OHASHI S. Production of 6-pentyl-α-pyrone with Trichoderma atroviride and its mutant in a novel extractive liquidsurface immobilization (Ext-LSI) system[J]. Proc Biochem, 2009, 44(6): 625-630. DOI:10.1016/j.procbio.2009.01.017 |
 2018, Vol. 26
2018, Vol. 26


