蛇足石杉[Huperzia serrata (Thunb.) Trev.]是中国传统的珍贵药用植物,又名千层塔、蛇足草,为石杉科(Huperziaceae)石杉属多年生蕨类植物,民间常将其全草入药,外敷用于治疗痈疽、疥疮、烫火伤。1986年,刘嘉森等[1]首次报道蛇足石杉中的石杉碱甲(Huperzine A, HupA)对乙酰胆碱酯酶(Acetylcholinesterase, AChE)有强效、低毒、可逆的抑制作用。同时,HupA能提高脑内胆碱能作用及减少可溶的β淀粉体和减缓淀粉样蛋白空斑的形成,对老年记忆提高和改善有良好的功效[2-4]。HupA作为天然的治疗阿尔茨海默症药物已经备受生物制药领域的关注,被美国FDA列为第二代胆碱酯酶抑制剂之一。
由于HupA药源野生蛇足石杉生物量小,生长缓慢, 长期遭到掠夺性采挖,导致植物资源匮乏。为了寻找可替代资源,陆续在化学合成、内生菌发酵和组织培养方面进行了探索研究,以期建立生产HupA的有效方法。但化学合成反应步骤复杂、耗资大且合成的HupA毒副作用大[5],脱离蛇足石杉的内生真菌菌株易退化[6],难以实现规模化生产。近年来,在组织培养方面相继有以蛇足石杉茎尖为外植体,培养出离体侧芽[7-8]和丛生芽[8]的报道;本研究室先后报道了蛇足石杉离体叶状体的培养技术及叶状体是产HupA的最佳蛇足石杉培养物形态[9-11], 但叶状体中HupA含量尚待提高。
人工诱变技术是提高植物变异频率、丰富种质遗传与表型多样化和选育优良品种的有效方法。化学诱变剂有引起染色体加倍或断裂、DNA结构或点位突变和DNA复制错配等生物效应。其中诱变剂H2O2可以通过过氧化氢或羟自由基等活性氧物质作用于DNA上,造成DNA的单链或双链断裂及碱基的改变,引起物种遗传分子发生变异[12]。本文利用H2O2诱变处理离体蛇足石杉叶状体,观察M0代(诱变当代)启动恢复生长情况,并建立M1代诱变株系,为后代稳定、有效的变异株系筛选提供科学依据。
1 材料和方法 1.1 材料以本实验室前期建立能产石杉碱甲的蛇足石杉叶状体为材料[9],野生蛇足石杉[Huperzia serrata (Thunb.) Trev.]植株由中国科学院庐山植物园詹远怀研究员鉴定与提供。
1.2 H2O2诱变处理将初始蛇足石杉叶状体(即M0代,设为对照CK)在无菌条件下分离成单片叶片(鳞片叶),分别放进盛有3%、4.5%、6%浓度的H2O2浸泡进行胁迫处理,每个浓度分别浸泡7 min、10 min、13 min、16 min和19 min,然后用无菌水洗净残余的H2O2,随后移入叶状体培养基培养观察(每瓶20片),转接后90 d统计恢复生长的鳞片叶数,每个处理重复3次。存活率(%)=恢复生长叶片数/总接种叶片数×100%。
1.3 叶状体株系建立与培养株系建立和继代 取启动恢复生长了60 d的单个蛇足石杉叶状体团块,分别在无菌条件下分割成小块,接种到新配置的叶状体培养基建成单个株系,并以SH1、SH2…命名株系,以后每世代在50 d继代1次,按株系分别扩大继代考察诱变效应。
培养条件 参照吉枝单等[10]报道的1/4MS叶状体培养基,pH为5.8~6.0,光照强度为377 μmol m-2s-1的白光,每日光照15 h,在恒温(22±2)℃培养箱培养,80 d为1个收获世代。
叶状体HupA提取和HPLC检测 参照陈曼等[13]的方法。
1.4 乙酰胆碱酯酶(AChE)活性检测采用DTNB显色法检测叶状体AChE的活性[14]。反应体系包括:0.25 g mL-1的叶状体提取液或30 μg mL-1的HupA标准品25 μL,0.22 U mL-1的AChE 25 μL、5 mmol L-1的硫代碘代乙酰胆碱(ATCI) 30 μL,0.1 mol L-1 (pH 7.8)的磷酸缓冲液补至终体积95 μL,混匀37℃孵育30 min后,取出加入4%十二烷基硫酸钠10 μL终止反应20 min,加入100 μL 0.05 mmol L-1 DTNB显色反应,最后取200 μL到96孔,在410 nm波长处测定OD值。计算AChE的抑制率(I, %)=[(A阴性-A阳性)-(A样品-A本底)]/(A阴性-A阳性)×100%。
1.5 SOD检测SOD粗酶提取 精准称取0.2 g培养了80 d的新鲜叶状体置于研钵,立即加液氮冷冻后,按1:6 (W/V)加入用0.1 mol L-1 pH 7.8磷酸缓冲液配置好的SOD提取液(内含5 mmol L-1 DTT和5% PVP), 冰浴中研磨成匀浆,在12000×g下4℃离心20 min,收集上清即为SOD粗酶液,并用Bradford[15]法检测酶蛋白浓度,-20℃冰箱保存备用。
SOD同工酶电泳 采用厚为1.00 mm,浓度为10%的分离胶和3.75%的浓缩胶电泳分离SOD同工酶[16]。每个胶孔点样总量为6.65 μg蛋白,分别采用稳压80 V和150 V冰浴(4℃~6℃)进行浓缩胶和分离胶电泳,氮蓝四唑(NBT)染色。
1.6 可溶性蛋白检测蛋白提取和电泳 精准称取0.2 g培养了80 d的新鲜叶状体,采用谷瑞升等[17]报道的改良丙酮沉淀法提取和可溶蛋白质储备液制备,并使用Bradford[15]法检测蛋白质浓度,-20℃保存作进样备用。SDS-聚丙烯凝胶电泳(SDS-PAGE)采用5%浓缩胶和12%的分离胶,每个点样孔上样量为10 μg蛋白。分别采用稳压80 V和135 V室温进行浓缩胶和分离胶电泳。
染色和脱色 将胶块浸没在50 mL配置好的0.1%考马斯亮兰R-250染色后,微波炉加热40 s (每次20 s)辅助染色,然后室温静置染色20 min后, 用含有5%甲醇、7%冰醋酸的脱色液进行脱色至背景色透明,立即拍照。
1.7 数据统计分析采用Origin 2015统计相关数据,使用SPSS软件进行数据显著性分析。
2 结果和分析 2.1 H2O2胁迫诱变效应从表 1可见,蛇足石杉叶状体的存活率随着H2O2浓度的加大和处理时间的延长呈下降趋势。当H2O2浓度大于4.5%时,鳞片叶存活率明显下降。当H2O2浓度为3%胁迫处理16 min时的存活率为47.63%,接近半致死率。基于半致死剂量为诱变处理常用量,本实验选用3%的H2O2进行诱变处理16 min。
| 表 1 H2O2处理对鳞片叶存活率(%)的影响 Table 1 Effect of H2O2 on leaf survival (%) |
经H2O2胁迫诱变处理后的鳞片叶,接种到叶状体培养基培养观察。培养3 d后叶状体呈白褐色(图 1: A),15 d后出现恢复生长迹象,可以看到鳞叶片有凸起“绿色星点”(图 1: B)。将恢复生长了60 d的单个叶状体团块切割成小块转接到新配制的培养基上建成单个叶状体株系,共建立了115个株系。依据各株系的相对生长率、干物质含量以及积累HupA含量的表现,从中选留了20个株系(表 2)。这20个叶状体株系第7代HupA含量均表现显著差异(P<0.05),它们HupA含量比对照株(CK)高, 约提高了0.46~2.61倍。SPSS-ward聚类分析表明, 当聚类系数小于5时,可将包括初始株在内的共21个株系分为a、b、c、d、e五类代谢水平(表 2)。其中SH40、SH42、SH43株属于高产HupA株系,依据相对生长率和产HupA质量分数两个指标,SH42为最好的高产HupA株系,其相对生长率和HupA含量分别达到4499.28%和(261.17±0.19) μg g-1DW, 比CK株分别提高了2.35倍和2.43倍。

|
图 1 诱变处理后恢复生长的鳞片叶。A:移接第3天;B:移接第15天。 Fig. 1 Restore growth of leaves after mutation treatment. A: The third day after transplanted; B: The 15th day after transplanted. |
| 表 2 诱变叶状体第7代的相对生长率和HupA含量的比较 Table 2 Comparison of relative growth rate and HupA content in mutation thallus at 7th generation |
统计连续多代培养诱变后代叶状体株系的相对生长率和HupA含量,结果表明,CK株的相对生长率和积累HupA含量均表现出稳定性;诱变后代叶状体的相对生长率在世代间变化不显著,而积累HupA含量在第2~5代表现不稳定,自第5代以后,虽各株系积累HupA的水平不同但趋于稳定(图 2: A)。

|
图 2 叶状体在继代培养中的HupA含量(A)和叶状体提取物对AChE活性的抑制率(%) (B) Fig. 2 HupA content of thallus in subcultures (A) and AChE inhibitory rate of thallus extracts (B) |
叶状体提取物对AChE活性试验结果表明,高效液相检测不同HupA含量的叶状体对AChE抑制率存在显著差异(图 2: B),高产HupA叶状体的抑制率较高,证实了H2O2对叶状体次生产物具有有效诱变作用。
2.4 叶状体株系间SOD同工酶酶谱及可溶性蛋白图谱特征6个叶状体株系的SOD同工酶酶谱共显示3条谱带,P1、P2和P3的Rf分别为0.096、0.25和0.46(图 3: A)。其中SH35、SH40、SH42、SH43株系具有P1、P2、P3带;SH29、HS30株系则缺少P1带, 且SH29株的P2、P3带亮度高,即表明酶含量较高。这表明6个株系在相同培养条件下的SOD同工酶酶谱间具有明显的差异,其中Rf为0.096谱带的表达与高产HupA性状有一定规律,疑为高产株系的SOD特异酶带。
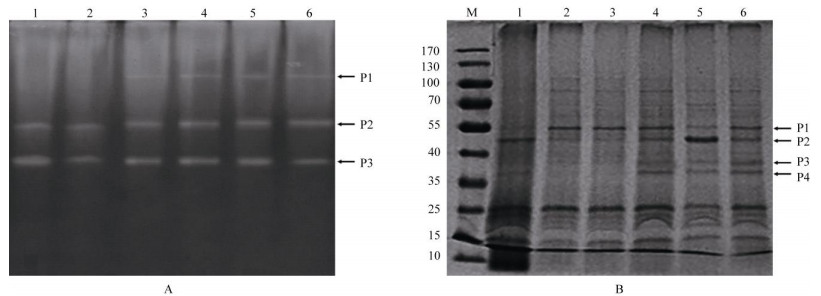
|
图 3 叶状体培养80 d的SOD同工酶酶谱(A)和可溶性蛋白SDS-PAGE的图谱(B)。A: 1: SH29; 2: SH30; 3: SH35; 4: SH40; 5: SH42; 6: SH43; B: M: Marker; 1: CK; 2: SH13; 3: SH30; 4: SH40; 5: SH42; 6: SH43。 Fig. 3 Maps of SOD isoenzyme (A) and soluble protein (B) of thallus cultured for 80 days. A: 1: SH29; 2: SH30; 3: SH35; 4: SH40; 5: SH42; 6:SH43; B: M: Marker; 1: CK; 2: SH13; 3: SH30; 4: SH40; 5: SH42; 6: SH43. |
从图 3: B可以看出,6个叶状体株系的可溶性蛋白电泳图谱带非常丰富,株系间存在许多相似的谱带,但也有差异表达的条带。与CK株比较,诱变株系的蛋白质条带更丰富,在55~170 kD间出现较多条带。SH13、SH30株系未出现P4带,而SH40、SH42、SH43株系都表达了P1、P2、P3、P4条带,但这些带的深浅有明显差异,表明不同叶状体株系的可溶性蛋白质在相同培养条件有选择性差异表达。
3 讨论植物次生代谢产物作为特有功效的天然产物和药用植物的主要活性成分,其生物合成量往往比较低。为了提高这些次生代谢产物的生物合成,已从优化培养基、改变生长条件、采用人工诱变和转基因技术等多方面进行了探索研究,以期推广规模化生产。紫外线辐照和甲基磺酸乙酯(EMS)诱变剂常用于植物离体培养筛选高产目标次生代谢产物[18-19]。针对蛇足石杉中的HupA具有强抗氧化性[13], 本研究选择H2O2诱变处理蛇足石杉叶状体。经连续近10代的培养,采用高效相液相色谱(HPLC)检测诱变后代各株系的目标产物HupA含量,建立了一批叶状体株系,其中SH42株系为双高产叶状体株系,其相对生长率和HupA含量比CK株分别提高了2.35倍和2.43倍。这表明H2O2适用于HupA生物合成通路的诱变育种,同时,该诱变技术可为本领域的相同类型研究提供借鉴应用。
有研究表明,植物经诱变剂处理后,诱变后代变异株系细胞的同工酶和可溶性蛋白质表达均会发生明显变化,两者作为基因表达的直接产物,可以直观地反映个体间遗传的差异[20-21]。本研究H2O2诱变蛇足石杉叶状体对SOD同工酶和可溶性蛋白质也发生了明显的效应。高产株系较低产株系在Rf为0.096处多了1条SOD同工酶条带,表明高产株系体内的抗氧化系统能力有增强。当瞬间超氧阴离子自由基升高,一方面,该信号可能激发次生代谢物合成的响应;另一方面,在高产株系中存在新的抗氧化SOD同工酶与超氧阴离子自由基作用解毒, 以保证叶状体高产株系正常的生命结构和代谢活动不受影响。可溶性蛋白质电泳带谱表明叶状体高产株系的差异蛋白条带丰富,为研究次生产物HupA积累的生物合成关键酶提供了物质基础。鉴于代谢途径是由多个基因产物调控的,H2O2诱变提高HupA量的生物合成分子机理还待进一步深入研究。
| [1] |
LIU J S, YU C M, ZHOU Y Z, et al. Study on the chemistry of huperzine A and B[J].
Acta Chim Sin, 1986, 44(10): 1035-1040. 刘嘉森, 俞超美, 周有作, 等. 石杉碱甲和石杉碱乙的化学研究[J]. 化学学报, 1986, 44(10): 1035-1040. |
| [2] | ZHANG H Y, TANG X C. Neuroprotective effects of huperzine A:New therapeutic targets for neurodegenerative disease[J]. Trends Pharmacol Sci, 2006, 27(12): 619-625. DOI:10.1016/j.tips.2006.10.004 |
| [3] | RATIA M, GIMÉNEZ-LLORT L, CAMPS P, et al. Huprine X and huperzine A improve cognition and regulate some neurochemical processes related with alzheimer's disease in triple transgenic mice (3xTg-AD)[J]. Neurodegener Dis, 2013, 11(3): 129-140. DOI:10.1159/000336427 |
| [4] | QIAN Z M, KE Y. Huperzine A:Is it an effective disease-modifying drug for Alzheimer's disease?[J]. Front Aging Neurosci, 2014, 6: 216 DOI:10.3389/fnagi.2014.00216 |
| [5] | MA X Q, TAN C H, ZHU D Y, et al. Huperzine A from Huperzia species:An ethnopharmacolgical review[J]. J Ethnopharmacol, 2007, 113(1): 15-34. DOI:10.1016/j.jep.2007.05.030 |
| [6] |
LIANG H, PAN L H, LUO J P. Research progress on sustainable utilization of huperzine A resources[J].
J Anhui Agric Sci, 2010, 38(23): 12467-12468. 梁昊, 潘利华, 罗建平. 石杉碱甲资源可持续利用研究进展[J]. 安徽农业科学, 2010, 38(23): 12467-12468. DOI:10.13989/j.cnki.0517-6611.2010.23.261 |
| [7] |
LIU J H, MA Y Z, ZHANG J L, et al. Study on lateral buds induction and culture of Huperzia serrata[J].
Chin Trad Herb Drugs, 2016, 47(17): 3103-3108. 刘江海, 马英姿, 张家玲, 等. 蛇足石杉侧芽的发生与培养研究[J]. 中草药, 2016, 47(17): 3103-3108. DOI:10.7501/j.issn.0253-2670.2016.17.024 |
| [8] |
LI X J, YANG X F, ZHU W N, et al. Plant regeneration of Huperzia serrata by rapid propagation of shoot tips[J].
Mod Chin Med, 2014, 16(5): 387-390. 李晓君, 杨雪飞, 朱皖南, 等. 蛇足石杉茎尖组织培养研究[J]. 中国现代中药, 2014, 16(5): 387-390. DOI:10.13313/j.issn.1673-4890.2014.05.010 |
| [9] |
JI Z D, TU Y S, DING M H, et al. In vitro culture of Huperzia serrata thallus for the medicinal component production[J].
Nat Prod Res Dev, 2014, 26(5): 645-649, 720. 吉枝单, 涂艺声, 丁明华, 等. 蛇足石杉离体培养产生有效成分的研究[J]. 天然产物研究与开发, 2014, 26(5): 645-649, 720. DOI:10.16333/j.1001-6880.2014.05.004 |
| [10] |
JI Z D, TU Y S, CHEN M, et al. Conditional optimization and kinetic research on producing huperzine A using Huperzia serrata in vitro[J].
Chin Trad Herb Drugs, 2016, 47(3): 488-492. 吉枝单, 涂艺声, 陈曼, 等. 蛇足石杉离体培养产石杉碱甲的条件优化及动力学研究[J]. 中草药, 2016, 47(3): 488-492. DOI:10.7501/j.issn.0253-2670.2016.03.023 |
| [11] |
Xu X Z, Tu Y S, JI Z D, et al. In vitro-cultured morphological changes in Huperzia serrata and accumulation of huperzine A[J].
Chin Bull Bot, 2015, 50(6): 733-738. 徐贤柱, 涂艺声, 吉枝单, 等. 蛇足石杉离体培养物形态变化与石杉碱甲积累的研究[J]. 植物学报, 2015, 50(6): 733-738. DOI:10.11983/CBB14220 |
| [12] | TERMINI J. Hydroperoxide-induced DNA damage and mutations[J]. Mutat Res, 2000, 450(1/2): 107-124. DOI:10.1016/S0027-5107(00)00019-1 |
| [13] |
CHEN M, TU Y S, YE L N, et al. Effect of amino acids on thallus growth and huperzine A accumulation in Huperzia serrata[J].
Chin Bull Bot, 2017, 52(2): 218-224. 陈曼, 涂艺声, 叶丽婻, 等. 氨基酸对蛇足石杉叶状体增殖及石杉碱甲积累的影响[J]. 植物学报, 2017, 52(2): 218-224. DOI:10.11983/CBB16033 |
| [14] |
DONG L H, FAN S W, LING Q Z, et al. Study on huperzine A-producing endophytic fungi isolated from Huperzia serrata[J].
Nat Prod Res Dev, 2014, 26(5): 650-655. 董丽辉, 范三微, 凌庆枝, 等. 千层塔中产石杉碱甲内生真菌的研究[J]. 天然产物研究与开发, 2014, 26(5): 650-655. DOI:10.16333/j.1001-6880.2014.05.001 |
| [15] | BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72(1/2): 248-254. |
| [16] |
LUO G H, WANG A G. Studies on gel electrophoresis and activity of SOD in plants[J].
Plant Physiol Commun, 1983(6): 44-45. 罗广华, 王爱国. 植物SOD的凝胶电泳及活性的显示[J]. 植物生理学报, 1983(6): 44-45. DOI:10.13592/jcnki.ppj.1983.06.024 |
| [17] |
GU R S, LIU Q L, CHEN X M, et al. Comparison and optimization of the methods on protein extraction and SDS-PAGE in woody plants[J].
Chin Bull Bot, 1999, 16(2): 171-177. 谷瑞升, 刘群录, 陈雪梅, 等. 木本植物蛋白提取和SDS-PAGE分析方法的比较和优化[J]. 植物学通报, 1999, 16(2): 171-177. DOI:10.3969/j.issn.1674-3466.1999.02.011 |
| [18] |
TU Y S, WU X C. Clone screening of high yield of flavonoids from grass coral[J].
Chin Trad Herb Drugs, 2006, 37(2): 276-279. 涂艺声, 吴笑臣. 筛选草珊瑚黄酮高产细胞克隆系的研究[J]. 中草药, 2006, 37(2): 276-279. DOI:10.3321/j.issn:0253-2670.2006.02.044 |
| [19] | KIM M, AHN J, JEON H, et al. Development of a Dunaliella tertiolecta strain with increased zeaxanthin content using random mutagenesis[J]. Mar Drugs, 2017, 15(6): 189 DOI:10.3390/md15060189 |
| [20] |
LI X Y, SUN Y X, SONG L P, et al. Effect of UV-B radiation on POD and SOD isoenzyme of Arabidopsis thaliana[J].
SW Chin J Agric Sci, 2011, 24(6): 2143-2146. 李晓阳, 孙永星, 宋丽平, 等. UV-B辐射对拟南芥POD、SOD同工酶的影响[J]. 西南农业学报, 2011, 24(6): 2143-2146. DOI:10.3969/j.issn.1001-4829.2011.06.024 |
| [21] |
GAO W Y, LI K F, GAO X M, et al. Effects of space environment on DNA mutagenesis and secondary metabolites in Glycyrrhiza uralensis[J].
Chin Sci Bull, 2008, 38(11): 1090-1094. 高文远, 李克峰, 高秀梅, 等. 太空环境对甘草DNA诱变作用和次生代谢产物的影响[J]. 中国科学C辑:生命科学, 2008, 38(11): 1090-1094. DOI:10.3724/SP.J.1005.2008.01083 |
 2017, Vol. 25
2017, Vol. 25



