2. 广州市白江湖森林公园管理处, 广州 511390;
3. 云浮市林业科学和技术推广中心, 广东 云浮 527300
2. Administrative Office of Baijianghu Forest Park of Guangzhou, Guang zhou 511390, China;
3. Yunfu Forestry Science and Technology Promotion Center, Yunfu 527300, Guangdong, China
光是植物光合作用的动力源泉,是影响植物生长发育最重要的生态因子,光照强度的改变对植物的生长、形态、开花、繁殖等都有着显著的影响[1-4]。不同植物在不同的生长发育阶段对光照的需求也是不一样的[5],特别是在苗期,光照条件会直接关系到幼苗的形态建成,影响着后期苗木的生长潜能大小[6-7]。人工遮荫是常用的光强处理方法,它能够显著影响苗木的生长发育进程。闫小莉等[8]的研究表明,40%遮荫会有效提高苦丁茶(Ligustrum robustum)的生长和光合能力。而降香黄檀(Dalbergia odorifera)幼苗适宜生长在全光照条件下,遮荫不利于其生长发育[9]。青钱柳(Cyclocarya paliurus)随光照强度增大,生长量先增加后减小[10]。因此给予适宜的生长光强对苗木生长发育及获得高质量的苗木具有重要意义。
裸花紫珠(Callicarpa nudiflora)为马鞭草科(Verbenaceae)紫珠属植物,灌木至小乔木,是海南大宗道地药材之一。在我国主要分布于海南、广东、广西、云南等地,美洲地区也有少量分布[11]。裸花紫珠含有黄酮类、萜类、酚类及挥发油类等多种物质,具有止血、抗炎、抑菌等功效,因此具有很高的药用价值及经济效益[12-13]。
目前关于裸花紫珠的研究多集中在药理[14-16]和扦插繁殖[17-18]方面,关于遮荫对裸花紫珠苗期生长发育的影响尚未见报道。本研究以2年生裸花紫珠苗为对象,探究遮荫条件下裸花紫珠光合气体交换参数、叶绿素荧光参数和总黄酮含量的变化规律,以期寻找适合裸花紫珠苗期生长的光照条件, 为裸花紫珠的人工种植和培育高品质的药材提供理论依据。
1 材料和方法 1.1 材料试验地点位于广州市中国林业科学研究院热带林业研究所苗圃(113°18′ E,23°06′ N),属南亚热带季风气候,雨量充沛,气候温暖。年平均气温为20℃~22.0℃,全年降水量为1720 mm,全年平均相对湿度77%。2016年6月选择苗圃培育的生长一致、同源同质的2年生裸花紫珠实生苗,选用规格一致的塑料花盆(高180 mm,口径200 mm,底径140 mm)进行盆栽试验,每盆1株。将盆栽幼苗放于自然光下生长1个月,期间只进行定期的浇水管理。
1.2 方法2016年7月开始用黑色遮荫网进行遮荫处理, 通过不同厚度质地遮荫网来调整遮荫程度,并在晴朗的正午使用AR-823照度计多点测定遮荫网下和无遮荫条件下的光照强度,通过二者的比值算出透光率,再转换成遮荫程度。共设置4种遮荫处理, 分别为30%、50%、70%,以全光照(遮荫0%)作为对照, 按常规栽培技术管理。单因素随机区组设计, 每处理小区10株,盆间距为40 cm,重复3次,共计12个小区,120株试验苗,所有处理统一常规化管理。遮荫40 d后进行光合和叶绿素荧光参数的测定,光合测定完成后,各处理采集光合测定时标记的叶片进行色素含量和总黄酮含量的测定。
光合和荧光参数日变化的测定 选择晴朗无云的天气,采用美国LI-COR公司生产的LI-6400型便携式光合仪测定不同遮荫处理的裸花紫珠苗的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)等参数的日变化,6:00-18:00每隔2 h测1次,每个处理从小区中间行选择长势一致的3株植株进行参数测定,每株选择3~5片功能叶,做上标记,以保证后面测定的一致性,每叶片读取3个稳定数值,取平均值。利用美国OPTI-sciences公司生产的OS-30P+快速植物胁迫测量仪,测定裸花紫珠的叶绿素荧光参数。测定前暗适应20 min, 主要测定初始荧光(Fo)、最大荧光(Fm),计算最大光化学效率(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)[19-20]。
叶绿素含量的测定 准确称取新鲜叶片0.20 g, 用剪刀剪成1~2 mm的碎片,置于10 mL具刻度离心管中,加入体积比1:1的95%的乙醇和80%的丙酮混合液10 mL,使叶片完全浸入混合液中,加盖,遮光,过程中轻轻摇晃,直至观察到叶片完全变白即可。将色素提取液倒入口径1 cm的比色皿中,以体积比1:1的95%的乙醇和80%的丙酮混合液作为空白对照,在紫外分光光度计上测定在662 mm、644 mm和440 mm处的吸光值, 分别计算叶绿素a、叶绿素b和类胡萝卜素含量。
总黄酮含量的测定 总黄酮含量测定采用亚硝酸钠-硝酸铝法[21-22],以芦丁为标准品。称取2.00 g样品粉末,倒入150 mL的具塞锥形瓶中,加入95%的酒精20 mL,称重并记录。将锥形瓶放入Elma超声波清洗器中,超声提取2次,每次30 min,然后再用95%的乙醇补足损失量。摇匀过滤,取5 mL续滤液用95%的酒精定容至50 mL, 摇匀,得到待测样品溶液。精密吸取2 mL样品溶液,加入25 mL棕色容量瓶中并进行显色反应,待显色稳定后,用岛津UV-2450紫色分光光度计测定510 nm处的吸光值。最后根据标准曲线y=0.07598x+ 0.00231 (R2=0.99966)计算样品的总黄酮含量。
1.3 数据处理采用Excel 2007进行数据整理和作图,数据采用均值±标准差表示,并运用SPSS 18.0软件进行数据的方差分析以及Duncan多重比较。
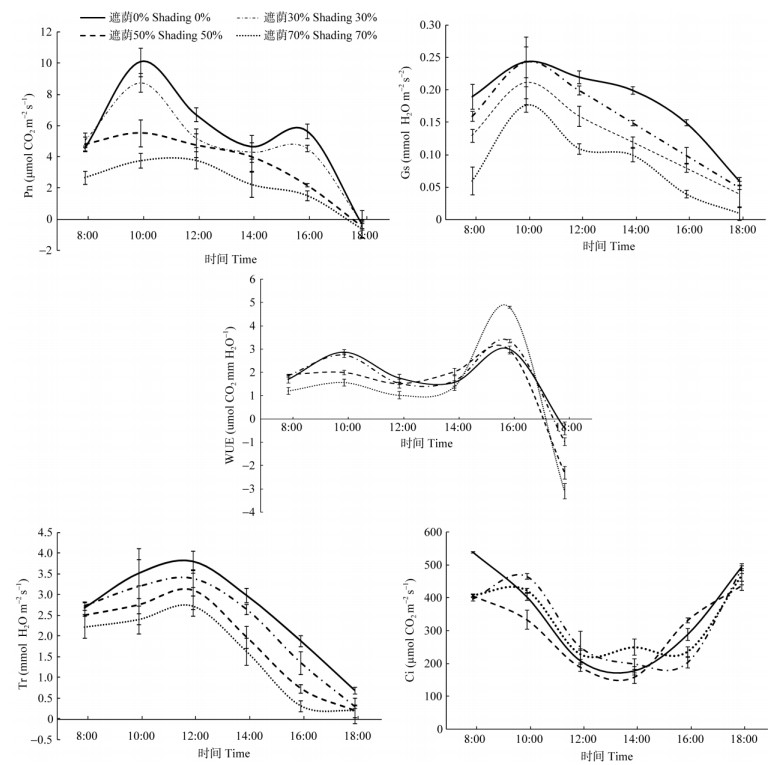
2 结果和分析 2.1 遮荫对光合特性的影响 2.1.1 净光合速率的日变化从图 1可见,遮荫处理对裸花紫珠净光合速率(Pn)日变化影响显著。在全光照和遮荫30%的情况下, Pn日变化曲线呈典型的双峰型,分别在10:00和16:00出现峰值,期间出现“午休”现象,在14:00时出现波谷。当遮荫达到50%以上时,Pn日变化曲线变成单峰型,未出现明显的“午休”现象。同时随着遮荫强度的增加,裸花紫珠Pn日均值逐渐降低,遮荫30%、50%和70%分别比全光照下降12.1%、33.7%和60.5%,且各处理间差异达到显著水平(P<0.05)(表 1)。
|
图 1 遮荫处理下裸花紫珠叶片的净光合速率(Pn)、气孔导度(Gs)、水分利用效率(WUE)、蒸腾速率(Tr)、胞间CO2浓度(Ci)日变化 Fig. 1 Diurnal changes in net photosynthetic rate (Pn), stomatal conductance (Gs), water use efficiency (WUE), transpiration rate (Tr), and intercellular CO2 concentration in the leaves of Callicarpa nudiflora under different shading treatments |
| 表 1 不同遮荫处理光合参数日平均值 Table 1 Daily mean of photosynthetic parameters of Callicarpa nudiflora under different treatments |
裸花紫珠叶片气孔导度(Gs)随着遮荫程度的增加而减小,各处理表现出相似的日变化趋势,8:00-10:00逐渐增加,并在10:00左右达到最大值,以后逐渐减小,并在18:00达到最小值(图 1)。由表 1也可以看出,各处理Gs日变化均值也是随着遮荫程度的增加逐渐减小,且各处理间的差异达到显著水平(P<0.05)。
各处理水分利用效率(WUE)的日变化曲线呈现出双峰型,分别在10:00和16:00达到峰值, 8:00-12:00的WUE以全光照>遮荫30%>遮荫50%>遮荫70%,而12:00-14:00则为遮荫50%>全光照>遮荫30%>遮荫70%;14:00-16:00为遮荫70%>遮荫50%、遮荫30%和全光照(图 1)。同时从表 1可见,WUE日平均值随着遮荫强度的增加呈现减小的趋势,且各处理间的差异显著(P<.05)。
2.1.3 蒸腾速率和胞间CO2浓度日变化由图 1可看出,遮荫比全光照下的蒸腾速率(Tr)明显降低,并随遮荫程度的增加逐渐降低。Tr日变化曲线呈明显的单峰型,各处理均在12:00达最高峰。全光照下日平均Tr为2.593 mmol H2O m-2s-1,遮荫30%、50%和70%分别比全光照下降了12.3%、27.3%和39.0%,且各处理间的差异达到显著水平(P<.05)(图 1)。
4种处理下,裸花紫珠叶片的胞间CO2浓度(Ci)日变化都呈现“V”型,8:00-14:00呈现下降趋势, 并在14:00左右达到最小值,14:00-18:00呈现上升趋势(图 1)。不同遮荫处理在不同时间段未表现出一致的规律性, 同时各处理Ci日平均值为遮荫0%>遮荫70%>遮荫30%>遮荫50%,但处理间的差异均未达到显著水平。
2.1.4 光合因子相关性分析为了分析不同遮荫处理下净光合速率的影响因子,对不同遮荫处理下Pn与Ci、Tr、Gs以及WUE进行相关性分析(表 2)。结果表明,在4种遮荫处理下,Gs和Tr都与Pn成显著正相关关系,在遮荫30%和50%下更呈极显著正相关关系;而Ci却与Pn间未表现出显著的相关性;WUE在全光照和遮荫30%下与Pn呈显著正相关,而当遮荫大于等于50%时,与Pn间未表现出显著相关性。
| 表 2 不同遮荫处理裸花紫珠光合参数之间的相关性分析 Table 2 Correlation analysis on photosynthetic parameters of Callicarpa nudiflora under different shading treatments |
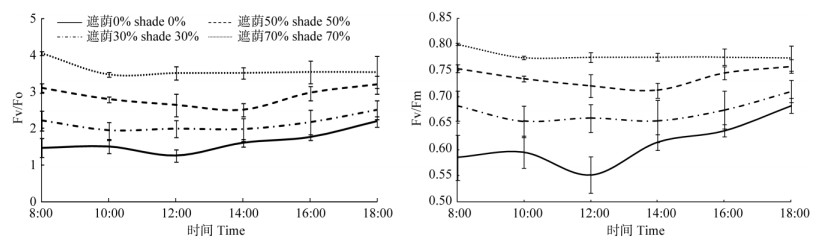
裸花紫珠的Fv/Fm和Fv/Fo日变化曲线呈“V”型,其中全光照在12:00时达到波谷,遮荫30%和50%在14:00时达到波谷,而遮荫70%在10:00时达到波谷,各遮荫处理的变化幅度要远小于全光照下(图 2)。由表 3可见,遮荫对裸花紫珠的Fv/Fm和Fv/Fo日变化均值具有显著影响(P<0.05),且随着遮荫程度的增加,Fv/Fm和Fv/Fo逐渐上升。
|
图 2 遮荫处理下裸花紫珠叶片的PSII最大光化学效率(Fv/Fm)和潜在光化学效率(Fv/Fo)日变化 Fig. 2 Diurnal changes in PSII maximum efficiency (Fv/Fm) and potential efficiency (Fv/Fo) in leaves of Callicarpa nudiflora under different shading treatments |
| 表 3 遮荫处理叶绿素荧光参数日平均值 Table 3 Daily average of chlorophyll fluorescence parameters in leaves of Callicarpa nudiflora under different treatments |
由表 4可见,随着遮荫程度的增加,裸花紫珠叶片中的Chl a、Chl b、Chl a+b及Car含量均显著增加,其中遮荫30%、50%和70%的Chl a+b分别比全光照下的高12.0%、21.0%和191.5%。同时, 遮荫70%下的Chl a/b和Car/Chl要显著低于其余处理,其余处理的Chl a/b和Car/Chl之间无显著差异。
| 表 4 遮荫对裸花紫珠叶绿素a、叶绿素b、类胡萝卜素含量的影响 Table 4 Effect of shading on contents of chlorophyll a (Chl a), chlorophyll b (Chl b) and carotenoid (Car) in leaves of Callicarpa nudiflora |
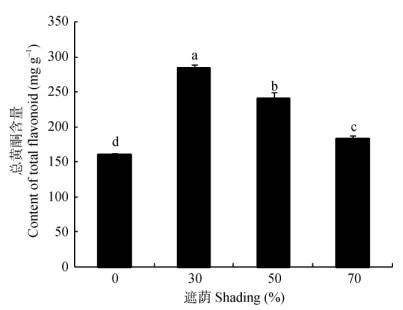
遮荫处理显著提高了裸花紫珠叶片中总黄酮的含量(P<0.05),且随着遮荫程度的增加呈现先上升后下降的趋势,以在遮荫30%时达到最大值,为283.96 mg g-1, 分别是遮荫0%、50%和70%处理下的1.76、1.18和1.56倍(图 3)。
|
图 3 遮荫对裸花紫珠叶片中总黄酮含量的影响 Fig. 3 Effects of different shade levels on total flavonoid content in the leaves of Callicarpa nudiflora |
光照强度是影响植物光合作用的主导生态因子[23]。遮荫处理能够改变植物叶片所接收到的光照强度以及温度、湿度,进而影响植物的光合进程[24]。本研究结果表明,遮荫处理显著影响裸花紫珠的净光合速率,且净光合速率随着遮荫程度的加深而减小。全光照和遮荫30%下裸花紫珠在中午会出现“午休”现象,同时伴随Ci呈现下降趋势,因此可能是气孔因素引起的。中午温度过高,叶片蒸腾速率过大,导致水分散失过多,水分利用效率下降,植物为了保持水分,关闭气孔,导致Ci降低,光合速率下降。当遮荫程度继续加大时,裸花紫珠的日变化曲线,由双峰型转变成了单峰型,此时主要是由于遮荫导致叶面温度降低,蒸腾速率下降,水分散失不再成为正午影响光合速率的主导因素,因此气孔导度会增大,光合速率增加,午休现象消失, 呈现单峰型。这与杨俊霞等[25]对美国黑莓(Rubus subgenus)和肖润林等[24]对茶树(Camellia sinensis)的研究结果相似。
叶绿素荧光技术是快速、灵敏、无损伤检测植物逆境胁迫的探针[26-27]。Fv/Fm是PSⅡ潜在光化学活性的度量,反映了PSⅡ反应中心的光能转换效率,它的下降是光合作用对光强适应的结果,Fv/Fo则反映了PSⅡ的潜在活性[28]。本研究结果表明, Fv/Fm、Fv/Fo随着遮荫程度加大逐渐呈现“V”型曲线,这与孙悦秋等[29]对异株荨麻(Urtica dioica)和王建华等[30]对连翘(Forsythia suspensa)的研究结果是一致的。这主要是早晨和傍晚阶段,光照较弱,植物叶片所捕获的光能大部分用于光化学反应,因此效率高;而在中午时分,植物叶片虽然吸收到的光能远大于早晚,但是大部分用于热耗散,因此出现光化学效率下降的现象。但是因为捕捉的光能基数很大,用于光化学的绝对光能要大于早晚,所以光化学反应速度最大。随着遮荫程度的增加,Fv/Fm、Fv/Fo呈现上升趋势,这是植物对于弱光环境的一种适应机制。此外前人研究发现非胁迫状态下Fv/Fm变化较小,不受物种和生长条件的影响,一般为0.75~0.85[31]。本研究表明,在全光照和遮荫30%下Fv/Fm小于0.75,表明受到了强光胁迫,发生了光抑制。光抑制主要分为两种情况,一种是不可逆的,引起光抑制的因素消除后,植物的光合功能恢复很慢、甚至不能修复,这种光抑制产生的原因是光合作用的PSII反应中心受到破坏,相关蛋白质发生破坏,降低了量子效率和光合速率。另外一种光抑制是可逆的,当光抑制因素消失后,植物的光合功能能够迅速恢复,这种主要是由于适度过量的光照引起碳同化量子效率下降。它的发生是由于吸收光的能量以热能的形式散失,导致量子效率的下降[32-33]。本研究中,发生的光抑制应属于第二类,未发生机构性破坏,是植物对于外界强光环境的一种适应机制。
光合色素在光合作用中起着吸收光能、传递光能的作用。遮荫条件下植物可以通过增加单位面积的色素含量来获得更多的光能[34]。本研究发现遮荫条件下裸花紫珠的Chl a、Chl b、Car均显著增加, 并随着遮荫强度的增加逐渐增加,表明光合色素含量的增加有助于植物适应弱光环境。其中Chl a/b呈现下降趋势,说明在光照条件减弱的情况下,植物会增加Chl b的合成。Chl b含量的增加能够吸收漫射光中短波长蓝紫光,从而有助于植物捕获更多的光能用于植物光合生长[35]。而Car/Chl比值随着遮荫程度的减小而增大,这与Huang等[36]对遮荫下苎麻属(Boehmeria)植物的研究结果一致。Car不仅具有吸收光能还有猝灭过剩光能的作用,强光下, Car相对含量的增加,表明植物能够通过Car猝灭过剩光能以保护植物不受强光伤害。弱光下,Chl相对含量增加,表明主要需要捕获更多的光能来满足生长。
药用植物的药用价值来源于植株体内的活性物质,多为一些次生代谢产物。次生代谢产物在植物体内的合成和积累是受一定环境条件诱导作用的结果,其合成途径分布在植物不同的器官、组织和细胞内,受发育进程的调控[37-38]。黄酮类化合物是植物体内一种重要的次生代谢产物,在植物的生长、发育、开花、结果以及抗菌防病等方面起着重要的作用[39]。有研究发现银杏(Ginko biloba)叶总黄酮含量和代谢过程中关键酶基因表达量存在着显著的相关性,并且具有明显的温度效应和温度、光强交互响应,光照和温度可以在转录水平上调节关键酶基因的表达,从而影响黄酮代谢[40]。前人的一些研究表明,光照条件能够显著影响植物体内黄酮化合物的合成,马兰(Kalimeris indica)和青钱柳叶片中黄酮类化合物含量随着光照强度的增加逐渐增加[10, 41]。但也有研究表明,一定程度的遮荫有助于黄酮类化合物的形成。朱肖锋等[42]对马蹄金(Dichondra repens)的研究表明,76.19%的透光率有利于马蹄金的生长并能提高马蹄金叶中总黄酮的含量。王华田等[43]对银杏叶片的研究表明,随着光照强度的增加,黄酮含量先增加后减小,在光照强度为42%时,含量达到最高值。本研究发现裸花紫珠叶片中总黄酮的含量更符合后者的观点,随着光照强度的增加而呈现先增加后减小的规律,并在遮荫30%时达到最大值。
从光合特性的变化规律来看,苗期裸花紫珠适宜全光照条件下生长,遮荫会降低裸花紫珠的光合速率,进而影响生长。但是其叶片内黄酮类化合物的最佳合成条件是遮荫30%,这二者是相互矛盾的,这也是药材生产上常遇到的产量与质量之间的矛盾关系。前人也遇到过类似问题,有研究表明马齿苋(Portulaca oleracea)随光强的增大,产量逐渐增加,而总黄酮含量却逐渐减小[44]。孙视等[45]研究银杏叶黄酮的积累条件也表明,黄酮含量最高的环境条件并非银杏最适宜的生长环境条件,他认为从药用植物栽培的角度来看,选择具有一定环境压力的次适宜生态环境是兼顾一些药用植物栽培生长和次生产物积累的平衡之法。因此对于本研究来说, 如果从药材质量的角度考虑,选择遮荫30%条件为佳。后期可以继续从裸花紫珠的药材产量与质量之间的关系来继续深入研究,找寻单株植物黄酮积累量的最大值下的光照条件。
| [1] | Benvenuti S, Macchia M, Stefani A. Effects of shade on reproduction and some morphological characteristics of Abutilon theophrasti Medicos, Datura stramonium L. Sorghum halepense L. Pers[J]. Weed Res, 1994, 34(4): 283-288. DOI:10.1111/j.1365-3180.1994.tb01996.x |
| [2] | DENG Y M, SHAO Q S, LI C C, et al. Differential responses of double petal and multi petal jasmine to shading:Ⅱ. Morphology, anatomy and physiology[J]. Sci Hort, 2012, 144: 19-28. DOI:10.1016/j.scienta.2012.06.031 |
| [3] |
CHAI S F, ZHUANG X Y, WEI X, et al. Effects of light intensity on photosynthesis and physiological characteristics in seedlings of Camellia pubipetala[J].
Acta Bot Boreali-Occid Sin, 2013, 33(3): 547-554. 柴胜丰, 庄雪影, 韦霄, 等. 光照强度对濒危植物毛瓣金花茶光合生理特性的影响[J]. 西北植物学报, 2013, 33(3): 547-554. DOI:10.3969/j.issn.1000-4025.2013.03.018 |
| [4] | FAVARETTO V F, MARTINEZ C A, SORIANI H H, et al. Differential responses of antioxidant enzymes in pioneer and late-successional tropical tree species grown under sun and shade conditions[J]. Environ Exp Bot, 2011, 70(1): 20-28. DOI:10.1016/j.envexpbot.2010.06.003 |
| [5] |
SONG Y, LIAO L, LIU T, et al. Response of photosynthesis and nitrogen distribution of Torreya grandis 'Merrilli' seedlings in different light regimes[J].
Sci Silv Sin, 2016, 52(5): 55-63. 宋洋, 廖亮, 刘涛, 等. 不同遮荫水平下香榧苗期光合作用及氮分配的响应机制[J]. 林业科学, 2016, 52(5): 55-63. DOI:10.11707/j.1001-7488.20160507 |
| [6] | OSUNKOYA O O, ASH J E, HOPKINS M S, et al. Influence of seed size and seedling ecological attributes on shade-tolerance of rain-forest tree species in northern Queensland[J]. J Ecol, 1994, 82(1): 149-163. DOI:10.2307/2261394 |
| [7] |
WU G L, CHEN M, DU G Z. Effects of nutrient and light on seedlings morphological plasticity of four Saussurea species with different ecological breadth[J].
Chin J Appl Ecol, 2008, 19(8): 1708-1713. 武高林, 陈敏, 杜国祯. 营养和光照对不同生态幅风毛菊属植物幼苗形态可塑性的影响[J]. 应用生态学报, 2008, 19(8): 1708-1713. |
| [8] |
YAN X L, WANG D L. Effects of shading on the leaves and photosynthetic characteristics of Ligustrum robustum[J].
Acta Ecol Sin, 2014, 34(13): 3538-3547. 闫小莉, 王德炉. 遮荫对苦丁茶树叶片特征及光合特性的影响[J]. 生态学报, 2014, 34(13): 3538-3547. DOI:10.5846/stxb201306241761 |
| [9] |
ZHENG J, WU C H, CHEN Q X, et al. Influence of shading on growth and physiology of Dalbergia odorifera seedlings[J].
Sci Silv Sin, 2016, 52(12): 50-57. 郑坚, 吴朝辉, 陈秋夏, 等. 遮荫对降香黄檀幼苗生长和生理的影响[J]. 林业科学, 2016, 52(12): 50-57. DOI:10.11707/j.1001-7488.20161206 |
| [10] | DENG B, SHANG X L, FANG S Z, et al. Integrated effects of light intensity and fertilization on growth and flavonoid accumulation in Cyclocarya paliurus[J]. J Agric Food Chem, 2012, 60(25): 6286-6292. DOI:10.1021/jf301525s |
| [11] |
Editorial Committee of flora.
Flora of China, Vol. 65[M]. Beijing: Science Press, 1982: 37-38.
中国科学院植物志编辑委员会. 中国植物志, 第65卷[M]. 北京: 科学出版社, 1982: 37-38. |
| [12] |
WANG Z N, HAN Z, CUI H B, et al. Chemical constituents from Callicarpa nudiflora[J].
J Trop Subtrop Bot, 2007, 15(4): 359-362. 王祝年, 韩壮, 崔海滨, 等. 裸花紫珠的化学成分[J]. 热带亚热带植物学报, 2007, 15(4): 359-362. DOI:10.3969/j.issn.1005-3395.2007.04.014 |
| [13] |
ZHANG Q L, PANG Y X, YANG Q, et al. Herbal textual research of Callicarpa nudiflora[J].
J Guangdong Pharm Univ, 2014, 30(5): 667-671. 张绮玲, 庞玉新, 杨全, 等. 裸花紫珠的本草考证[J]. 广东药学院学报, 2014, 30(5): 667-671. DOI:10.3969/j.issn.1006-8783.2014.05.032 |
| [14] | LIANG J J, QI J L, LI L, et al. Flavonoids from Callicarpa nudiflora leaves[J]. Chem Nat Comp, 2011, 47(1): 110-111. DOI:10.1007/s10600-011-9846-z |
| [15] | HUANG B, FU H Z, CHEN W K, et al. Hepatoprotective triterpenoid saponins from Callicarpa nudiflora[J]. Chem Pharm Bull, 2014, 62(7): 695-699. DOI:10.1248/cpb.c14-00159 |
| [16] |
ZHENG D K, CHEN W K, MA S C, et al. Study on HPLC fingerprint of Callicarpa nudiflora and determination of ten components[J].
China J Chin Mat Med, 2015, 40(9): 1776-1782. 郑东昆, 陈伟康, 马双成, 等. 裸花紫珠指纹图谱研究及10种成分的含量测定[J]. 中国中药杂志, 2015, 40(9): 1776-1782. DOI:10.4268/cjcmm20150928 |
| [17] |
ZHANG L, JIANG D Q, WENG C Y, et al. Study on the cutting technology of Callicarpa nudiflora, a medical plant used by the li people in Hainan[J].
Chin Agric Sci Bull, 2013, 29(13): 197-200. 张浪, 姜殿强, 翁春雨, 等. 海南黎药裸花紫株扦插育苗技术研究[J]. 中国农学通报, 2013, 29(13): 197-200. DOI:10.11924/j.issn.1000-6850.2012-3375 |
| [18] |
ZHOU Z Z, LIU S C, ZHANG J H, et al. Effects of IBA treatment on adventitious rooting and endogenous hormones contents of shoot cuttings of Callicarpa nudiflora[J].
Chin J Trop Crops, 2016, 37(6): 1075-1080. 周再知, 刘式超, 张金浩, 等. 外源IBA对裸花紫珠扦插生根和内源激素含量变化的影响[J]. 热带作物学报, 2016, 37(6): 1075-1080. DOI:10.3969/j.issn.1000-2561.2016.06.004 |
| [19] | GENTY B, BRIANTAIS J M, BAKER N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochim Biophys Acta, 1989, 990(1): 87-92. DOI:10.1016/S0304-4165(89)80016-9 |
| [20] | BILGER W, BJ RKMAN O. Role of the xanthophyll cycle in photoprotection elucidated by measurements of light-induced absor-bance changes, fluorescence and photosynthesis in leaves of Hedera canariensis[J]. Photosynth Res, 1990, 25(3): 173-185. DOI:10.1007/BF00033159 |
| [21] |
WU X M, YIN B Z. Determination of flavone from Ginkgo biloba leaves[J].
Chin J Pharm Anal, 2001, 21(2): 138-141. 吴晓明, 殷斌志. 银杏叶黄酮类化合物的测定方法[J]. 药物分析杂志, 2001, 21(2): 138-141. |
| [22] | VOLPI N, BERGONZINI G. Analysis of flavonoids from propolis by on-line HPLC-electrospray mass spectrometry[J]. J Pharm Biomed Anal, 2006, 42(3): 354-361. DOI:10.1016/j.jpba.2006.04.017 |
| [23] |
ZHAO S, HUANG Q X, LI Y L, et al. Effects of shading treatments on photosynthetic characteristics of Juniperus sabina Ant. seedlings[J].
Acta Ecol Sin, 2014, 34(8): 1994-2002. 赵顺, 黄秋娴, 李玉灵, 等. 遮荫处理对臭柏幼苗光合特性的影响[J]. 生态学报, 2014, 34(8): 1994-2002. DOI:10.5846/stxb201306101606 |
| [24] |
XIAO R L, WANG J R, SHAN W X, et al. Tea plantation environment and quality under different degrees of shading[J].
Chin J Eco-Agric, 2007, 15(6): 6-11. 肖润林, 王久荣, 单武雄, 等. 不同遮荫水平对茶树光合环境及茶叶品质的影响[J]. 中国生态农业学报, 2007, 15(6): 6-11. |
| [25] |
YANG J X, GUO B L, LU R Q, et al. The effect of shading on the growth and photosynthesis characteristics in American blackberry[J].
Acta Hort Sin, 2005, 32(2): 292-294. 杨俊霞, 郭宝林, 鲁韧强, 等. 遮荫对美国黑莓生长及光合特性的影响[J]. 园艺学报, 2005, 32(2): 292-294. DOI:10.3321/j.issn:0513-353X.2005.02.020 |
| [26] | MAXWELL K, JOHNSON G N. Chlorophyll fluorescence:A practical guide[J]. J Exp Bot, 2000, 51(345): 659-668. DOI:10.1093/jxb/51.345.659 |
| [27] | BAKER N R. Chlorophyll fluorescence:A probe of photosynthesis in vivo[J]. Annu Rev Plant Biol, 2008, 59: 89-113. DOI:10.1146/annurev.arplant.59.032607.092759 |
| [28] | TRUEMAN S J, RICHARDSON D M. Propagation and chlorophyll fluorescence of Camptotheca acuminata cuttings[J]. J Med Plants Res, 2011, 5(1): 1-6. DOI:10.3923/rjmp.2011.1.20 |
| [29] |
LIU Y Q, SUN X Y, WANG Y, et al. Effects of shades on the photo-synthetic characteristics and chlorophyll fluorescence parameters of Urtica dioica[J].
Acta Ecol Sin, 2007, 27(8): 3457-3464. 刘悦秋, 孙向阳, 王勇, 等. 遮荫对异株荨麻光合特性和荧光参数的影响[J]. 生态学报, 2007, 27(8): 3457-3464. DOI:10.3321/j.issn:1000-0933.2007.08.044 |
| [30] |
WANG J H, REN S F, SHI B S, et al. Effects of shades on the photosynthetic characteristics and chlorophyll fluorescence parameters of Forsythia suspense[J].
Acta Ecol Sin, 2011, 31(7): 1811-1817. 王建华, 任士福, 史宝胜, 等. 遮荫对连翘光合特性和叶绿素荧光参数的影响[J]. 生态学报, 2011, 31(7): 1811-1817. |
| [31] |
WEN G S, TIAN H T, ZHANG M R, et al. Application of chlorophyll fluorescence analysis in forest tree cultivation[J].
Chin J Appl Ecol, 2006, 17(10): 1973-1977. 温国胜, 田海涛, 张明如, 等. 叶绿素荧光分析技术在林木培育中的应用[J]. 应用生态学报, 2006, 17(10): 1973-1977. DOI:10.3321/j.issn:1001-9332.2006.10.038 |
| [32] |
XU D Q, ZHANG Y Z, ZHANG R X. Photoinhibition of photo-synthesis in plants[J].
Plant Physiol Commun, 1992, 28(4): 237-243. 许大全, 张玉忠, 张荣铣. 植物光合作用的光抑制[J]. 植物生理学通讯, 1992, 28(4): 237-243. |
| [33] |
JIA H S, LI D Q, HAN Y Q. Advances in studies on photoinhibition in photosynthesis of higher plants[J].
Chin Bull Bot, 2000, 17(3): 218-224. 贾虎森, 李德全, 韩亚琴. 高等植物光合作用的光抑制研究进展[J]. 植物学报, 2000, 17(3): 218-224. DOI:10.3969/j.issn.1674-3466.2000.03.004 |
| [34] | WITTMANN C, ASCHAN G, PFANZ H. Leaf and twig photosynthesis of young beech (Fagus sylvatica) and aspen (Populus tremula) trees grown under different light regime[J]. Bas Appl Ecol, 2001, 2(2): 145-154. DOI:10.1078/1439-1791-00047 |
| [35] | DAI Y J, SHEN Z G, LIU Y, et al. Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence, and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J]. Environ Exp Bot, 2009, 65(2/3): 177-182. DOI:10.1016/j.envexpbot.2008.12.008 |
| [36] | HUANG C J, WEI G, JIE Y C, et al. Effect of shade on plant traits, gas exchange and chlorophyll content in four ramie cultivars[J]. Photo-synthetica, 2016, 54(3): 390-395. DOI:10.1007/s11099-016-0186-x |
| [37] | CORTELL J M, KENNEDY J A. Effect of shading on accumulation of flavonoid compounds in (Vitis vinifera L.) pinot noir fruit and extraction in a model system[J]. J Agric Food Chem, 2006, 54(22): 8510-8520. DOI:10.1021/jf0616560 |
| [38] |
SU W H, ZHANG G F, LI X H, et al. Relationship between accumu-lation of secondary metabolism in medicinal plant and environmental condition[J].
Chin Trad Herb Drugs, 2005, 36(9): 1415-1418. 苏文华, 张光飞, 李秀华, 等. 植物药材次生代谢产物的积累与环境的关系[J]. 中草药, 2005, 36(9): 1415-1418. DOI:10.3321/j.issn:0253-2670.2005.09.052 |
| [39] | CUSHNIE T P T, LAMB A J. Antimicrobial activity of flavonoids[J]. Int J Antimicrob Agents, 2005, 26(5): 343-356. DOI:10.1016/j.ijantimicag.2005.09.002 |
| [40] |
XU Y, WANG H L, WANG G B, et al. Effects of temperature and light intensity on flavonoid biosynthesis of ginkgo (Ginkgo biloba L.) leaves[J].
J CS Univ For Technol, 2016, 36(4): 30-34. 徐友, 王欢利, 汪贵斌, 等. 温度和光照强度对银杏叶黄酮合成的影响[J]. 中南林业科技大学学报, 2016, 36(4): 30-34. DOI:10.14067/j.cnki.1673-923x.2016.04.006 |
| [41] |
LI Z L, GUO K X, ZHOU S B, et al. Effects of light intensity on biological characteristics, physiological indexes and flavone content of Kalimeris indica[J].
Acta Pratacult Sin, 2014, 23(4): 162-170. 李中林, 郭开秀, 周守标, 等. 光强对马兰形态、生理及黄酮类化合物含量的影响[J]. 草业学报, 2014, 23(4): 162-170. DOI:10.11686/cyxb20140420 |
| [42] |
ZHU X F, ZHOU S B, YANG J H, et al. Effects on leaf characteristics and total flavone content of Dichondra repens under different light intensity[J].
Acta Laser Biol Sin, 2009, 18(1): 62-66. 朱肖锋, 周守标, 杨集辉, 等. 不同光照强度对马蹄金叶的特征及总黄酮含量的影响[J]. 激光生物学报, 2009, 18(1): 62-66. DOI:10.3969/j.issn.1007-7146.2009.01.012 |
| [43] |
WANG H T, XIE B D, JIANG Y Z, et al. Effect of solar irradiation intensity on leaf development and flavonoid and terpene content in Ginkgo biloba leaves[J].
Acta Agric Univ Jiangxi (Nat Sci), 2002, 24(5): 617-622. 王华田, 谢宝东, 姜岳忠, 等. 光照强度对银杏叶片发育及黄酮和内酯含量的影响[J]. 江西农业大学学报(自然科学版), 2002, 24(5): 617-622. DOI:10.3969/j.issn.1000-2286.2002.05.013 |
| [44] |
WU Y Y, LIU Y H, LI Z, et al. Dynamic variety study on the biomass and nutrients of Poaulaca oleracea L. in different illumination intensities[J].
Sci Technol Food Ind, 2008, 29(6): 102-103, 106. 吴爰爰, 刘迎辉, 李震, 等. 马齿苋在不同光照强度下生物量及营养成分的动态变化研究[J]. 食品工业科技, 2008, 29(6): 102-103, 106. |
| [45] |
SUN S, LIU W G, PAN F S, et al. The effect of ecological conditions on flavonoid accumulation in Ginkgo biloba leaves[J].
J Plant Resour Environ, 1998, 7(3): 1-7. 孙视, 刘晚苟, 潘福生, 等. 生态条件对银杏叶黄酮积累的影响[J]. 植物资源与环境学报, 1998, 7(3): 1-7. |
 2017, Vol. 25
2017, Vol. 25



