升振山姜(Alpinia hainanensis ‘Shengzhen')是由中国科学院已故高级工程师陈升振先生于20世纪80年代利用姜科药食两用山姜属植物草豆蔻(Alpinia katsumadai Hayata.)和小草蔻(A. henryi K. Schumann)杂交所得,为了纪念他的突出贡献,将其命名为升振山姜[1]。目前,仅在中国科学院华南植物园有栽培。升振山姜的植株高、花序长、花期长,因此具有很高的观赏价值[1-2]。至今尚无该植物的化学成分报道,前人研究多集中在亲本草豆蔻的化学成分及药用价值方面,亲本草豆蔻的主要化学成分为黄酮和二苯基庚烷等[3],其药用作用研究主要包括抗氧化、抗菌、抗炎以及抗肿瘤等[4-5]。为深入了解升振山姜茎的主要化学成分,挖掘其资源利用潜力,我们对其茎化学成分进行了研究,从中分离鉴定了10个黄酮化合物,并采用体外ABTS、DPPH自由基清除法测试了这些化合物的抗氧化活性。本文报道这些黄酮化合物的提取分离方法、结构鉴定以及体外抗氧化活性。
1 材料和方法 1.1 材料升振山姜(Alpinia hainanensis ‘Shengzhen')茎于2015年5月采自中国科学院华南植物园姜园, 由本园叶育石鉴定,切片晾干后粉碎备用。
1.2 仪器和试剂柱色谱正相硅胶(100~200目)为青岛海洋化工厂生产;柱层析凝胶(Sephadex LH-20) 为瑞士Amersham Biosciences公司生产;薄层层析硅胶板(HSGF254, 0.2 mm)为烟台黄务硅胶开发试验厂生产。
分析用HPLC仪器为日本岛津公司LC-20A型液相色谱仪;MPLC采用上海利穗科技有限公司的Dr Flash-S分离纯化系统,色谱柱为Chromatoxex®ODS(C18, MB 100 40~75 µm, Fuji, 日本);ESIMS采用美国应用生物系统公司MDS SCIEX APCI 2000 LS-MS-MS,以甲醇为溶剂,直接进样测定; 1H NMR和13C NMR谱采用Bruker Avance Ⅲ核磁共振仪,以TMS为内标;比旋光度用Perkin-Elmer 341旋光仪测定。
抗氧化活性测试所用阳性对照l-抗坏血酸(l-Ascorbic acid)为上海伯奥生物科技有限公司产品, DPPH (1, 1-二苯基-2-硝基苯肼)和ABTS [2, 2′-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)]购自Sigma公司; PBS (pH=7.4) 购自上海立菲生物技术有限公司;分析纯过硫酸钾、DMSO和MeOH购自天津富宇精细化工有限公司。酶标仪(Tecan infinite M200 PRO)为瑞士生产。
1.3 提取和分离升振山姜茎干粉10.0 kg,用95%乙醇室温浸泡提取3次,每次24 h。乙醇提取液经过减压浓缩后依次用石油醚、氯仿和乙酸乙酯萃取3~4次,合并浓缩得到各部分萃取物。
石油醚部分(89.98 g)经硅胶柱层析,氯仿-甲醇[100:0~50:50, (V/V, 下同)]梯度洗脱,收集各流份后以TLC检查合并, 得到Fr.P1~Fr.P22。Fr.P10经过正相硅胶柱氯仿-甲醇(100:0~80:20) 梯度洗脱得到Fr.P10-1~Fr.P10-7,其中Fr.P10-2经HPLC纯化(55%乙腈-水为流动相,流速为5 mL min-1),得到化合物4 (8 mg, tR=120 min)。Fr.P12经过MPLC分离,用甲醇-水(40:60~80:20),梯度洗脱得到Fr.P12-1~Fr.P12-40,其中Fr.P12-19和Fr. P12-30析出沉淀,用甲醇洗涤得到化合物2 (500 mg)和5 (400 mg),Fr.P12-23经过HPLC纯化(55%甲醇-水为流动相,流速为5 mL min-1),得到化合物1 (400 mg, tR=60 min)。
氯仿可溶部分(82.26 g)经正相硅胶柱层析,氯仿-甲醇(100:0~50:50) 梯度洗脱,每份收集1 L, 经TLC检查合并得到Fr.C1~Fr.C8。其中Fr.C1经过MPLC分离,用甲醇-水(40:60~80:20) 梯度洗脱,经TLC检查合并得到Fr.C1-1~Fr.C1-21。Fr.C1-11经HPLC纯化(33%乙腈-水为流动相,流速为5 mL min-1),得到化合物6 (5 mg, tR=90 min)。Fr.C3用甲醇清洗沉淀得到化合物3 (150 mg)。
取乙酸乙酯部分(56.76 g)粗样10 g,经过MPLC分离,甲醇-水(20:80~40:60) 梯度洗脱,经TLC检查合并得到Fr.E1~Fr.E18。Fr.E3经HPLC纯化(13%乙腈-水,流速为5 mL min-1),得到化合物7 (35 mg, tR=35 min)。Fr.E8经HPLC纯化(14%乙腈-水为流动相,流速为5 mL min-1),分别得到化合物8 (3 mg, tR=40 min)、9 (5 mg, tR=76 min)和10 (4 mg, tR=86 min)。
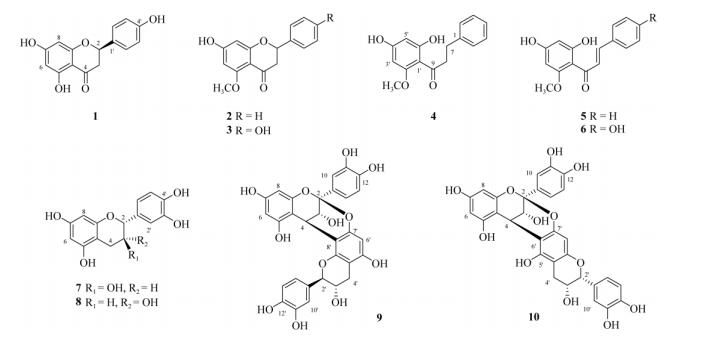
1.4 结构鉴定化合物1 无色针状结晶,分子式C15H12O4; [α]D20–166 (c 0.90, MeOH); ESIMS m/z: 257 [M + H]+, 279 [M + Na]+, 295 [M + K]+, 535 [2M + Na]+, 551 [2M + K]+, 255 [M-H]-, 511 [2M-H]-。1H NMR (DMSO-d6, 500 MHz): δ 5.59 (1H, dd, J = 12.6, 3.1 Hz, H-2), 2.78 (1H, dd, J = 12.6, 3.1 Hz, H-3α), 3.25 (1H, dd, J = 17.1, 12.6 Hz, H-3β), 5.89 (1H, d, J = 2.1 Hz, H-6), 5.92 (1H, d, J = 2.1 Hz, H-8), 7.36~ 7.56 (5H, m, ArH); 13C NMR (DMSO-d6, 125 MHz): δ 78.8 (C-2), 42.6 (C-3), 196.2 (C-4), 164.0 (C-5), 95.6 (C-6), 167.7 (C-7), 96.5 (C-8), 102.1 (C-4a), 163.2 (C-8a), 139.2 (C-1′), 127.1 (C-2′, 6′), 129.0 (C-3′, 5′), 129.0 (C-4′)。以上数据与文献[6]报道的平面结构一致,测得的旋光值为负,鉴定该化合物为(-)-乔松素。
化合物2 无色针状结晶,分子式C16H14O5; [α]D20±0 (c 0.18, MeOH); ESIMS m/z: 270 [M + H]+, 293 [M + Na]+, 541 [2M + H]+, 563 [2M + Na]+, 269 [M-H]-, 539 [2M-H]-。1H NMR (DMSO-d6, 500 MHz): δ 5.48 (1H, dd, J = 12.4, 3.1 Hz, H-2), 2.63 (1H, dd, J = 16.4, 3.1 Hz, H-3α), 2.98 (1H, dd, J = 16.4, 12.4 Hz, H-3β), 6.02 (1H, d, J = 2.2 Hz, H-6), 6.08 (1H, d, J = 2.2 Hz, H-8), 7.33~7.56 (5H, m, ArH), 3.74 (3H, s, H-5-OMe); 13C NMR (DMSO-d6, 125 MHz): δ 78.5 (C-2), 45.3 (C-3), 187.9 (C-4), 164.5 (C-5), 96.1 (C-6), 164.8 (C-7), 93.8 (C-8), 105.0 (C-4a), 162.7 (C-8a), 139.6 (C-1′), 126.9 (C-2′, 6′), 129.0 (C-3′, 5′), 128.8 (C-4′), 56.1 (C-5-OMe)。以上数据与文献[6]报道一致,其旋光值为0,说明其为一对对映异构体,鉴定该化合物为(±)-山姜素。
|
图 1 化合物1~10的结构 Fig. 1 Structures of compounds 1–10 |
化合物3 黄色针状结晶,分子式C16H14O5; [α]D20±0 (c 0.28, MeOH); ESIMS m/z: 287 [M + H]+, 309 [M + Na]+, 325 [M + K]+, 595 [2M + Na]+, 611 [2M + K]+, 285 [M-H]-, 571 [2M-H]-。1H NMR (DMSO-d6, 500 MHz): δ 5.34 (1H, dd, J = 12.6, 2.9 Hz, H-2), 2.54 (1H, dd, J = 16.4, 2.9 Hz, H-3α), 2.99 (1H, dd, J = 16.4, 12.6 Hz, H-3β), 5.95 (1H, d, J = 2.1 Hz, H-6), 6.06 (1H, d, J = 2.1 Hz, H-8), 7.29 (2H, d, J = 2.0 Hz, H-2′, 6′), 6.78 (2H, d, J = 2.0 Hz, H-3′, 5′), 3.74 (3H, s, H-5-OMe); 13C NMR (DMSO-d6, 125 MHz): δ 78.5 (C-2), 45.2 (C-3), 188.2 (C-4), 164.1 (C-5), 93.7 (C-6), 164.8 (C-7), 96.1 (C-8), 104.9 (C-4a), 162.7 (C-8a), 129.8 (C-1′), 128.5 (C-2′, 6′), 115.6 (C-3′, 5′), 158.0 (C-4′), 56.1 (C-5-OMe)。以上数据与文献[7]报道一致,由于旋光值为0,鉴定该化合物为(±)-7, 4′-二羟基-5-甲氧基二氢黄酮。
化合物4 黄色针状结晶,分子式C16H16O4; ESIMS m/z: 273 [M + H]+, 295 [M + Na]+, 311 [M + K]+, 567 [2M + Na]+, 583 [2M + K]+, 271 [M-H]-, 543 [2M-H]-。1H NMR (DMSO-d6, 500 MHz): δ 7.16~7.30 (5H, m, ArH), 2.88 (2H, m, H-7), 3.23 (2H, d, J = 8.4, 7.0 Hz, H-8), 5.96 (1H, d, J = 2.1 Hz, H-3′), 5.88 (1H, d, J = 2.1 Hz, H-5′), 3.81 (3H, s, H-2′-OMe); 13C NMR (DMSO-d6, 125 MHz): δ 141.7 (C-1), 128.4 (C-2, 6), 128.5 (C-3, 5), 126.0 (C-4), 30.7 (C-7), 45.7 (C-8), 205.6 (C-9), 105.8 (C-1′), 163.5 (C-2′), 96.6 (C-3′), 167.3 (C-4′), 90.8 (C-5′), 162.6 (C-6′), 55.7 (C-2′-OMe)。以上数据与文献[8]报道一致,鉴定该化合物为4′, 6′-二羟基-2′-甲氧基二氢查尔酮。
化合物5 黄色针状结晶,分子式C16H14O4; ESIMS m/z: 271 [M + H]+, 293 [M + Na]+, 309 [M + K]+, 563 [2M + Na]+, 579 [2M + K]+, 269 [M-H]-, 539 [2M-H]-。1H NMR (DMSO-d6, 500 MHz): δ 7.42~7.70 (5H, m, ArH), 7.83 (1H, d, J = 15.7 Hz, H-7), 7.66 (1H, d, J = 15.7 Hz, H-8), 5.94 (1H, d, J = 2.1 Hz, H-3′), 6.03 (1H, d, J = 2.1 Hz, H-5′), 3.89 (3H, s, H-2′-OMe); 13C NMR (DMSO-d6, 125 MHz): δ 135.4 (C-1), 128.9 (C-2, 6), 119.5 (C-3, 5), 130.8 (C-4), 128.8 (C-7), 142.3 (C-8), 192.2 (C-9), 105.6 (C-1′), 163.2 (C-2′), 96.3 (C-3′), 165.5 (C-4′), 92.2 (C-5′), 166.7 (C-6′), 56.5 (C-2′-OMe)。以上数据与文献[7]报道一致,鉴定该化合物为小豆蔻明。
化合物6 黄色针状结晶,分子式C16H14O5; ESIMS m/z: 287 [M + H]+, 309 [M + Na]+, 325 [M + K]+, 595 [2M + Na]+, 611 [2M + K]+, 285 [M-H]-, 571 [2M-H]-。1H NMR (CD3OD, 500 MHz): δ 7.49 (2H, d, J = 2.1 Hz, H-2, 6), 6.82 (2H, d, J = 2.1 Hz, H-3, 5), 7.76 (1H, d, J = 15.6 Hz, H-7), 7.66 (1H, d, J = 15.6 Hz, H-8), 5.99 (1H, d, J = 2.1 Hz, H-3′), 5.92 (1H, d, J = 2.1 Hz, H-5′), 3.89 (3H, s, H-2′-OMe); 13C NMR (CD3OD, 125 MHz): δ 128.4 (C-1), 131.3 (C-2, 6), 116.2 (C-3, 5), 161.1 (C-4), 143.8 (C-7), 125.6 (C-8), 194.1 (C-9), 105.8 (C-1′), 164.6 (C-2′), 97.1 (C-3′), 168.6 (C-4′), 92.5 (C-5′), 166.4 (C-6′), 56.4 (C-2′-OMe)。以上数据与文献[6]报道一致,鉴定该化合物为蜡菊亭。
化合物7 白色无定型粉末,分子式C15H14O6;ESIMS m/z: 291 [M + H]+, 313 [M + Na]+, 329 [M + K]+, 603 [2M + Na]+, 619 [2M + K]+, 289 [M-H]-。1H NMR (CD3OD, 500 MHz): δ 4.61 (1H, d, J = 7.4 Hz, H-2), 4.02 (1H, td, J = 7.4, 5.4 Hz, H-3), 2.87 (1H, dd, J = 16.1, 5.4 Hz, H-4α), 2.55 (1H, dd, J = 16.1, 8.0 Hz, H-4β), 5.91 (1H, d, J = 1.8 Hz, H-6), 5.97 (1H, d, J = 1.8 Hz, H-8), 6.87 (1H, d, J = 2.0 Hz, H-2′), 6.79 (1H, d, J = 8.1 Hz, H-5′), 6.74 (1H, dd, J = 8.1, 2.0 Hz, H-6′); 13C NMR (CD3OD, 125 MHz): δ 81.4 (C-2), 67.4 (C-3), 27.0 (C-4), 144.8 (C-5), 94.3 (C-6), 156.3 (C-7), 95.0 (C-8), 99.5 (C-4a), 156.1 (C-8a), 130.8 (C-1′), 113.9 (C-2′), 144.8 (C-3′), 155.5 (C-4′), 118.8 (C-5′), 114. 8 (C-6′)。以上数据与文献[9]报道一致,鉴定该化合物为(+)-儿茶素。
化合物8 白色无定型粉末,分子式C15H14O6; ESIMS m/z: 291 [M + H]+, 313 [M + Na]+, 329 [M + K]+, 603 [2M + Na]+, 619 [2M + K]+, 289 [M-H]-。1H NMR (CD3OD, 500 MHz): δ 4.84 (1H, s, H-2), 4.20 (1H, m, H-3), 2.88 (1H, dd, J = 16.8, 4.7 Hz, H-4α), 2.76 (1H, dd, J = 16.8, 3.0 Hz, H-4β), 5.94 (1H, d, J = 2.2 Hz, H-6), 5.96 (1H, d, J = 2.2 Hz, H-8), 6.99 (1H, d, J = 2.0 Hz, H-2′), 6.78 (1H, d, J = 8.1 Hz, H-5′), 6.82 (1H, dd, J = 8.1, 2.0 Hz, H-6′); 13C NMR (CD3OD, 125 MHz): δ 79.9 (C-2), 67.5 (C-3), 29.3 (C-4), 146.0 (C-5), 95.9 (C-6), 157.7 (C-7), 96.5 (C-8), 100.1 (C-4a), 158.0 (C-8a), 132.3 (C-1′), 115.4 (C-2′), 145.8 (C-3′), 157.4 (C-4′), 119.4 (C-5′), 115.9 (C-6′)。以上数据与文献[10]报道的一致,确定该化合物为(-)-表儿茶素。
化合物9 无色针状,分子式C30H24O12; ESIMS m/z 599 [M + Na]+, 615 [M + K]+, 575 [M-H]-。1H NMR (CD3OD, 500 MHz): δ 4.09 (1H, d, J = 3.5 Hz, H-3), 4.25 (1H, d, J = 3.5 Hz, H-4), 5.98 (1H, d, J = 2.3 Hz, H-6), 6.09 (1H, d, J = 2.3 Hz, H-8), 7.15 (1H, d, J = 2.2 Hz, H-10), 6.84 (1H, d, J = 8.0 Hz, H-13), 7.04 (1H, dd, J = 8.0, 2.2 Hz, H-14), 4.75 (1H, d, J = 7.8 Hz, H-2′), 4.17 (1H, td, J = 7.8, 5.6 Hz, H-3′), 2.96 (1H, dd, J = 16.4, 5.6 Hz, H-4′α), 2.60 (1H, dd, J = 16.4, 8.3 Hz, H-4′β), 6.11 (1H, s, H-6′), 6.93 (1H, d, J = 2.2 Hz, H-10′), 6.84 (1H, d, J = 8.0 Hz, H-13′), 6.85 (1H, dd, J = 8.0, 2.2 Hz, H-14′); 13C NMR (CD3OD, 125 MHz): δ 100.4 (C-2), 67.8 (C-3), 29.3 (C-4), 156.8 (C-5), 98.2 (C-6), 158.2 (C-7), 96.6 (C-8), 104.1 (C-4a), 154.3 (C-8a), 132.3 (C-9), 115.6 (C-10), 146.8 (C-11), 145.7 (C-12), 116.4 (C-13), 119.9 (C-14), 84.6 (C-2′), 68.1 (C-3′), 29.1 (C-4′), 156.2 (C-5′), 96.6 (C-6′), 152.2 (C-7′), 106.8 (C-8′), 103.2 (C-4′a), 151.4 (C-8′a), 130.6 (C-9′), 115.8 (C-10′), 146.8 (C-11′), 146.4 (C-12′), 115.7 (C-13′), 120.7 (C-14′)。以上数据与文献[11]报道的一致,确定该化合物为原花青素A1。
化合物10 无色针状,分子式C30H24O12; ESIMS m/z: 599 [M + Na]+, 615 [M + K]+, 575 [M-H]-。1H NMR (CD3OD, 500 MHz): δ 4.15 (1H, d, J = 3.5 Hz, H-3), 4.25 (1H, d, J = 3.5 Hz, H-4), 5.95 (1H, d, J = 2.3 Hz, H-6), 6.08 (1H, d, J = 2.3 Hz, H-8), 7.17 (1H, d, J = 2.2 Hz, H-10), 6.84 (1H, d, J = 8.0 Hz, H-13), 7.05 (1H, dd, J = 8.0, 2.2 Hz, H-14), 4.76 (1H, d, J = 7.9 Hz, H-2′), 4.08 (1H, td, J = 8.6, 5.6 Hz, H-3′), 2.98 (1H, dd, J = 16.3, 5.6 Hz, H-4′α), 2.58 (1H, dd, J = 16.3, 8.6 Hz, H-4′β), 6.10 (1H, s, H-6′), 6.87 (1H, d, J = 2.2 Hz, H-10′), 6.87 (1H, d, J = 8.0 Hz, H-13′), 6.84 (1H, dd, J = 8.0, 2.2 Hz, H-14′); 13C NMR (CD3OD, 125 MHz): δ 100.5 (C-2), 67.7 (C-3), 29.3 (C-4), 156.7 (C-5), 98.2 (C-6), 158.2 (C-7), 96.6 (C-8), 104.1 (C-4a), 154.2 (C-8a), 132.3 (C-9), 115.7 (C-10), 146.8 (C-11), 145.7 (C-12), 116.4 (C-13), 119.9 (C-14), 83.9 (C-2′), 68.4 (C-3′), 29.0 (C-4′), 154.1 (C-5′), 96.6 (C-6′), 152.2 (C-7′), 106.6 (C-8′), 102.9 (C-4′a), 150.1 (C-8′a), 131.0 (C-9′), 115.8 (C-10′), 146.8 (C-11′), 146.5 (C-12′), 115.5 (C-13′), 120.4 (C-14′)。以上数据与文献[12]报道的一致,确定该化合物为原花青素A6。
1.5 抗氧化活性测定ABTS自由基清除活性 按Yang等[13]的方法稍作改动。首先用10 mmol L-1的磷酸缓冲液(PBS, pH=7.4) 配制7 mmol L-1的ABTS溶液、140 mmol L-1过硫酸钾溶液,然后取5 mL的ABTS液与88 µL过硫酸钾溶液混合,在室温、避光条件下静置过夜(12~16 h),形成ABTS自由基储备液, 使用前用PBS (pH=7.4) 稀释成工作液,室温在波长734 nm下的OD值为0.70±0.02。然后将初始浓度为10 mmol L-1的待测化合物以及阳性对照(l-抗坏血酸)用DMSO倍比稀释为6~8个浓度。取5 µL样品(或阳性对照)溶液加入96孔板,再加入195 µL ABTS试剂液,阴性对照为5 µL DMSO+195 µL ABTS液;空白组为200 µL PBS;25℃下遮光反应6 min后,用酶标仪测定415 nm处的OD值;每个样品独立重复3次,计算ABTS自由基清除率(%)= [1-(OD样品-OD空白)/(OD阴性-OD空白)]×100%。
DPPH自由基清除活性 按Ma等[14]的方法稍作改动。DPPH用甲醇稀释成0.1 mmol L-1 (当天新鲜配置)。将初始浓度为10 mmol L-1的待测化合物和阳性对照分别用DMSO倍比稀释为6~8个浓度。取5 µL样品(或阳性对照)溶液加入96孔板, 再加入195 µL DPPH试剂液,阴性对照为5 µL DMSO+195 µL DPPH试剂液,空白组为200 µL甲醇;25˚C下遮光反应30 min后,用酶标仪测定517 nm处的OD值;每个样品独立重复3次,计算DPPH自由基清除率(%)=[1-(OD样品-OD空白)/(OD阴性-OD空白)]× 100%。
2 结果和讨论本研究采用有机溶剂萃取分部、正反相硅胶和凝胶柱层析以及HPLC等分离技术,首次对升振山姜茎乙醇提取物的化学成分进行了研究,分别从石油醚、氯仿和乙酸乙酯部位分离得到10个黄酮化合物。通过光谱分析和文献数据比较,分别鉴定为(-)-乔松素(1)、(±)-山姜素(2)、(±)-7, 4′-二羟基-5-甲氧基二氢黄酮(3)、4′, 6′-二羟基-2′-甲氧基二氢查尔酮(4)、小豆蔻明(5)、蜡菊亭(6)、(+)-儿茶素(7)、(-)-表儿茶素(8)、原花青素A1 (9)和原花青素A6 (10)。体外自由基清除活性测试结果表明(表 1),(+)-儿茶素(7)、原花青素A1 (9)和原花青素A6 (10)对ABTS和DPPH自由基均有显著的清除活性(IC50 < 10 µmol L-1),均强于阳性对照l-抗坏血酸。此外,化合物1、3和5也表现出显著的ABTS自由基清除活性,其IC50值分别为7.9、10.7和7.5 µmol L-1, 强于阳性对照l-抗坏血酸(IC50= 17.7 µmol L-1),但三者没有表现出DPPH自由基清除活性(IC50 > 250 µmol L-1)。
| 表 1 化合物1~10和l-抗坏血酸的抗氧化活性 Table 1 Antioxidant activities of compounds 1–10 and l-ascorbic acid |
结果表明,不同方法所得的抗氧化活性差异明显,除化合物6对ABTS和DPPH均具有中等或较弱的活性外,仅有具备邻位酚羟基的儿茶素类和原花青素类黄酮化合物(化合物7~10)才同时具备显著的ABTS和DPPH自由基清除活性,关于它们的抗氧化活性和用途有过不少报道[15-18],是功能食品、化妆品等领域重要的天然抗氧化剂。此外,乔松素(1)、山姜素(2)和小豆蔻明(5)作为升振山姜亲本草豆蔻药材(种子团)的主要特征性成分,是草豆蔻发挥降血糖、抗炎、抗肿瘤以及止吐暖胃等功效的主要成分[19-21]。
山姜属植物地上部位发达,尤其是升振山姜植株高达1.5~2.2 m,茎生物量大。本研究表明升振山姜茎中含有丰富的黄酮类功效成分,其中包括较高含量的草豆蔻药材药效成分乔松素(1)、山姜素(2)和小豆蔻明(5)以及抗氧化活性显著的儿茶素(7)和花青素类黄酮,为杂交新品种升振山姜的资源综合利用提供了一定的科学依据。
| [1] |
HU J Z, YE Y S, ZOU P, et al. Studies on the hybrid breeding and biological characteristics of zingiberaceous plant (Alpinia hainanensis 'Shengzhen')[J].
J Trop Subtrop Bot, 2011, 19(3): 279-282. 胡建竹, 叶育石, 邹璞, 等. 升振山姜的选育和生物学特性研究[J]. 热带亚热带植物学报, 2011, 19(3): 279-282. DOI:10.3969/j.issn.1005-3395.2011.03.014 |
| [2] |
WEN Q, PANG Y X, YANG Q, et al. Progress on the resources and exploitation of medicinal edible plants in Hainan Island[J].
J Guangdong Pharm Univ, 2015, 31(1): 126-131. 闻庆, 庞玉新, 杨全, 等. 海南岛药食同源植物资源及其开发利用现状[J]. 广东药学院学报, 2015, 31(1): 126-131. DOI:10.3969/j.issn.1006-8783.2015.01.028 |
| [3] | NGO K S, BROWN G D. Stilbenes, monoterpenes, diarylheptanoids, labdanes and chalcones from Alpinia katsumadai[J]. Phytochemistry, 1998, 47(6): 1117-1123. DOI:10.1016/S0031-9422(98)80083-6 |
| [4] | CHOI J K, KIM K M, KIM D K, et al. Topical anti-inflammatory and antipruritic effects of Alpinia katsumadai extracts[J]. J Dermatol Sci, 2009, 53(1): 81-84. DOI:10.1016/j.jdermsci.2008.07.008 |
| [5] |
LI Y Y, YANG L, WANG C H, et al. Chemical constituents from seeds of Alpinia katsumadai Hayata and their anti-tumor activity[J].
Acta Univ Trad Med Sin Pharmacol Shanghai, 2010, 24(1): 72-75. 李元圆, 杨莉, 王长虹, 等. 草豆蔻化学成分及体外抗肿瘤作用研究[J]. 上海中医药大学学报, 2010, 24(1): 72-75. |
| [6] | WANG X B, YANG C S, HUA S Z, et al. Chemical constituents from the seeds of Alpinia katsumadai Hayata[J]. Chin J Nat Med, 2010, 8(6): 419-421. |
| [7] |
WANG X Q, YANG X J, LI J S. Studies on chemical constituents of Alpinia katsumadai[J].
J Chin Med Mat, 2008, 31(6): 853-855. 王秀芹, 杨孝江, 李教社. 草豆蔻化学成分研究[J]. 中药材, 2008, 31(6): 853-855. DOI:10.3321/j.issn:1001-4454.2008.06.019 |
| [8] | HUFFORD C D, OGUNTIMEIN B O. Dihydrochalcones from Uvaria angolensis[J]. Phytochemistry, 1980, 19(9): 2036-2038. DOI:10.1016/0031-9422(80)83036-6 |
| [9] | NGUYEN P H, ZHAO B T, LEE J H, et al. Antithrombotic phenolics from the stems of parthenocissus tricuspidata possess anti-inflammatory effect[J]. Bull Korean Chem Soc, 2014, 35(6): 1763-1768. DOI:10.5012/bkcs.2014.35.6.1763 |
| [10] | SETO R, NAKAMURA H, NANJO F, et al. Preparation of epimers of tea catechins by heat treatment[J]. Biosci Biotechnol Biochem, 1997, 61(9): 1434-1439. DOI:10.1271/bbb.61.1434 |
| [11] | LOU H X, YAMAZAKI Y, SASAKI T, et al. A-type proanthocyanidins from peanut skins[J]. Phytochemistry, 1999, 51(2): 297-308. DOI:10.1016/S0031-9422(98)00736-5 |
| [12] | KAMIYA K, WATANABE C, ENDANG H, et al. Studies on the constituents of bark of Parameria laevigata Moldenke[J]. Chem Pharm Bull, 2001, 49(5): 551-557. DOI:10.1248/cpb.49.551 |
| [13] | YANG D, XIE H H, JIANG Y M, et al. Phenolics from strawberry cv. Falandi and their antioxidant and alpha-glucosidase inhibitory activities[J]. Food Chem, 2016, 194: 857-863. DOI:10.1016/j.foodchem.2015.08.091 |
| [14] | MA Q, XIE H H, LI S, et al. Flavonoids from the pericarps of Litchi chinensis[J]. J Agric Food Chem, 2014, 62(5): 1073-1078. DOI:10.1021/jf405750p |
| [15] | XU X Y, XIE H H, WANG Y F, et al. A-type proanthocyanidins from lychee seeds and their antioxidant and antiviral activities[J]. J Agric Food Chem, 2010, 58(22): 11667-11672. DOI:10.1021/jf1033202 |
| [16] | MALDONADO P D, RIVERO-CRUZ I, MATA R, et al. Antioxidant activity of A-type proanthocyanidins from Geranium niveum(Geraniaceae)[J]. J Agric Food Chem, 2005, 53(6): 1996-2001. DOI:10.1021/jf0483725 |
| [17] | YILMAZ Y, TOLEDO R T. Major flavonoids in grape seeds and skins:Antioxidant capacity of catechin, epicatechin, and gallic acid[J]. J Agric Food Chem, 2004, 52(2): 255-260. DOI:10.1021/jf030117h |
| [18] | KUMAZAWA S, TANIGUCHI M, SUZUKI Y, et al. Antioxidant activity of polyphenols in carob pods[J]. J Agric Food Chem, 2002, 50(2): 373-377. DOI:10.1021/jf010938r |
| [19] | PROMSAN S, JAIKUMKAO K, PONGCHAIDECHA A, et al. Pinocembrin attenuates gentamicin-induced nephrotoxicity in rats[J]. Can J Physiol Pharmacol, 2016, 94(8): 808-818. DOI:10.1139/cjpp-2015-0468 |
| [20] | HU K, YANG Y, TU Q Y, et al. Alpinetin inhibits LPS-induced inflammatory mediator response by activating PPAR-γ in THP-1-derived macrophages[J]. Eurp J Pharmacol, 2013, 721(1/2/3): 96-102. DOI:10.1016/j.ejphar.2013.09.049 |
| [21] | MOREIRA G L, MARIA V I, ANTÓNIO R J. An overview on cardamonin[J]. J Med Food, 2014, 17(6): 633-640. DOI:10.1089/jmf.2013.0061 |
 2017, Vol. 25
2017, Vol. 25


