2. 新疆农业科学院微生物应用研究所, 乌鲁木齐 830091
2. Institute of Applied Microbes, Xinjiang Academy of Agriculture, Wulumuqi 830091, China
温度是影响植物生长和分布的一个重要因素。在夏季高温季节,有些植物通过自身的高抗热性度过夏天,而另一些植物则通过在盛夏到来之前完成种子繁殖或生长停滞来躲避和避免高温的伤害[1-2]。一般来说,高温能够对植物细胞造成多种伤害。首先,由于植物的细胞膜和内膜系统的主要成分是脂类和蛋白质,在正常的生理状态下形成具有多种功能的液晶态半透膜,隔离细胞内物质和外部环境。在高温条件下,膜脂趋向于液化,流动性加大而稳定性降低,使膜系统出现缺陷,质膜全部或部分失去半透性和主动吸收的特性,导致细胞内特有的物质或浓度高于外界的物质渗漏[3-5]。其次,高温能影响植物细胞内各种酶系统的活性,由于这些酶系统对于温度的敏感性差别,造成不同途径代谢速率的比例失调和代谢改变,进而导致细胞伤害或衰老死亡[6-7]。严重的高温还会直接导致细胞内的蛋白质变性,破坏蛋白质的空间构型,直接导致细胞死亡[8-9]。高温对植物的伤害也与细胞的生理特性和细胞外环境的物理条件有关。以呼吸为例,随着温度的升高,植物组织的呼吸强度会不断升高;当温度到达某一程度后,由于呼吸系统的酶类受到伤害,呼吸强度可能反而会随着温度的升高而逐渐下降[10-11]。另一方面,在高温条件下,细胞的呼吸速率增加, 对氧的需求增大,而这时细胞和环境中水的氧气溶解度反而大大下降,这就有可能造成细胞缺氧,限制细胞的氧化还原过程而影响细胞正常的生理功能[12-13]。光合作用虽然不受水中溶解氧浓度的限制,但其酶系统也有与呼吸类似的温度效应[14-15]。因此,通过分析不同植物细胞膜透性对温度的响应,分析植物组织的光合作用和呼吸作用对温度的响应规律,就能够了解不同植物对温度响应的差异,进而分析植物对高温胁迫的抗性和抗性机理。
目前,植物对高温胁迫的抗性研究,多集中于生理指标,如电导率、丙二醛、叶绿素、可溶性蛋白、脯氨酸含量和SOD活性的变化等方面[16-17]; 关于高温胁迫下叶绿体及类囊体膜的损伤、光合电子传递活力的改变、活性氧累积、光合作用相关蛋白质降解及细胞自噬方面[18]也有大量的研究。但关于同一植物体内不同的功能系统,或不同植物的同一功能系统对温度反应的比较研究鲜有报道。为了了解不同植物体内同类代谢系统的高温耐受极限与耐热性的关系,以及同一植物中不同代谢系统高温耐受极限的差别与高温伤害机理的关系,本文以珊瑚菜(Glehnia littoralis)和同一生境的滨旋花(Calystegia soldanella)进行研究。珊瑚菜属于伞形科珊瑚菜属,为单种属。在我国主要分布在东部沿海,生长在海滨沙地[19]。珊瑚菜也是一种常用的传统药用植物,近些年数量急剧减少,已被列为国家Ⅱ级濒危保护植物[20]。珊瑚菜每年5-6月开花结果,进入盛夏后生长缓慢,活力大大降低,秋季又恢复生长,是一种对高温相对比较敏感的植物,而同一生境的滨旋花却没有这种现象。本文通过分析这两种植物的光合系统、呼吸系统的活性和质膜系统对温度变化的响应,一方面了解植物的不同功能系统对高温伤害的敏感性以及不同植物的同类功能系统对高温伤害的敏感性,探讨高温对植物伤害的机理;另一方面探讨环境变化影响珊瑚菜生长的原因,为研究珊瑚菜夏季生长停滞机理提供参考。
1 材料和方法 1.1 材料试验材料为烟台海滨沙地生长的多年生草本植物的珊瑚菜(Glehnia littoralis Fr. Schaidt ex Mig.), 以伴生的滨旋花[Calystegia soldanella (L.) R. Br.]作为参考。取材时间为2015年6-7月,从长势一致的健康植株中部采集成熟的完整叶片,立即装入密封塑料袋并放入装有碎冰的塑料保温箱中待用。先将待测叶片用单面刀片切成约1.5 mm×1.5 mm的小块,在蒸馏水中清洗切口表面3次,用滤纸吸干叶片表面的水分,再将叶片切块放入玻璃培养皿, 用塑料袋密封放入冰箱冷藏室待用。
1.2 呼吸作用和光合作用的测定叶片的呼吸作用和光合作用采用氧电极(Oxygraph, Hansatech, 英国)通过恒温水浴控温(误差≤0.1℃)测定。反应液为2‰碳酸氢钠以提供光合作用所需的CO2,反应杯体积为1 mL以取得灵敏度和搅拌均匀度的折中平衡,叶片样品量为(0.050±0.001) g。测定开始前,将装有2‰碳酸氢钠水溶液的反应杯在恒温循环水浴中加热到待测温度,然后将叶片投入反应杯中搅拌和测定。单位重量叶片的光合和呼吸速率根据样品重量和叶片的耗氧或放氧速率计算, 并根据不同温度下氧在水中的溶解度对结果进行校正并作图分析。为了减少光源的温度干扰,光合作用使用的光源为特制的30 W高功率LED光导纤维冷光源。光合作用测定的光照强度为1200 µmol m-2s-1,温度范围为0℃~50℃,每5℃为一个区间。所有光合和呼吸作用均取整个测定过程中的60 s区间斜率最高值,每个测定至少重复3次。
1.3 细胞膜透性的测定将叶片放入塑料袋密封好,塑料袋在不同温度下处理2 h后,用直径5.2 mm的事先抛光打磨锋利的打孔器,取30片小圆片,用高纯水清洗伤口3遍后加入4 mL高纯水,抽真空5 min后,振荡均匀,用TDS-型电导仪测定电导率A,最后将试管放入沸腾水浴中煮沸5 min杀死叶片,冷却至室温并摇匀,用TDS-型电导仪测定电导率B,以A与B比值的百分数表示膜的透性。
1.4 光合作用和呼吸作用的动力学曲线由于叶片在呼吸和光合过程中会耗氧和放氧, 导致反应杯中的含氧量会发生变化,光合作用和呼吸作用的动力学曲线就是以呼吸和光合过程中的含氧量变化来绘制的。在呼吸测定过程中,一方面反应杯中的溶解氧浓度由于叶片呼吸耗氧而不断降低,另一方面溶液中的饱和溶解氧浓度随温度升高而不断降低,因此不同温度的呼吸反应动力学曲线的溶解氧浓度起点不同,各个温度的曲线不会重叠。在光合作用测定过程中,反应杯中的溶解氧浓度由于叶片的光合放氧而迅速增加,如果不经过特殊处理会造成各条曲线的重叠。为了避免不同温度下的曲线重叠难以区别,在绘制光合作用反应动力学曲线图时,自5℃开始,温度每升高5℃,其曲线的时间起点坐标被依次向后推移10 min,即0℃以第0 min为开始起点,5℃以第10 min为开始起点,10℃以第20 min为开始起点,以此类推,但除了曲线起始点的改变外,每个温度下测定得到的曲线的时间变化过程完全保持不变。
2 结果和分析 2.1 叶片细胞膜透性对温度的反应从图 1可见,从0℃到45℃,珊瑚菜和滨旋花叶片的细胞膜透性一直都没有明显的变化,当温度达到50℃时,两种植物的相对电导率都迅速升高, 其中珊瑚菜的相对电导率超过50%,而滨旋花叶片的相对电导率为33.6%,即珊瑚菜叶片细胞膜的热稳定性低于滨旋花的,两种植物叶片的细胞膜都能耐受45℃的高温胁迫。
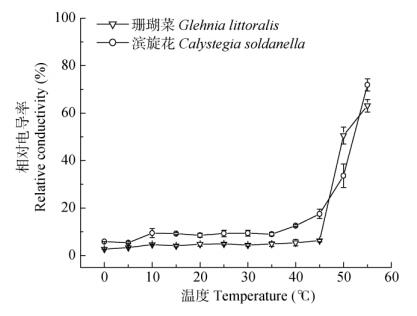
|
图 1 珊瑚菜和滨旋花叶片相对电导率与温度的关系 Fig. 1 Relation between relative conductivity in Glehnia littoralis and Calystegia soldanella and temperature |
由图 2可见,两种植物的呼吸速率都随着温度的升高而逐渐升高,在45℃时达到最高,当温度为50℃时略有下降但仍然保持很高,没有受到严重伤害的迹象,表明两种植物的呼吸系统都对高温有很高的抗性,对比图 1可以看到,两种植物的呼吸系统的耐热性都明显高于各自细胞膜对温度的抗性。
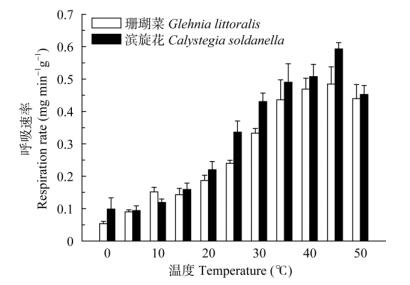
|
图 2 珊瑚菜和滨旋花叶片的呼吸速率与温度的关系 Fig. 2 Relation between respiration rate in Glehnia littoralis and Calystegia soldanella and temperature |
由图 3可见,两种植物的光合速率都随着温度的升高而逐渐升高,珊瑚菜叶片的光合作用在30℃时达到最高,温度不高于40℃仍然保持很高,当温度达到45℃时剧烈下降,在50℃时停止(负值表明仅有呼吸耗氧)。滨旋花叶片的光合作用在35℃时达到最高,温度不高于40℃时也仍然保持很高,当温度达到45℃时剧烈下降,也是在50℃时停止。这表明两种植物的光合作用临界点都在40℃左右, 滨旋花的光合反应系统对高温的耐性要略高于珊瑚菜。与图 2相比,两种植物的光合系统的耐热性比呼吸系统的都要低10℃以上,表明高温下两种植物的光合系统首先受到伤害,而呼吸系统的热稳定性要高得多,同时两种植物的净光合速率没有很大的差别。
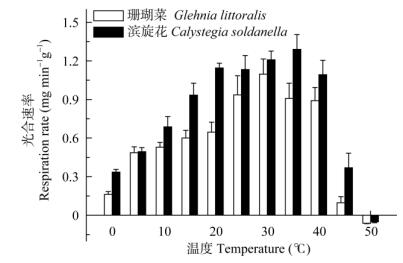
|
图 3 珊瑚菜和滨旋花叶片的净光合速率与温度的关系 Fig. 3 Relation between net photosynthetic rate in Glehnia littoralis and Calystegia soldanella and temperature |
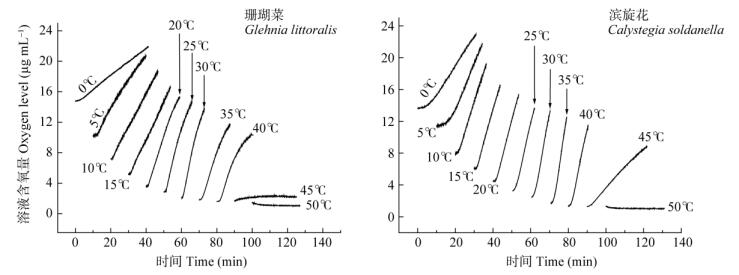
从图 4可见,尽管在35℃以上高温低氧条件下,两种植物的呼吸作用曲线在初始5~10 min都呈现较好的线性关系,没有显示出反应钝化的动力学现象,也充分说明两种植物呼吸系统的酶对高温有较高的抗性。

|
图 4 珊瑚菜和滨旋花叶片呼吸耗氧量的动力学曲线 Fig. 4 Kinetics curves showing respirational oxygen consumption in Glehnia littoralis and Calystegia soldanella |
从图 5可见,珊瑚菜叶片的光合作用曲线在35℃开始出现斜率下降和轻微的钝化弯曲偏离线性变化,40℃的初始反应斜率没有明显变化,但后期曲线明显弯曲,45℃时斜率降为0;而滨旋花叶片的光合作用在40℃以下均表现出正常的线性关系,在45℃时的斜率大幅度下降,仅约为正常曲线的一半,直到50℃时才为0,因此,滨旋花叶片的光合系统抗热性明显高于珊瑚菜。
|
图 5 珊瑚菜和滨旋花叶片的光合作用动力学曲线 Fig. 5 Kinetics curves of photosynthesis in Glehnia littoralis and Calystegia soldanella |
由高斯回归分析曲线(图 6)可以看出,虽然两种植物的呼吸速率和光合速率都随温度升高而升高, 但温度低于13℃~15℃时,光合速率的升高速度明显高于呼吸速率,随着温度的进一步上升,呼吸速率迅速加快,而光合速率的上升速度开始低于呼吸速率,滨旋花和珊瑚菜的转折点分别在13.2℃和15.4℃。同时,叶片的光合速率与呼吸速率在转折点的比值,15.4℃时珊瑚菜的达到3.98倍,13.2℃时滨旋花的达到5.65倍,并且在40℃以下始终高于珊瑚菜,表明滨旋花比珊瑚菜有更高的光合产物累积能力。
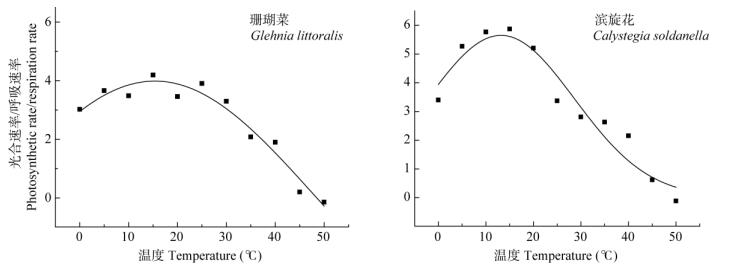
|
图 6 珊瑚菜和滨旋花叶片光合作用/呼吸作用的高斯回归分析 Fig. 6 Guassian regression analysis on the ratio of photosynthesis rate to respiration rate in Glehnia littoralis and Calystegia soldanella |
虽然有很多研究证明植物的光合系统对高温胁迫敏感[18, 21-22],但与细胞内的其他代谢或功能系统的比较尚不明朗。本研究表明,珊瑚菜和滨旋花在受到高温胁迫时,在光合、呼吸和膜系统中,最先受到伤害的是光合系统。温度较低时,两种植物的光合速率都随着温度的升高而逐渐升高,但最适光合温度有差别,珊瑚菜叶片的光合作用在30℃时达到最高,而滨旋花在35℃时达到最高。珊瑚菜的光合系统在40℃虽仍有较高的活性但开始出现钝化现象(图 2),当温度达到45℃时,受到强烈的伤害达到完全失活。相比之下,滨旋花的光合作用在45℃时才开始大幅度下降但仍能保持最佳温度下的一半以上,表明滨旋花叶片的光合系统比珊瑚菜有较高的耐热性。从图 1来看,当温度达到50℃时,珊瑚菜细胞质膜系统超过50%达到半致死点,而滨旋花的为33.6%,表明滨旋花细胞膜的热稳定性也要高于珊瑚菜。
从呼吸系统对高温的反应来看,珊瑚菜和滨旋花的呼吸速率都随着温度的升高而逐渐升高,在45℃时达到最高,当温度达到50℃时略有下降但仍然保持很高的活性,没有受到严重伤害的迹象,表明两种植物的呼吸系统都对高温有很高的抗性,因此推测这两种植物在受到高温胁迫时,首先是光合系统遭到损害,其次是膜系统的伤害,而呼吸系统相对前两者有更高的耐热性,因而可能是最后受到伤害的。滨旋花的整体抗热性高于珊瑚菜。高斯回归分析显示,珊瑚菜的光合速率与呼吸速率比始终低于滨旋花。由此,高温条件下的光合产物昼夜过度消耗可能是珊瑚菜夏天生长停滞的原因。
另外,目前有关高温对植物胁迫的研究,一方面集中在植物细胞信号转导、基因表达和调控[23-26],有助于阐明高温胁迫产生的后效应和修复;另一方面是关于高温胁迫对植物不同生理指标的影响,包括电导率、丙二醛、叶绿素、可溶性蛋白、脯氨酸含量和SOD活性等[16-17, 27-28],以及光系统Ⅱ的最大光化学效率(Fv/Fm)等与叶绿素荧光有关的参数变化[29-30]。但植物细胞的整个子功能系统的活性可能比单个酶的活性更有代表性。虽然这些指标与植物抗热性有关,但是单个指标或酶活性的变化所反映的植物细胞的抗热性可能不如一个完整的功能系统更有意义。由于植物的光合系统、呼吸系统和质膜系统是植物细胞重要的代谢部分,它们的代谢失调或伤害对细胞的生存有重要的决定作用,因此这些代谢系统的变化比单个生理指标的变化更能反映植物受到的伤害程度[31]。在所有系统中,植物对高温胁迫最敏感的代谢部分可能就决定着植物的抗热性,因此,分析比较植物细胞各个代谢系统的温度效应有可能为分析对比植物的抗热性高低找到有效的方法。
| [1] | MARCO F, BITRIÁN M, CARRASCO P, et al. Genetic engineering strategies for abiotic stress tolerance in plants[M]//BAHADUR B, RAJAM M V, SAHIJRAM L, et al. Plant Biology and Biotechnology. India:Springer, 2015:579-609. doi:10.1007/978-81-322-2283-5_29. |
| [2] | TAIZ L, ZEIGER E. Plant Physiology[M]. 5th ed. Sunderland, USA: Sinauer Associates, 2010: 591-623. |
| [3] | LAVANIA D, DHINGRA A, SIDDIQUI M H, et al. Current status of the production of high temperature tolerant transgenic crops for cultivation in warmer climates[J]. Plant Physiol Biochem, 2015, 86: 100-108. DOI:10.1016/j.plaphy.2014.11.019 |
| [4] | NARAYANAN S, TAMURA P J, ROTH M R, et al. Wheat leaf lipids during heat stress:I. High day and night temperatures result in major lipid alterations[J]. Plant Cell Environ, 2016, 39(4): 787-803. DOI:10.1111/pce.12649 |
| [5] | AL BUSAIDI K T S, FARAG K M. The use of electrolyte leakage procedure in assessing heat and salt tolerance of Ruzaiz date palm (Phoenix dactylifera L.) cultivar regenerated by tissue culture and offshoots and treatments to alleviate the stressful injury[J]. J Hort For, 2015, 7(4): 104-111. DOI:10.5897/JHF2014.0378 |
| [6] | KRASENSKY J, JONAK C. Drought, salt, and temperature stressinduced metabolic rearrangements and regulatory networks[J]. J Exp Bot, 2012, 63(4): 1593-1608. DOI:10.1093/jxb/err460 |
| [7] | ZHONG L L, ZHOU W, WANG H J, et al. Chloroplast small heat shock protein HSP21 interacts with plastid nucleoid protein pTAC5 and is essential for chloroplast development in Arabidopsis under heat stress[J]. Plant Cell, 2013, 25(8): 2925-2943. DOI:10.1105/tpc.113.111229 |
| [8] | JESPERSEN D, XU C P, HUANG B R. Membrane proteins associated with heat-induced leaf senescence in a cool-season grass species[J]. Crop Sci, 2015, 55(2): 837-850. DOI:10.2135/cropsci2014.04.0335 |
| [9] | SONI M L, YADAVA N D, TALWAR H S, et al. Variability in heat tolerance in Bambara groundnut[Vigna subterranea (L.) Verdc[J]. Ind J Plant Physiol, 2015, 20(1): 92-96. DOI:10.1007/s40502-015-0137-8 |
| [10] | ALMESELMANI M, DESHMUKH P S, CHINNUSAMY V. Effects of prolonged high temperature stress on respiration, photosynthesis and gene expression in wheat (Triticum aestivum L.) varieties differing in their thermotolerance[J]. Plant Stress, 2012, 6(1): 25-32. |
| [11] | HASANUZZAMAN M, NAHAR K, ALAM M M, et al. Physiological, biochemical, and molecular mechanisms of heat stress tolerance in plants[J]. Int J Mol Sci, 2013, 14(5): 9643-9684. DOI:10.3390/ijms14059643 |
| [12] | DREW M C. Oxygen deficiency and root metabolism:Injury and acclimation under hypoxia and anoxia[J]. Annu Rev Plant Physiol Plant Mol Biol, 1997, 48: 223-250. DOI:10.1146/annurev.arplant.48.1.223 |
| [13] | BITA C E, GERATS T. Plant tolerance to high temperature in a changing environment:Scientific fundamentals and production of heat stress-tolerant crops[J]. Front Plant Sci, 2013, 4(4): 273 DOI:10.3389/fpls.2013.00273 |
| [14] | BUCHNER O, STOLL M, KARADAR M, et al. Application of heat stress in situ demonstrates a protective role of irradiation on photosynthetic performance in alpine plants[J]. Plant Cell Environ, 2015, 38(4): 812-826. DOI:10.1111/pce.12455 |
| [15] | HALDIMANN P, FELLER U. Inhibition of photosynthesis by high temperature in oak (Quercus pubescens L.) leaves grown under natural conditions closely correlates with a reversible heat-dependent reduction of the activation state of ribulose-1, 5-bisphosphate carboxylase/oxygenase[J]. Plant Cell Environ, 2004, 27(9): 1169-1183. DOI:10.1111/j.1365-3040.2004.01222.x |
| [16] | WANG P, ZHAO L, HOU H L, et al. Epigenetic changes are associated with programmed cell death induced by heat stress in seedling leaves of Zea mays[J]. Plant Cell Physiol, 2015, 56(5): 965-976. DOI:10.1093/pcp/pcv023 |
| [17] |
CHEN P Q, YU S L, ZHAN Y N, et al. A review on plant heat stress physiology[J].
Chin Agric Sci Bull, 2006, 22(5): 223-227. 陈培琴, 郁松林, 詹妍妮, 等. 植物在高温胁迫下的生理研究进展[J]. 中国农学通报, 2006, 22(5): 223-227. DOI:10.3969/j.issn.1000-6850.2006.05.060 |
| [18] |
YANG X F, GUO F Q. Research advances in mechanisms of plant leaf senescence under heat stress[J].
Acta Physiol J, 2014, 50(9): 1285-1292. 杨小飞, 郭房庆. 高温逆境下植物叶片衰老机理研究进展[J]. 植物生理学报, 2014, 50(9): 1285-1292. DOI:10.13592/j.cnki.ppj.2014.1012 |
| [19] |
SHAN R H, SHE M L.
Flora Reipublicae Popularis Sinicae, Tomus 55(3)[M]. Beijing: Science Press, 1992: 176-177.
单人骅, 佘孟兰. 中国植物志, 第55卷第3分册[M]. 北京: 科学出版社, 1992: 176-177. |
| [20] |
FU L G.
China Plant Red Data Book:Rare and Endangered Plants, Vol. 1[M]. Beijing: Science Press, 1991: 698-699.
傅立国. 中国植物红皮书——稀有濒危植物(一)[M]. 北京: 科学出版社, 1991: 698-699. |
| [21] |
TANG T, ZHENG G W, LI W Q. Defense mechanisms of plants photosystem to heat stress[J].
Chin J Biochem Mol Biol, 2012, 28(2): 127-132. 唐婷, 郑国伟, 李唯奇. 植物光合系统对高温胁迫的响应机制[J]. 中国生物化学与分子生物学报, 2012, 28(2): 127-132. |
| [22] |
MA T C, XIA J F, WANG Y L, et al. High temperature stress effect on physiological indexes of rice in heading and flowering period[J].
Chin Agric Sci Bull, 2015, 31(24): 25-32. 马廷臣, 夏加发, 王元垒, 等. 抽穗扬花期高温胁迫对不同耐热性水稻生理指标的影响[J]. 中国农学通报, 2015, 31(24): 25-32. DOI:10.11924/j.issn.1000-6850.casb15040109 |
| [23] | HELEN M P B, LAKSHMI P A, NANDAGOPALAN V, et al. Effect of heat treatment on germination, seedling growth and some biochemical parameters of dry seeds of black gram[J]. Int J Pharm Phytopharmacol Res, 2012, 1(4): 194-202. |
| [24] | GUERRA D, CROSATTI C, KHOSHRO H H, et al. Post-transcriptional and post-translational regulations of drought and heat response in plants:A spider's web of mechanisms[J]. Front Plant Sci, 2015, 6: 57 DOI:10.3389/fpls.2015.00057 |
| [25] | LIN Y H, HUANG L F, HASE T, et al. Expression of plant ferredoxinlike protein (PFLP) enhances tolerance to heat stress in Arabidopsis thaliana[J]. New Biotechnol, 2015, 32(2): 235-242. DOI:10.1016/j.nbt.2014.12.001 |
| [26] |
LIU J M, ZHAO Q, YIN Z P, et al. Heat-responsive mechanisms in plants revealed by proteomic analysis:A review[J].
Chin J Appl Ecol, 2015, 26(8): 2561-2570. 刘军铭, 赵琪, 尹赜鹏, 等. 利用蛋白质组学技术揭示的植物高温胁迫响应机制[J]. 应用生态学报, 2015, 26(8): 2561-2570. |
| [27] |
RANG Z W, ZHOU Q M. Research advances on physiological responses and tolerant mechanism to high temperature stress in rice[J].
Chin Agric Sci Bull, 2015, 31(21): 249-258. 穰中文, 周清明. 水稻高温胁迫的生理响应及耐热机理研究进展[J]. 中国农学通报, 2015, 31(21): 249-258. DOI:10.11924/j.issn.1000-6850.casb15010133 |
| [28] | SGOBBA A, PARADISO A, DIPIERRO S, et al. Changes in antioxidants are critical in determining cell responses to short-and long-term heat stress[J]. Physiol Plant, 2015, 153(1): 68-78. DOI:10.1111/ppl.12220 |
| [29] |
SUN Y J, FU Y D, DU Y P, et al. Effects of different temperature and light treatments on photosynthetic system Ⅱ in Vitis vinifera L. cv. Cabernet Sauvignon[J].
Sci Agric Sin, 2013, 46(6): 1191-1200. 孙永江, 付艳东, 杜远鹏, 等. 不同温度/光照组合对'赤霞珠'葡萄叶片光系统Ⅱ功能的影响[J]. 中国农业科学, 2013, 46(6): 1191-1200. DOI:10.3864/j.issn.0578-1752.2013.06.012 |
| [30] | YAMAMOTO Y, AMINAKA R, YOSHIOKA M, et al. Quality control of photosystem Ⅱ:Impact of light and heat stresses[J]. Photosynth Res, 2008, 98(1/2/3): 589-608. DOI:10.1007/s11120-008-9372-4 |
| [31] | SREENIVASULU N, BUTARDO V M JR, MISRA G, et al. Designing climate-resilient rice with ideal grain quality suited for hightemperature stress[J]. J Exp Bot, 2015, 66(7): 1737-1748. DOI:10.1093/jxb/eru544 |
 2017, Vol. 25
2017, Vol. 25


