生物多样性保护的关键目标并不单是增加物种数量,而是保存更多物种携带的演化信息和变异潜力[1]。认知群落的系统发育多样性和系统发育结构在生物多样性保护工作中有重要的实际意义。生物多样性保护常受到人力、资金和时间等限制,而且区域建设发展势必会对植被造成一定的影响,难以做到完全的保护。因此,利用有限的资源保护生物多样性,需要对不同区域和生物类群设定不同的保护优先次序[2]。系统发育多样性和系统发育结构已经在许多区域的保护生物学研究中发挥作用。Forest等[3]和Pio等[4]对好望角的植物物种丰富度和系统发育多样性分布格局的研究显示,在设计植物多样性保护方案时,系统发育多样性是比物种丰富度更好的参考标准,将系统发育多样性用于生物多样性保护决策制定中是可行的和必要的。Li等[5]对独龙江地区植物的研究发现,常绿阔叶林表现为系统发育结构发散,而其他植被型表现为系统发育结构聚集,建议重点保护系统发育结构发散的群落, 另外还认为系统发育结构在生物多样性保护中可以表征系统发育多样性。动物类群如蛙类、鸟类的多样性研究中也发现,系统发育多样性的加入比传统的单一使用物种多样性指标能够更有效地揭示生物多样性优先保护区域和类群[6-7]。海岛特殊生态系统与大陆存在地理隔离乃至生殖隔离,又长期受到大风、降水不均等恶劣气候以及盐碱干旱土壤等不利自然条件影响,植物生长状况不良,物种组成简单,生态系统脆弱敏感[8]。近年来,养殖、工程建设、开挖采石等开发利用行为加速了对海岛生物多样性的破坏,海岛生物多样性保护形势更为严峻[9]。很多海岛可达性差,地势陡峭,野外工作受天气影响很大,生物多样性保护工作需要更大的投入。我国开展了一些海岛植物调查研究,但主要侧重于海岛植物区系和资源调查等描述性的工作[10-11],对海岛植物群落系统发育多样性及系统发育结构没有开展过研究。系统发育多样性对海岛植物群落的生存和稳定有不可忽视的作用,这方面的研究将为更加集约有效地保护海岛生物多样性和合理使用海岛提供重要理论指导。
本研究以蜈支洲岛代表性植物群系为例探讨群落系统发育多样性和系统发育结构对海岛生物多样性保护的影响。蜈支洲岛生境多样,水热条件适宜热带植物生长,拥有丰富的植物资源,现作为旅游开发用岛,其植物多样性保护不容忽视,但目前该岛还未见植物多样性相关的调查报告或植物名录,对该岛的植物物种多样性、丰富度以及群落系统发育多样性还缺乏认识,植物多样性保护的重点还不明确。本研究目的是查清蜈支洲岛主要植物群系类型及其分布;分析蜈支洲岛被子植物群系样方的物种丰富度、系统发育多样性和系统发育结构的关系,并分析系统发育多样性和系统发育结构格局形成的可能的原因;为蜈支洲岛植物多样性保护提出建议。
1 研究区域概况蜈支洲岛位于海南岛最南端三亚市北部的海棠湾内,地理位置为北纬18°18′22′′~18°18′59′′、东经109°45′18′′~109°46′09′′,距海岸线(三亚林旺后海村)约2.7 km。岛屿面积1.48 km2,东西长1500 m,南北宽1100 m,海岸线全长5.7 km。岛屿东、南、西部为山坡,中及中北部地势较为平坦,最高峰位于南部(最高海拔79.9 m)。岛屿东、南、西三面岸线为基岩海岸,北部岸线大部平坦,多沙滩。岛屿东、南、西部山坡土壤类型主要为砖红壤性土,中北部沙滩主要为珊瑚质滨海砂土和砂质潮滩盐土。蜈支洲岛所处的三亚市属热带海洋性季风气候区, 年均温25.7℃,气温最高为6月,平均28.7℃;气温最低为1月,平均21.4℃。全年日照时数2534 h,年均降水量1347.5 mm。潮汐类型属不正规日潮, 平均潮差 < 1 m[12]。
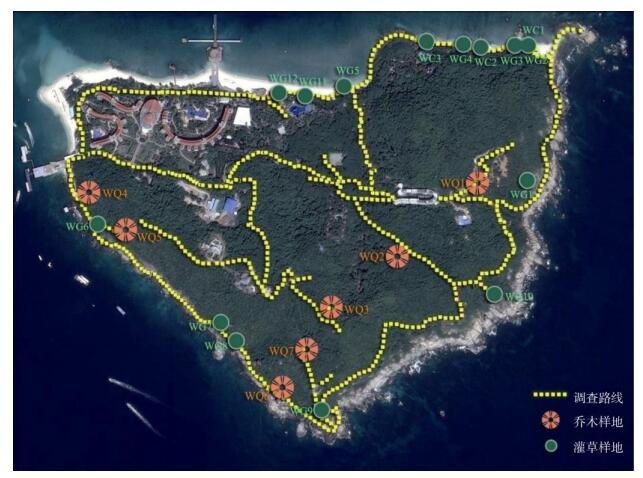
2 方法本研究组于2015年10月开展蜈支洲岛植物调查。由于海岛地势陡峭,难以大量布设样方,因此先采用路线法调查,参照《中国植被》[13]确定该岛的主要植被型和植物群系类型,在路线法调查基础上结合可达性,对典型群系类型设置样方,样方面积为10 m×10 m,共布设样方22个,其中森林样方7个、灌木和草本样方15个(图 1),调查记录样方内物种名、个体数、盖度、高度、胸径等。采集的凭证标本存放于国家海洋局第三海洋研究所海岛植物标本室。
|
图 1 蜈支洲岛植物物种信息采集调查路线及样地分布 Fig. 1 Routes and sample plots for plant survey in Wuzhizhou Island |
将记录的物种及其科属信息输入到植物谱系库软件Phylomatic[14]中,该软件以被子植物分类系统APG Ⅲ为基础数据,并整合Zanne[15]的进化树骨架,输出有枝长的系统进化树。
系统发育多样性的计算选用广泛使用的Faith系统发育多样性指数(PD)[16],该指数定义为连接系统发育树上所有物种的最短路径的分支长度总和, 按下式计算:
式中,C为连接系统发育树上所有物种的最短路径上的所有分支之和,c为连接节点的一段分支,Lc为c的分支长度。用Phylocom 4.2[17]中的pd模块计算各样方的系统发育多样性(PD),用SPSS 22.0对各样方的被子植物物种丰富度(SR)和系统发育多样性进行一元线性回归分析,检验二者是否呈线性关系。
本研究采用物种间净亲缘指数(NRI)来代表群落的系统发育结构。用Phylocom 4.2中的comstruct模块计算各样方的NRI,零模型采用非约束型,首先计算出样方中所有物种对的平均谱系距离(Mean phylogenetic distance, MPD),保持每一样地的物种丰富度不变,将小样方中的物种名从谱系库中随机抽取999次,获得该样方中物种在随机零模型下的MPD分布(MPDran),再利用随机分布结果将观察值(MPDob)标准化获得NRI,NRI=-1×(MPDob-MPDran)/sd MPDran, 式中sd为标准偏差。当NRI > 0,说明样方内的物种系统发育结构聚集;NRI=0,说明样方内的物种系统发育结构随机;NRI < 0,说明样方内的物种系统发育结构发散。
对各样方的PD和NRI进行Pearson相关性分析,并控制变量SR后对PD和NRI进行偏相关分析。
3 结果和分析 3.1 植物种类根据实地调查,鉴定采集的植物标本,蜈支洲岛(岛陆及其滨滩)共有维管束植物252种(包括种下等级,下同),隶属于71科203属。蕨类植物有3科3属5种。被子植物有68科200属247种,其中双子叶植物57科158属201种,单子叶植物11科42属46种,尚未见裸子植物。蜈支洲岛分布有丰富的海南龙血树(Dracaena cambodiana),属于国家Ⅱ级保护植物,IUCN易危物种[18]。据调查,蜈支洲岛样方内有海南龙血树24株(丛),植株高度为3.5~6.0 m,丛生基径为50~150 cm,胸高直径10~ 30 cm,大部分植株生长旺盛。
3.2 主要植被类型海南三亚蜈支洲岛的现状自然植被类型,可分为2个植被型组4个植被型10个群系(图 2):

|
图 2 蜈支洲岛植被生态景观图。A:厚皮树林;B:榄仁树林;C, D:龙胆木林;E:乌墨+台琼海桐林;F, G:银合欢林;H:露兜树灌丛;I:苦郎树灌丛;J:草海桐灌丛;K:厚藤灌草丛;L:单叶蔓荆灌草丛。 Fig. 2 Vegetation ecology landscape in Wuzhizhou Island. A: Lannea coromandelica forest; B: Terminalia catappa forest; C, D: Richeriella gracilis forest; E: Syzygium cumini + Pittosporum pentandrum forest; F, G: Leucaena leucocephala forest; H: Pandanus tectorius bushland; I: Clerodendrum inerme bushland; J: Ipomoea pes-caprae bushland; K: Vitex trifolia scrub-grassland; L: Scaevola sericea scrub-grassland. |
植被型组 阔叶林Broad-leaved forest
植被型Ⅰ季雨林 Monsoon forest
1.厚皮树林 Lannea coromandelica (图 2: A)
2.榄仁树林 Terminalia catappa (图 2: B)
3.龙胆木林 Richeriella gracilis (图 2: C, D)
4.乌墨+台琼海桐林 Syzygium cumini + Pittosporum pentandrum (图 2: E)
5.银合欢林 Leucaena leucocephala (图 2: F, G)
植被型II珊瑚岛常绿灌丛 Evergreen bushland in coral island
6.苦郎树灌丛 Clerodendrum inerme (图 2: I)
7.草海桐灌丛 Scaevola sericea (图 2: L)
植被型组 灌丛和灌草丛 Bushland and scrub-grassland
植被型Ⅲ常绿阔叶灌丛 Evergreen broad-leaved bushland
8.露兜树灌丛 Pandanus tectorius (图 2: H)
植被型Ⅳ灌草丛 Scrub-grassland
9.厚藤灌草丛 Ipomoea pes-caprae (图 2: J)
10.单叶蔓荆灌草丛 Vitex trifolia var. simplicifolia (图 2: K)
厚皮树林在蜈支洲岛的东部以及南部山地有较广泛的分布。榄仁树林除在岛屿中部及中北部平地旅游区为常见树种外,在南部山地的临海山坡, 也有较成片的分布。龙胆木林在蜈支洲岛的东部、南部和西部山地,有较广泛的分布。乌墨+台琼海桐林分布在蜈支洲岛的中南部山地,林木较高大。成片的银合欢林分布在蜈支洲岛的西北部山地,主要为纯林。成片或星散的草海桐灌丛分布在蜈支洲岛北部岸线,尤其是中段岸线潮上带沙滩内缘,沿岸线呈带状分布。苦郎树灌丛在蜈支洲岛东、南、西面的海岸山坡,以及北面岸线沙滩等,均有广泛或成片较小面积或星散的分布。在蜈支洲岛西、南、东三面的临海岸线和山坡、以及北面岸线潮上带沙滩内缘等,均有广泛和成片或星散的露兜树灌丛呈片状或带状分布,植被繁茂。在蜈支洲岛北部岸线高潮线上沙滩,尤其是中至东段岸线潮上带沙滩内缘,有成片或星散的厚藤灌草丛呈带状沿岸线分布。单叶蔓荆灌草丛主要分布在蜈支洲岛北面海岸线东段的沙滩内缘,沿岸线内缘呈带状丛状蔓性分布。
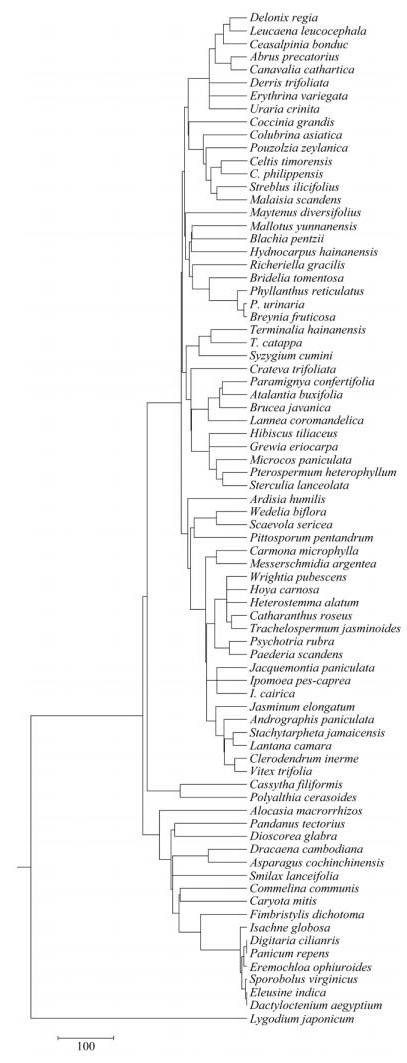
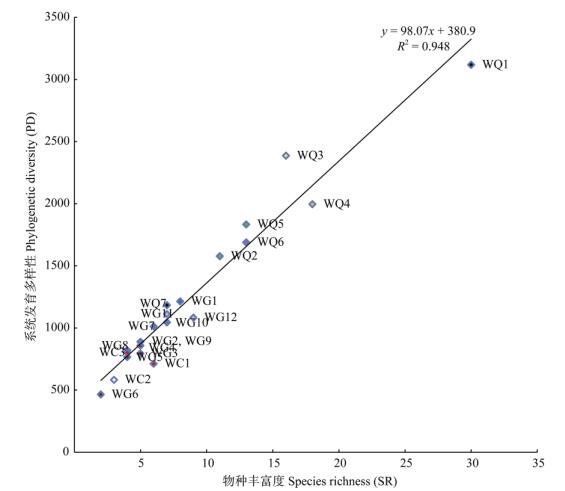
3.3 物种丰富度、系统发育多样性及系统发育结构图 3为22个样方中78种植物构建的系统发育树,各样方物种丰富度、系统发育多样性和系统发育结构见表 1。经一元线性回归分析,各样方系统发育多样性与物种丰富度总体上呈显著的线性正相关(P < 0.001, R2=0.948)(图 4)。但物种丰富度与系统发育多样性不完全成正比,拥有较高的物种丰富度的样方,其系统发育多样性可能较低;物种丰富度相同的样方,其系统发育多样性可能不同。森林样方的物种丰富度和系统发育多样性普遍高于灌木群系和草本群系样方。灌木群系样方中,露兜树灌丛样方和草海桐灌丛样方的物种丰富度和系统发育多样性高于苦郎树灌丛样方;草本群系样方中,厚藤灌草丛样方的物种丰富度和系统发育多样性高于单叶蔓荆灌草丛样方。
|
图 3 22个样方中78种被子植物的系统发育树 Fig. 3 Phylogenetic tree of 78 angiosperm species in 22 plots |
| 表 1 22个样方中被子植物物种丰富度(SR)、系统发育多样性(PD)及净亲缘指数(NRI) Table 1 Species richness (SR), phylogenetic diversity (PD) and net relatedness index (NRI) of angiosperm in 22 plots |
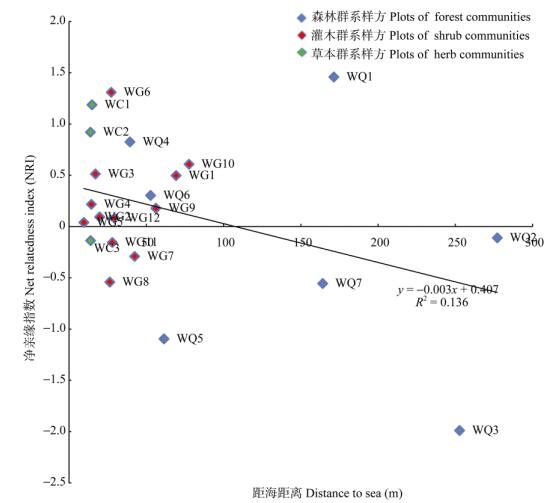
NRI与样方距海距离的一元回归分析表明(图 5), NRI与样方距海距离呈一定的线性关系,但不显著(P=0.09, R2=0.137)。森林群系WQ1、WQ4和WQ6样方的NRI大于0,其余样方NRI小于0,灌木群系WG7、WG8和WG11样方的NRI小于0, 其余9个样方NRI大于0。草本群系WC3样方的NRI略小于0,WC1和WC2的NRI大于0。
|
图 5 22个样方净亲缘指数(NRI)与距海距离散点图 Fig. 5 Scatter diagram of net relatedness index (NRI) and distance to sea in 22 plots |
Pearson相关性分析表明,22个样方的PD和NRI相关性不显著(P=0.452)。但控制变量SR后, 对PD和NRI进行偏相关分析表明,PD与NRI呈显著负相关(相关系数为-0.894, P < 0.001)。
4 讨论 4.1 蜈支洲岛植物系统发育多样性和系统发育结构本研究结果表明,森林群系WQ2、WQ3、WQ5和WQ7样方的系统发育多样性显著高于回归模型预测值,说明这4个样方中的植物类群间亲缘关系较远(图 4)。灌木群系中露兜树灌丛和草海桐灌丛系统发育多样性比苦郎树灌丛高,草本群系中厚藤灌草丛系统发育多样性高于单叶蔓荆灌草丛。灌木群系和草本群系样方大部分倾向于系统发育结构聚集,露兜树灌丛WG7样方、苦郎树灌丛WG8样方和厚藤灌草丛WC3样方、草海桐灌丛WG11样方的系统发育结构为很小程度的发散,接近中性随机。总体上可以看出灌木群落和草本群落系统发育结构倾向于聚集,而森林群系中,4个群系发散,3个聚集。森林群系中的WQ1、WQ4和WQ6样方以及灌草群系样方大多分布在蜈支洲岛的边缘,可能是靠近海洋,受到海风、盐雾等气候影响更大, 或者是这些样方位置更靠近人类活动区,人类干扰作为环境过滤器促使群落系统发育呈聚集。而森林群系WQ2、WQ3、WQ5和WQ7样方位于岛屿内陆距海较远的林中,也更加远离人类活动区,可能这些样方受到人为干扰和环境过滤影响程度比较低, 竞争排斥在群落构建中起主导作用(图 5)。这与Matos[1]在片段化热带雨林研究中报道的斑块群落边缘系统发育结构聚集,内部系统发育结构较为发散的规律有一致性。Li[5]的研究认为系统发育结构可以代替系统发育多样性,作为生物多样性保护优先次序的设定依据。本研究中代表系统发育结构的物种间净亲缘指数与系统发育多样性没有表现出显著的相关性,但在控制了物种多样性这个变量后,物种间净亲缘指数与系统发育多样性呈显著负相关。群落系统发育多样性与物种丰富度存在显著的线性关系,排除了物种多样性的影响后发现,系统发育多样性越大,群落的系统发育结构越趋向于发散,这与Li[5]的研究结论是符合的。但本研究样方数量有限,还需要更多的调查数据加以验证。
|
图 4 22个样方中物种丰富度(SR)与系统发育多样性(PD)散点图 Fig. 4 Scatter diagram of species richness (SR) and phylogenetic diversity (PD) in 22 plots |
一般来说,遗传距离比较远的种汇聚会导致较高的系统发育多样性和较为发散的系统发育结构, 这种群落在面对环境变化时有着更大的应对潜力。系统发育多样性和系统发育结构除了与群落的构建机制有关系,还有研究指出与群落环境因子、演替阶段、受干扰程度以及研究尺度有关[19-24]。而对于海岛这一特殊生态系统,目前大多是对海岛植物物种丰富度影响因素的研究[25-26],认为海岛植物物种多样性受到岛屿面积、纬度和隔离度影响较显著[27-32],但对于海岛植物系统发育多样性和系统发育结构及其影响因素的研究还很少,Weigelt等[33]研究表明, 海岛被子植物系统发育多样性与海岛隔离度呈正相关,而海岛棕榈科植物的系统发育多样性与海岛隔离度呈负相关。采集更多数据,进行不同尺度的研究,特别是比较研究不同面积、近陆距离、形成时间的海岛植物群落系统发育多样性和系统发育结构,将是非常有意义的。
4.2 蜈支洲岛植物多样性保护生物多样性保护常受到人力、资金和时间等限制,而且区域建设发展势必会对植被造成一定的影响,难以做到完全的保护。因此,如何对不同区域和生物类群设定保护优先次序,利用有限的资源更加高效地保护生物多样性,是保护生物学的关键问题[2, 6]。除了优先保护国家重点保护植物群落之外, 优先次序设定的另一个重要原则就是保存更多的变异信息,使得未来的预期生物多样性最大化[34]。早期的保护生物学家常以物种丰富度代表生物多样性,优先保护物种丰富度高的生物群落[35],但系统学的发展让我们认识到,生物类群在保护中的优先级不应是相等的,而要考虑类群的系统发育关系,优先保护类群间系统发育关系较远,即系统发育多样性高,系统发育结构较为发散的群落[36]。
尽管很多研究都表明物种丰富度与系统发育多样性呈线性关系,但二者也常表现出一定的差异,如在群落受到干扰或发生快速物种分化或灭绝时[37-41],物种丰富度不适宜单独作为植物保护优先性确定的标准[3]。例如本研究中,银合欢林WQ4样方的物种丰富度高于乌墨+台琼海桐林WQ3样方,但WQ3样方的系统发育多样性更高,而且系统发育结构发散,从这个方面来说,乌墨+台琼海桐林在植物保护工作中应优先于银合欢林。但WQ4样方中的海南龙血树属于国家Ⅱ级保护植物和IUCN易危物种,因此银合欢林和乌墨+台琼海桐林都需要注意保护。又如龙胆木林WQ5样方和榄仁树林WQ6样方的物种丰富度相同,但龙胆木林系统发育多样性较高,且系统发育结构发散,从系统发育角度来说应注意对龙胆木林的优先保护。本研究结果表明,环境过滤和人为影响可能导致植物群落由亲缘关系较近的物种构成,而环境和人为干扰较小的植物群落中的物种亲缘关系较远,因此,应尽量减少对植物群落的干扰,对于受环境影响严重的植物群落要注意养护。系统发育多样性和系统发育结构只是建议作为提出生物多样性保护策略的一个方面的参考,不同的环境因子适宜保护不同的群落,多样性低的群落可以通过演替、降低干扰程度或加强保护提高多样性,每个海岛也有各自不同的实际情况和用途。因此,保护工作中具体方案的提出,尚需要综合考虑各种因素。由于海岛生物多样性调查难度大,本研究样方的代表性有一定的局限性,但希望能为今后的海岛植物多样性研究和保护提供思路。
致谢: 感谢研究组成员参与蜈支洲岛植物调查,厦门大学郑文教教授、侯学良博士、欣玮玮指导协助调查和标本鉴定,中国科学院昆明植物研究所任宗昕博士和Donald Danforth植物科学中心的Steven Callen博士对文章给予建议,三亚蜈支洲岛旅游区工作人员大力协助。| [1] | MATOS F A R, MAGNAGO L F S, GASTAUER M, et al. Effects of landscape configuration and composition on phylogenetic diversity of trees in a highly fragmented tropical forest[J]. J Ecol, 2017, 105(1): 265-276. DOI:10.1111/1365-2745.12661 |
| [2] | PARDI F, GOLDMAN N. Resource-aware taxon selection for maximizing phylogenetic diversity[J]. Syst Biol, 2007, 56(3): 431-444. DOI:10.1080/10635150701411279 |
| [3] | FOREST F, GRENYER R, ROUGET M, et al. Preserving the evolu-tionary potential of floras in biodiversity hotspots[J]. Nature, 2007, 445(7129): 757-760. DOI:10.1038/nature05587 |
| [4] | PIO D V, BROENNIMANN O, BARRACLOUGH T G, et al. Spatial predictions of phylogenetic diversity in conservation decision making[J]. Conserv Biol, 2011, 25(6): 1229-1239. DOI:10.1111/j.1523-1739.2011.01773.x |
| [5] | LI R, KRAFT N J B, YU H Y, et al. Seed plant phylogenetic diversity and species richness in conservation planning within a global biodiversity hotspot in eastern Asia[J]. Conserv Biol, 2015, 29(6): 1552-1562. DOI:10.1111/cobi.12586 |
| [6] | MENDOZA A M, ARITA H T. Priority setting by sites and by species using rarity, richness and phylogenetic diversity:The case of neotropical glassfrogs (Anura:Centrolenidae)[J]. Biodiv Conserv, 2014, 23(4): 909-926. DOI:10.1007/s10531-014-0642-5 |
| [7] | VOSKAMP A, BAKER D J, STEPHENS P A, et al. Global patterns in the divergence between phylogenetic diversity and species richness in terrestrial birds[J]. J Biogeogr, 2017, 44(4): 709-721. DOI:10.1111/jbi.12916 |
| [8] |
LI J S, XIE M Y, KONG F S. On the protection, restructure and exploitation of plant resources on coastal islands in Fujian[J].
Subtrop Plant Res Comm, 1994, 23(2): 56-60. 李金算, 谢美云, 孔繁升. 试论福建海岛植物资源的保护、改造及合理开发利用[J]. 亚热带植物通讯, 1994, 23(2): 56-60. |
| [9] |
LIAO L Z, HUANG M Q, LIU Z H. Concept and planning for the ecological protection of vegetation on non-residential sea islands[J].
J Oceanogr Taiwan Strait, 2007, 26(3): 430-434. 廖连招, 黄明群, 刘正华. 厦门市无居民海岛植被生态保护方案与规划[J]. 台湾海峡, 2007, 26(3): 430-434. DOI:10.3969/j.issn.1000-8160.2007.03.018 |
| [10] |
Editorial Board of the Report of National Island Resources Comprehensive Investigation.
Report of the National Island Resources Comprehensive Investigation[M]. Beijing: Ocean Press, 1996: 1-235.
《全国海岛资源综合调查报告》编写组. 全国海岛资源综合调查报告[M]. 北京: 海洋出版社, 1996: 1-235. |
| [11] |
WU D L, XING F W, LI Z X, et al.
A Checklist of Flowering Plants of Islands and Reefs of Hainan and Guangdong Province[M]. Beijing: Science Press, 1994: 1-334.
吴德邻, 邢福武, 李泽贤, 等. 海南及广东沿海岛屿植物名录[M]. 北京: 科学出版社, 1994: 1-334. |
| [12] |
Ocean Department of Hainan Province, Leading Group of Island Resources Comprehensive Investigation in Hainan Province.
Report of Island Resources Comprehensive Investigation and Research in Hainan Province[M]. Beijing: Ocean Press, 1999: 1-1174.
海南省海洋厅, 海南省海岛资源综合调查领导小组办公室. 海南省海岛资源综合调查研究专业报告集[M]. 北京: 海洋出版社, 1999: 1-1174. |
| [13] |
Editorial Board of Vegetation in China.
Vegetation in China[M]. Beijing: Science Press, 1980: 1-1382.
中国植被编委会. 中国植被[M]. 北京: 科学出版社, 1980: 1-1382. |
| [14] | WEBB C O, DONOGHUE M J. Phylomatic:Tree assembly for applied phylogenetics[J]. Mol Ecol Notes, 2005, 5(1): 181-183. DOI:10.1111/j.1471-8286.2004.00829.x |
| [15] | ZANNE A E, TANK D C, CORNWELL W K, et al. Three keys to the radiation of angiosperms into freezing environments[J]. Nature, 2014, 506(7486): 89-92. DOI:10.1038/nature12872 |
| [16] | FAITH D P. Conservation evaluation and phylogenetic diversity[J]. Biol Conserv, 1992, 61(1): 1-10. DOI:10.1016/0006-3207(92)91201-3 |
| [17] | WEBB C O, ACKERLY D D, KEMBEL S W. Phylocom:Software for the analysis of phylogenetic community structure and trait evolution[J]. Bioinformatics, 2008, 24(18): 2098-2100. DOI:10.1093/bioinformatics/btn358 |
| [18] |
Ministry of Environmental Protection of the People's Republic of China, Chinese Academy of Sciences. Red List of Biodiversity in China:Higher Plants[M]. Beijing:Ministry of Environmental Protection of the People's Republic of China, Chinese Academy of Sciences, 2013.
中华人民共和国环境保护部, 中国科学院. 中国生物多样性红色名录: 高等植物卷[M]. 北京: 中华人民共和国环境保护部, 中国科学院, 2013. |
| [19] | SWENSON N G, ENQUIST B J, THOMPSON J, et al. The influence of spatial and size scale on phylogenetic relatedness in tropical forest communities[J]. Ecology, 2007, 88(7): 1770-1780. DOI:10.1890/06-1499.1 |
| [20] | LETCHER S G. Phylogenetic structure of angiosperm communities during tropical forest succession[J]. Proc Roy Soc B Biol Sci, 2010, 277(1678): 97-104. DOI:10.1098/rspb.2009.0865 |
| [21] |
HUANG J X, ZHENG F Y, MI X C. Influence of environmental factors on phylogenetic structure at multiple spatial scales in an evergreen broad-leaved forest of China[J].
Chin J Plant Ecol, 2010, 34(3): 309-315. 黄建雄, 郑凤英, 米湘成. 不同尺度上环境因子对常绿阔叶林群落的谱系结构的影响[J]. 植物生态学报, 2010, 34(3): 309-315. DOI:10.3773/j.issn.1005-264X.2010.03.008 |
| [22] |
SONG K, MI X C, JIA Q, et al. Variation in phylogenetic structure of forest communities along a human disturbance gradient in Gutianshan forest, China[J].
Biodiv Sci, 2011, 19(2): 190-196. 宋凯, 米湘成, 贾琪, 等. 不同程度人为干扰对古田山森林群落谱系结构的影响[J]. 生物多样性, 2011, 19(2): 190-196. DOI:10.3724/SP.J.1003.2011.07030 |
| [23] |
LU M M, HUANG X C, CI X Q, et al. Phylogenetic community structure of subtropical forests along elevational gradients in Ailao Mountains of southwest China[J].
Biodiv Sci, 2014, 22(4): 438-448. 卢孟孟, 黄小翠, 慈秀芹, 等. 沿海拔梯度变化的哀牢山亚热带森林群落系统发育结构[J]. 生物多样性, 2014, 22(4): 438-448. DOI:10.3724/SP.J.1003.2014.14011 |
| [24] |
REN S Y, WANG T, ZHU Y, et al. Phylogenetic structure of individuals with different DBH sizes in a deciduous broad-leaved forest community in the temperate-subtropical ecological transition zone, China[J].
Biodiv Sci, 2014, 22(5): 574-582. 任思远, 王婷, 祝燕, 等. 暖温带-北亚热带过渡带落叶阔叶林群落不同径级系统发育结构的变化[J]. 生物多样性, 2014, 22(5): 574-582. DOI:10.3724/SP.J.1003.2014.14116 |
| [25] | TRIGAS P, PANITSA M, TSIFTSIS S. Elevational gradient of vascular plant species richness and endemism in Crete:The effect of postisolation mountain uplift on a continental island system[J]. PLoS One, 2013, 8(3) DOI:10.1371/journal.pone.0059425 |
| [26] | IRL S D H, HARTER D E V, STEINBAUER M J, et al. Climate vs. topography-spatial patterns of plant species diversity and endemism on a high-elevation island[J]. J Ecol, 2015, 103(6): 1621-1633. DOI:10.1111/1365-2745.12463 |
| [27] | JOHNSON M P, MASON L G, RAVEN P H. Ecological parameters and plant species diversity[J]. Amer Nat, 1968, 102(926): 297-30. DOI:10.1086/282544 |
| [28] | JOHNSON M P, SIMBERLOFF D S. Environmental determinants of island species numbers in the British Isles[J]. J Biogeogr, 1974, 1(3): 149-154. DOI:10.2307/3037964 |
| [29] | AMERSON Jr A B. Species richness on the nondisturbed northwestern Hawaiian Islands[J]. Ecology, 1975, 56(2): 435-444. DOI:10.2307/1934974 |
| [30] | MOODY A. Analysis of plant species diversity with respect to island characteristics on the Channel Islands, California[J]. J Biogeogr, 2000, 27(3): 711-723. DOI:10.1046/j.1365-2699.2000.00435.x |
| [31] | McMASTER R T. Factors influencing vascular plant diversity on 22 islands off the coast of eastern North America[J]. J Biogeogr, 2005, 32(3): 475-492. DOI:10.1111/j.1365-2699.2004.01200.x |
| [32] | WEIGELT P, KREFT H. Quantifying island isolation:Insights from global patterns of insular plant species richness[J]. Ecography, 2013, 36(4): 417-429. DOI:10.1111/j.1600-0587.2012.07669.x |
| [33] | WEIGELT P, KISSLING W D, KISEL Y, et al. Global patterns and drivers of phylogenetic structure in island floras[J]. Sci Rep, 2015, 5: 12213 DOI:10.1038/srep12213 |
| [34] | HARTMANN K, STEEL M. Maximizing phylogenetic diversity in biodiversity conservation:Greedy solutions to the Noah's Ark problem[J]. Syst Biol, 2006, 55(4): 644-651. DOI:10.1080/10635150600873876 |
| [35] | GASTON K J. Species richness:Measure and measurement[M]//GASTON K J. Biodiversity:A Biology of Numbers and Difference. Cambridge:Blackwell Science, 1996:77-113. |
| [36] | POSADAS P, MIRANDA E D R, CRISCI J V. Using phylogenetic diversity measures to set priorities in conservation:An example from southern South America[J]. Conserv Biol, 2001, 15(5): 1325-1334. DOI:10.1111/j.1523-1739.2001.99404.x |
| [37] | SAFI K, CIANCIARUSO M V, LOYOLA R D, et al. Understanding global patterns of mammalian functional and phylogenetic diversity[J]. Philos Trans Roy Soc B Biol Sci, 2011, 366(1577): 2536-2544. DOI:10.1098/rstb.2011.0024 |
| [38] | COCA M, PAUSAS J G. Regeneration traits are structuring phylogenetic diversity in cork oak (Quercus suber) woodlands[J]. J Veget Sci, 2009, 20(6): 1009-1015. DOI:10.1111/j.1654-1103.2009.01097.x |
| [39] | DEVICTOR V, MOUILLOT D, MEYNARD C, et al. Spatial mismatch and congruence between taxonomic, phylogenetic and functional diversity:The need for integrative conservation strategies in a changing world[J]. Ecol Lett, 2010, 13(8): 1030-1040. DOI:10.1111/j.1461-0248.2010.01493.x/full |
| [40] | DAVIES T J, BUCKLEY L B. Phylogenetic diversity as a window into the evolutionary and biogeographic histories of present-day richness gradients for mammals[J]. Philos Trans Roy Soc B Biol Sci, 2011, 366(1576): 2414-2425. DOI:10.1098/rstb.2011.0058 |
| [41] | SCHULDT A, BARUFFOL M, BRUELHEIDE H, et al. Woody plant phylogenetic diversity mediates bottom-up control of arthropod biomass in species-rich forests[J]. Oecologia, 2014, 176(1): 171-182. DOI:10.1007/s00442-014-3006-7 |
 2017, Vol. 25
2017, Vol. 25


