2. 广西壮族自治区亚热带作物研究所, 南宁 530001;
3. 玉林师范学院, 广西 玉林 537000
2. Guangxi Subtropical Crops Research Institute, Nanning 530001, China;
3. Yulin Normal University, Yulin 537000, Guangxi, China
秋枫(Bischofia javanica)是大戟科(Euphorbiaceae)秋枫属的常绿大乔木[1],是我国重要的园林绿化树种,主要分布于我国滇、川、黔、桂、粤、闽、台[2], 在广西主要分布于梧州、大瑶山、天峨的南部及西部[3]。由于秋枫耐水湿、耐火、抗风,故也常用于生态公益林、防风林[4]。其木材可应用于建筑、家具、造船等行业;果实可食用,也可酿酒;根、树皮和叶均具一定药用价值,经济价值和开发价值颇高。目前,国内外对秋枫的研究主要集中于抗逆性[3]、光合特性[5]、生物学研究[6]、抗菌活性[7]、化学成分[8]等方面。大量研究表明, 中等强度的光照有利于木本植物幼苗的生长[9],而过强的光照对幼苗生长则有一定抑制作用[10-11],因此适宜的遮荫能够促进植物的生长[12],对秋枫幼苗的耐荫性研究尚未见报道。本文通过对夏季1年生秋枫幼苗在不同遮荫程度下的生理指标测定,对秋枫的耐荫性进行初步探讨,为秋枫苗木繁育生产中遮荫程度合理设置提供理论依据和实践指导。
1 材料和方法 1.1 材料试验所用秋枫(Bischofia javanica)幼苗由广西壮族自治区良凤江国家森林公园提供。2012年5月选长势良好、长势一致(高约5 cm)的出芽约1周的秋枫幼苗,并将其移栽于20 cm (直径)×36 cm (高)的试验盆中,每盆1株,移栽后正常的管理养护。60 d后,选生长状况一致[(苗高(15±0.5) cm、地径(3.1±0.1) mm)]、无病虫害的秋枫幼苗120盆进行遮荫试验处理。
1.2 方法将秋枫幼苗随机分成4组,分别给以全光照[(100%NS (Natural sunshine)透光率)]、一层遮荫(41.3%NS透光率)、二层遮荫(14.3%NS透光率)和三层遮荫(3.6%NS透光率)处理,采用LI-6400XT便携式光合作用测定仪测定透光率,为保证遮荫效果,遮荫棚四周用遮荫网围住[13]。每处理之间相隔0.5 m, 每处理占地10 m×1.5 m,以避免边缘效应和重复遮荫,每周1次调整盆的位置以保证处理内各盆获得的遮荫效果一致。150 d后对秋枫幼苗叶片的叶绿素、相对电导率、丙二醛含量(MDA)、游离脯氨酸含量(Pro)、可溶性糖含量和可溶性蛋白质含量及SOD、CAT活性、叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)进行测定,参照刘思祝[13]和李玲[14]的方法测定。
1.3 数据分析采用Microsoft Excel 2007软件、SPSS 18.0软件等进行试验数据的统计检验,方差分析采用LSD多重比较方法进行。
2 结果和分析 2.1 遮荫对叶片膜系统的影响电导率 由表 1可以看出,遮荫处理间的秋枫幼苗叶片相对电导率存在显著差异(P < 0.05),且随着遮荫程度的加重,相对电导率呈先降后升的趋势,在全光照(100%NS)下最大,分别为41.3%NS、14.6%NS、3.6%NS遮荫处理的1.826、1.682、1.551倍。经多重比较分析,全光照(100%NS)的细胞膜透性与其他遮荫处理间均存在极显著差异(P < 0.01); 41.3%NS与14.6%NS间不存在显著差异(P > 0.05), 与3.6%NS间存在显著差异(P < 0.05);14.6%NS与3.6%NS间差异不显著(P > 0.05)。这表明适度遮荫减少了秋枫叶片细胞质膜伤害。
| 表 1 遮荫对秋枫幼苗叶片相对电导率、丙二醛含量和CAT、SOD活性的影响 Table 1 Effect of shading on relative conductivity, MDA content, and CAT, SOD activities of Bischofia javanica seedlings |
丙二醛含量 不同遮荫处理对秋枫幼苗叶片MDA含量的影响极显著(P < 0.01)。随着光照强度的降低,秋枫幼苗叶片MDA含量呈先降低后上升的变化趋势,在41.3%NS遮荫下,MDA含量最小,100%NS的MDA含量最高。100%NS下的MDA含量与遮荫处理间存在极显著差异(P < 0.01); 41.3%NS与14.6%NS间差异不显著(P > 0.05),与3.6%NS间存在显著差异(P < 0.05);14.6%NS与3.6%NS间差异不显著(P > 0.05)(表 1)。这说明适度遮荫处理减少了秋枫叶片生物膜伤害。
2.2 遮荫对抗氧化酶活性的影响超氧化物歧化酶(SOD)活性 秋枫幼苗叶片的SOD酶活性随着遮荫强度的加强而不断下降。方差分析表明,秋枫幼苗叶片SOD酶活性在不同遮荫处理间呈极显著差异(P < 0.01)。经多重比较分析, 全光照(100%NS)的SOD活性与遮荫处理的差异极显著(P < 0.01);41.3%NS与14.6%NS、3.6%NS间的差异极显著(P < 0.01);14.6%NS与3.6%NS间差异不显著(P > 0.05) (表 1)。
过氧化氢酶(CAT)活性 秋枫幼苗叶片的CAT活性随着遮荫程度的加强先降后升,以41.3%NS下的最小,全光照(100%NS)下的最大。方差分析表明,秋枫幼苗叶片的CAT活性在不同遮荫程度下存在极显著差异(P < 0.01),全光照(100%NS)的CAT活性与遮荫处理间存在极显著差异(P < 0.01), 41.3%NS与14.6%NS、3.6%NS间的差异极显著(P < 0.01),14.6%NS与3.6%NS间的差异显著(P < 0.05) (表 1)。
2.3 遮荫对渗透调节物质含量的影响可溶性糖含量 秋枫幼苗叶片的可溶性糖含量随遮荫强度的增强呈先升再降的趋势,为100%NS < 3.6%NS < 14.6%NS < 41.3%NS,处理间差异极显著(P < 0.01)。全光照下秋枫幼苗叶片的可溶性糖含量与41.3%NS、14.6%NS、3.6%NS间的差异显著(P < 0.05),41.3%NS、14.6%NS、3.6%NS间的差异极显著(P < 0.01)。表明适度遮阴处理对秋枫碳水化合物积累具有促进作用。
可溶性蛋白质含量 秋枫幼苗叶片的可溶性蛋白质含量在不同遮荫处理间存在显著差异(P < 0.05),随着遮荫强度的加强而减少,可溶性蛋白质含量为100%NS > 41.3%NS > 14.6%NS > 3.6%NS。41.3%NS、14.6%NS、3.6%NS遮荫处理分别为100%NS全光照处理的97%、93%、89%。全光照(100%NS)与41.3%NS处理的可溶性蛋白含量差异显著(P < 0.05)、与14.6%NS、3.6%NS间的差异极显著(P < 0.01); 41.3%NS与14.6%NS间的差异显著(P < 0.05), 与3.6%NS间的差异极显著(P < 0.01); 14.6%NS与3.6%NS间的差异极显著(P < 0.01)(表 2)。可见, 遮荫对秋枫幼苗叶片中可溶性蛋白质含量有一定影响。
| 表 2 遮荫对秋枫幼苗叶片可溶性糖与可溶性蛋白含量的影响 Table 2 Effects of shading on contents of soluble sugar and soluble protein in leaves of Bischofia javanica seedlings |
由表 3可知,随着遮荫程度的增加,叶绿素a、叶绿素b及叶绿素总量均表现出先增加后减少的变化趋势,遮荫处理(41.3%NS、14.6%NS、3.6%NS)的叶绿素含量均远高于全光照的,且以14.6%NS的最大。光照对秋枫幼苗叶片叶绿素a、叶绿素b及叶绿素总量有影响,100%NS的叶绿素a含量与遮荫处理间存在极显著差异(P < 0.01);41.3%NS与14.6%NS、3.6%NS间存在极显著差异(P < 0.01); 14.6%NS与3.6%NS存在显著差异(P < 0.05)。100%NS的叶绿素b含量与遮荫处理间存在极显著差异(P < 0.01);41.3%NS与14.6%NS间存在极显著差异(P < 0.01), 与3.6%NS间的差异不显著(P > 0.05); 14.6%NS与3.6%NS间的差异极显著(P < 0.01)。100%NS的叶绿素总量与遮荫处理间的差异均极显著(P < 0.01)。
| 表 3 遮荫对秋枫叶片叶绿素含量的影响 Table 3 Effect of shading on content of chlorophyll in leaves of Bischofia javanica seedlings |
采用非直线双曲线模型[15]对秋枫幼苗进行光响应曲线拟合(图 1)。由表 4可知,秋枫幼苗的Pmax、LCP、LSP、Rd均随着遮荫程度的增加而降低,AQY在41.3%NS下最大,对光能的利用效率最高,说明秋枫幼苗对遮荫有一定适应性,通过降低LCP,在较弱的光照下能达到平衡并积累有机物质,降低LSP, 使其在更低的光照下也可达到最大净光合速率,同时通过降低Rd,减少夜间有机物质的消耗, 从而最大限度地积累有机物。
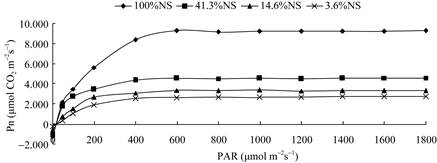
|
图 1 不同光照条件下秋枫幼苗光响应曲线。Pn:净光合速率; PAR:光合有效辐射。 Fig. 1 Photoresponse curve of Bischofia javanica seedlings under shading. Pn: Net photosynthetic rate; PAR: Photosynthetic active radiation. |
| 表 4 不同光照条件下秋枫幼苗光合参数 Table 4 Photosynthetic parameters of Bischofia javanica seedlings under shading |
由图 2可知,秋枫幼苗的净光合速率(Pn)日变化呈双峰型曲线,4种处理均在12:00达到第1个峰值,Pn随遮荫度程度的增加而减小;4种处理在14:00均达到谷底,Pn随遮荫程度增加而增加;全光照处理在16:00达到第2个峰值,3种遮荫处理则在17:00达到第2个峰值,Pn值随着遮荫程度增加而减小。100%NS、41.3%NS、14.6%NS和3.6%NS处理的Pn平均值分别为1.965、2.002、1.760和1.549 μmol CO2 m-2s-1,全光照与41.3%NS、14.6%NS间差异不显著(P > 0.05),与3.6%NS间的差异极显著(P < 0.01); 41.3%NS与14.6%NS间的差异显著(P < 0.05), 与3.6%NS的差异极显著(P < 0.01); 14.6%NS与3.6%NS的差异不显著(P > 0.05)。这表明秋枫虽喜光,光照越强Pn越大,但过强的光照可能产生光抑制现象,适度遮荫反而更有利于秋枫有机物质的积累。
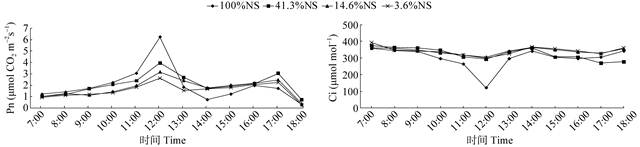
|
图 2 遮荫对秋枫幼苗净光合速率(Pn)日变化和胞间CO2浓度(Ci)日变化的影响 Fig. 2 Daily variation in net photosynthetic rate (Pn) and intercellular CO2concentration (Ci) of Bischofia javanica seedlings under shading |
胞间CO2浓度(Ci)与植物净光合速率(Pn)密切相关,一定程度上反映了植物光合效率的高低。秋枫幼苗叶片的Ci与Pn呈负相关。多重比较表明, 100%NS与41.3%NS的Ci存在显著差异(P < 0.05),与14.6%NS、3.6%NS间的差异极显著(P < 0.01); 41.3%NS与14.6%NS、3.6%NS间的差异不显著(P > 0.05);14.6%NS与3.6%NS间不存在显著差异(P > 0.05)。
2.7 遮荫对气孔导度(Gs)和蒸腾速率(Tr)的影响由图 3可看出,在不同遮荫条件下,秋枫幼苗的气孔导度(Gs)日变化与蒸腾速率(Tr)日变化趋势基本一致。在100%NS和41.3%NS下, Gs和Tr呈双峰曲线,100%NS下Gs和Tr均在12:00、16:00达到峰值,41.3%NS下在10:00、14:00达到峰值。14.6%NS、3.6%NS处理呈单峰曲线,均在14:00达到峰值。100%NS下Gs和Tr在14:00时达到谷底,说明由于气孔的关闭引起净光合速率(Pn)降低。
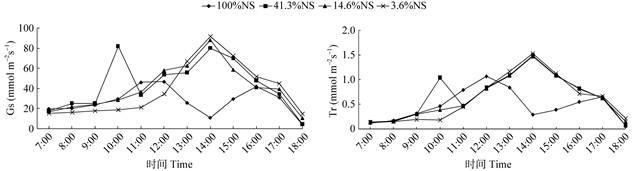
|
图 3 遮荫对秋枫幼苗气孔导度(Gs)和蒸腾速率(Tr)日变化的影响 Fig. 3 Daily variation in stomatal conductance (Gs) and transpiration rate (Tr) in Bischofia javanica seedlings under shading |
经多重比较,100%NS的Gs与41.3%NS、14.6%NS、3.6%NS的存在极显著差异(P < 0.01), 41.3%NS与14.6%NS、3.6%NS间存在极显著差异(P < 0.01),14.6%NS与3.6%NS间的差异不显著(P > 0.05)。多重比较表明,100%NS下的Tr与41.3%NS、14.6%NS的存在极显著差异(P < 0.01), 与3.6%NS的差异不显著(P > 0.05);41.3%NS与14.6%NS间的差异不显著(P > 0.05),与3.6%NS存在极显著差异(P < 0.01);14.6%NS与3.6%NS的差异不显著(P > 0.05)。
3 讨论和结论光照是植物必需的环境因子之一,对植物的生长发育、生理生化及形态建成有着非常重要的影响。通过遮荫对光照强度进行人工控制会对植物产生深刻的影响。
相对电导率常代表植物细胞膜透性的大小[16], 能够反映植物叶片的相对外渗率,相对导电率越大,说明组织渗出液越多,质膜透性越大,也就反映了植物受到伤害的程度越深[17]。植物膜脂过氧化的主要产物为丙二醛(MDA),MDA的产生、积累会导致膜脂过氧化加剧,从而破坏植物膜脂。MDA可以反映植物膜脂过氧化的程度,是间接测定膜系统受损程度的重要指标[18]。植物生理学中常用MDA含量来衡量膜脂过氧化程度的大小[19]。无论是强光还是弱光胁迫,都会加剧植物的叶片细胞膜脂过氧化,导致MDA的积累,引起质膜透性增大[20]。秋枫幼苗叶片的相对电导率和MDA含量随遮荫程度的加重呈先降后升的趋势,二者在100%NS下远大于遮荫处理,均以41.3%NS处理的最低。这表明在透光率为41.3%NS时,秋风幼苗叶片的细胞膜透性和质膜氧化程度最小,不遮荫处理的细胞膜透性和质膜氧化程度最大,适度遮荫对于秋枫幼苗叶片细胞的膜系统起到一定保护作用。
正常状态下,植物细胞内活性氧自由基产生和清除能力处于平衡状态。但当植物受逆境胁迫(强光、弱光、干旱等)时,平衡状态被打破,活性氧自由基就会在细胞内积累,而SOD的作用就是清除植物细胞内的超氧自由基,同时产生歧化产物H2O2,避免超氧自由基对细胞膜的伤害[18];CAT的作用是在植物的微体内催化过氧化氢分解为水和分子氧,其还与生长素、还原型辅酶Ⅰ(NADH)、还原型辅酶Ⅱ(NADPH)的氧化作用有关[21]。因此,植物抗逆性的大小常与抗氧化酶活性息息相关,植物对逆境的应激反应一般表现为提高抗氧化酶(SOD、CAT等)活性以消除活性氧自由基的积累,保护膜结构[22-23]。本研究结果表明,秋枫幼苗叶片的SOD活性为100%NS > 41.3%NS > 14.6%NS > 3.6%NS, CAT活性为100%NS > 3.6%NS > 14.6%NS > 41.3%NS, 均表现为遮荫处理的活性弱于全光照的,说明适度遮荫有利于秋枫幼苗细胞膜结构免于活性氧自由基的破坏。CAT活性和SOD活性在不同遮荫处理下的表现不同,其中SOD活性在3.6%NS遮荫处理下最弱,CAT活性在41.3%NS遮荫处理下最弱,这可能是过度遮荫同样会对秋枫幼苗产生胁迫,因此需要提高CAT活性来削减对细胞的伤害;而SOD在3.6%NS遮荫处理下活性最低,可能原因是由于过度遮荫导致膜脂过氧化加剧,从而影响了SOD合成所需蛋白质的合成。
可溶性糖以及可溶性蛋白质均为植物细胞中重要的渗透调节物质。光照是影响植物光合作用的重要环境因子,光照强度影响着植物干物质积累的量。可溶性糖是植物光合作用的主要产物,大部分可溶性糖会被转化为多糖(淀粉的形式)贮存起来, 给植物细胞的生理代谢提供能源。在受到逆境胁迫时, 可溶性糖含量会提高以稳定细胞代谢,为维持植物细胞渗透压起着重要作用。因而可溶性糖含量一定程度上反映了植物对逆境环境的适应能力[24-25]。当秋枫幼苗受到遮荫时,影响了可溶性糖转化为淀粉的速率,从而导致叶片可溶性糖含量显著提高。全光照条件下,秋枫幼苗可溶性糖转化为淀粉的速率相对较高,且存在光抑制现象,从而使得细胞可溶性糖含量相对其他处理最低;适度遮荫处理后,光抑制缓解或消除,光强成为光合作用主要影响因素, 遮荫程度越厉害,其光合速率越低,产生的可溶性糖也越少。可溶性蛋白质不仅是植物细胞内的渗透调节物质,其含量影响细胞的保水能力, 维持在一定水平有利于提高植物的抗逆性,对细胞的生命物质及生物膜起到保护作用。同时,可溶性蛋白质也是植物光合作用产物之一,即植物的营养物质,含量的高低与植物光合作用的强度有关[26]。本研究中可溶性蛋白质含量随遮荫程度的加重而减少,说明秋枫幼苗叶片中的可溶性蛋白质对光照强度反应较敏感,遮荫过度会影响光合作用,从而抑制生长发育。
本研究结果表明,秋枫幼苗有明显的午休现象,其净光合速率(Pn)日变化表现为双峰型曲线。虽然其最大净光合速率在遮荫下小于全光照的,但日均Pn为41.3%NS > 100%NS > 14.6%NS > 3.6%NS,可能是全光照下高温高湿对秋枫幼苗形成胁迫,而遮荫可以缓解或消除这种胁迫,一定的遮荫反而更加有利于其生长。秋枫幼苗的气孔导度(Gs)日变化呈现双峰型和单峰型,日均Gs以41.3%NS > 14.6%NS > 3.6%NS > 100%NS。这可能是100%NS下气温和叶片温度都相对较高,Gs直接影响着蒸腾速率(Tr), 为了避免过分蒸腾而失水,其Gs必须相应减小。秋枫幼苗的Tr日变化与Gs日变化趋势一致,说明Tr主要受气孔导度的影响,气孔是植物与外界CO2和水分交流的主要通道,气孔导度增大,植物光合作用碳获得增加,但同时蒸腾作用失水会加快,因此气孔导度的大小对光合作用和蒸腾作用的平衡有着极其重要的意义。胞间CO2浓度(Ci)日变化与Pn日变化趋势相反,Ci日平均值为100%NS > 41.3%NS > 4.6%NS > 3.6%NS。秋枫的Pn升高时, 其细胞间的CO2则相对减少。
植物光合速率发生午休现象的主要原因分为两种:气孔限制以及非气孔限制,主要通过Ci和GS的变化来判断[27]。本研究中4种光照处理的秋枫幼苗均在14:00左右出现午休现象,100NS处理的秋枫幼苗Ci升高而GS下降,说明主要原因是气孔限制,41.3%NS、14.6%NS和3.6%NS处理的Ci下降而GS上升,则说明植物光合速率降低的主要原因是非气孔限制。
从光补偿点(LCP)、光饱和点(LSP)可以看出植物对弱光的利用率,植物的暗呼吸速率(Rd)是衡量植物消耗有机物质的重要指标。秋枫幼苗在遮荫处理半年后,LCP、LSP发生了转移,受遮荫影响, LSP明显下降,且光照越弱LSP越小,这是秋枫幼苗对遮荫环境的适应性反应,在光照不足时不仅通过降低LCP来利用弱光,提高光能利用率,同时也降低LSP,能够在较低的光照强度即达到最大净光合速率,为其生长最大限度地积累有机物。秋枫幼苗的Rd随着遮荫程度的加重而下降,这也说明秋枫幼苗对遮荫环境产生了适应性,通过降低Rd来减少夜间对有机物质的消耗。表观量子效率(AQY)的变化说明秋枫幼苗在一定的遮荫条件下对弱光的利用能力更高。本研究的AQY为0.039~0.062,与前人的研究结果[28-30]相似。
通过对秋枫幼苗LCP、LSP、Rd和AQY的综合分析表明,秋枫幼苗的LCP、LSP、Rd随着遮荫程度加重而下降,AQY比全光照下的增大。遮荫会降低秋枫幼苗最大净光合速率,同时LCP、LSP也降低,因而在光照强度降低时也能很好的利用光能,Rd降低也可以减少夜间有机物的消耗,这是秋枫幼苗对遮荫的适应性反应。在41.3%NS光照下,秋枫幼苗的表观量子效率最大,对光能的利用效率高, 说明41.3%NS更有利于夏季秋枫幼苗的生长。
| [1] |
Delectis Flora Reipublicae Popularis Sinicae Agendae Academiae Sinicae Edita.
Flora Reipublicae Popularis Sinicae, Tomus 44(1)[M]. Beijing: Science Press, 1999: 185.
中国科学院中国植物志编辑委员会. 中国植物志, 第44卷第1分册[M]. 北京: 科学出社, 1999: 185. |
| [2] |
KE H, ZHUANG X Y, LIANG Z Q, et al. Study on salinity tolerance of seven gardening tree species in south China[J].
Guangdong Landsc Arch, 2010, 32(6): 62-65. 柯欢, 庄雪影, 梁珍琦, 等. 7个华南园林树种的耐盐性研究[J]. 广东园林, 2010, 32(6): 62-65. DOI:10.3969/j.issn.1671-2641.2010.06.015 |
| [3] |
OU Y T, ZHONG M J, LI H S. The layout for preservation and enhancing of the first ancient Bischofia polycarpa in Dongguan City, Guangdong Province[J].
J Agro-Environ Sci, 2007, 26(S2): 756-759. 欧应田, 钟孟坚, 黎华寿. 广东东莞市千年古秋枫保护的生态环境分析与环境改造方案[J]. 农业环境科学学报, 2007, 26(S2): 756-759. |
| [4] |
CHEN D R. Dillenia turbinata, Bischofia javanica, Albizia lebbeck, Falcataria moluccana[J].
Guangdong Landsc Arch, 2010, 32(2): 79-80. 陈定如. 大花五桠果、秋枫、大叶合欢、南洋楹[J]. 广东园林, 2010, 32(2): 79-80. DOI:10.3969/j.issn.1671-2641.2010.02.021 |
| [5] |
HUA L, HE Q, LI J Y, et al. Comparison of the water consumption characteristics of Eucalyptus and Corymbia clone seedlings and the local indigenous tree species Bischofia javanica[J].
Chin J Appl Ecol, 2014, 25(6): 1639-1644. 华雷, 何茜, 李吉跃, 等. 桉树无性系和华南乡土树种秋枫苗木耗水特性的比较[J]. 应用生态学报, 2014, 25(6): 1639-1644. |
| [6] |
XUE H G, ZHOU S D, WANG Q, et al. Chromosome number of Bischofia (Euphorbiaceae) and its evolutionary implications[J].
Acta Bot Yunnan, 2007, 29(2): 193-197. 薛恒钢, 周颂东, 王强, 等. 秋枫属的染色体数目及其进化意义[J]. 云南植物研究, 2007, 29(2): 193-197. DOI:10.3969/j.issn.2095-0845.2007.02.012 |
| [7] | KHAN M R, KIHARA M, OMOLOSO A D. Anti-microbial activity of Bidens pilosa, Bischofia javanica, Elmerillia papuana and Sigesbekia orientalis[J]. Fitoterapia, 2001, 72(6): 662-665. DOI:10.1016/S0367-326X(01)00261-1 |
| [8] | TANAKA T, NONAKA G I, NISHIOKA I, et al. Bischofianin, a dimeric dehydroellagitannin from Bischofia javanica[J]. Phyto-chemistry, 1995, 38(2): 509-513. DOI:10.1016/0031-9422(94)00670-O |
| [9] |
YAN X F, CAO M. Effects of forest gap on the seedling growth of a canopy tree species Pometia tomentosa in tropical rainforest of Xishuangbanna[J].
Chin J Appl Ecol, 2008, 19(2): 238-244. 闫兴富, 曹敏. 林窗对热带雨林冠层树种绒毛番龙眼幼苗生长的影响[J]. 应用生态学报, 2008, 19(2): 238-244. |
| [10] |
WANG B Y, FENG Y L. Effects of growth light intensities on photo-synthesis in seedlings of two tropical rain forest species[J].
Acta Ecol Sin, 2005, 25(1): 23-30. 王博轶, 冯玉龙. 生长环境光强对两种热带雨林树种幼苗光合作用的影响[J]. 生态学报, 2005, 25(1): 23-30. DOI:10.3321/j.issn:1000-0933.2005.01.005 |
| [11] |
LIU P, KANG H J, ZHANG Z X, et al. Responses of growth and chlorophyll florescence of Emmenopterys henryi seedlings to different light intensities[J].
Acta Ecol Sin, 2008, 28(11): 5656-5664. 刘鹏, 康华靖, 张志详, 等. 香果树(Emmenopterys henryi)幼苗生长特性和叶绿素荧光对不同光强的响应[J]. 生态学报, 2008, 28(11): 5656-5664. DOI:10.3321/j.issn:1000-0933.2008.11.051 |
| [12] |
SONG X L, YANG H Y, ZENG L Q, et al. Study on the shading impact on plant[J].
N Hort, 2009(5): 129-133. 宋晓蕾, 杨红玉, 曾黎琼, 等. 植物遮荫效应的研究进展[J]. 北方园艺, 2009(5): 129-133. |
| [13] |
LIU S Z. Research in growth characteristics of Syzygium hancei seedlings under different sunlight[D]. Nanning:Guangxi University, 2012:1-66. doi:10.7666/d.y2160976.
刘思祝. 不同光照条件下红鳞蒲桃幼苗生长特性研究[D]. 南宁: 广西大学, 2012: 1-66. doi: 10.7666/d.y2160976. http://cdmd.cnki.com.cn/Article/CDMD-10593-1012495418.htm |
| [14] |
LI L.
Experimental Instruction of Plant Plant Physiology Physiology[M]. Beijing: Science Press, 2009: 50-98.
李玲. 植物生理学模块实验指导[M]. 北京: 科学出版社, 2009: 50-98. |
| [15] |
LIU Y F, XIAO L T, TONG J H, et al. Primary application on the non-rectangular hyperbola model for photosynthetic light-response curve[J].
Chin Agri Sci Bull, 2005, 21(8): 76-79. 刘宇锋, 萧浪涛, 童建华, 等. 非直线双曲线模型在光合光响应曲线数据分析中的应用[J]. 中国农学通报, 2005, 21(8): 76-79. DOI:10.3969/j.issn.1000-6850.2005.08.021 |
| [16] |
ZHAGN X P, SUN T G, WANG Z Y, et al. Effects of hydrogen fluoride stress on chlorophyll fluorescence characteristics and conductance of Euphorbiaceae tree species[J].
For Environ Sci, 2016, 32(4): 38-43. 张学平, 孙同高, 王志云, 等. 氟化氢胁迫对大戟科苗木叶绿素荧光特性及电导率的影响研究[J]. 林业与环境科学, 2016, 32(4): 38-43. DOI:10.3969/j.issn.1006-4427.2016.04.008 |
| [17] |
LI M Y, WANG N, ZHOU Y, et al. Variation analysis of transient gene expression and growth, physiological indicators under drought stress in expressed LbDREB Populus ussuriensis Kom[J].
Bull Bot Res, 2016, 36(3): 409-415. 李墨野, 王娜, 周宇, 等. 干旱胁迫条件下转LbDREB基因大青杨瞬时基因表达及生长、生理指标变异分析[J]. 植物研究, 2016, 36(3): 409-415. DOI:10.7525/j.issn.1673-5102.2016.03.014 |
| [18] |
DU S N, BAI G S, LIANG Y L. Effects of soil moisture content and light intensity on the plant growth and leaf physiological characteristics of squash[J].
Chin J Appl Ecol, 2011, 22(4): 1101-1106. 杜社妮, 白岗栓, 梁银丽. 土壤水分和光照对西葫芦生长和生理特性的影响[J]. 应用生态学报, 2011, 22(4): 1101-1106. |
| [19] |
ZHOU S Y, JIAGN J, GAO L Y, et al. Effects of calcium on anti-oxidant enzymes and membrane lipid peroxidation of Brazil banana seedling under NaCl stress[J].
SW China J Agri Sci, 2014, 27(6): 2354-2359. 周双云, 蒋晶, 高龙燕, 等. 钙对盐胁迫下巴西蕉幼苗膜脂过氧化和抗氧化酶的影响[J]. 西南农业学报, 2014, 27(6): 2354-2359. DOI:10.16213/j.cnki.scjas.2014.06.018 |
| [20] |
CHEN S Y. Injury of membrane lipid peroxidation to plant cell[J].
Plant Physiol Commun, 1991, 27(2): 84-90. 陈少裕. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯, 1991, 27(2): 84-90. |
| [21] |
HE A N, LIN W Q, YAO Y. Effect of shading on the photosynthetic characteristics of Saxifrage stolonifera Curt[J].
Bull Bot Res, 2012, 32(6): 657-661. 贺安娜, 林文强, 姚奕. 遮荫对虎耳草光合生理特性的影响[J]. 植物研究, 2012, 32(6): 657-661. |
| [22] |
WANG B S. Biological free radicals and membrane damage of plants[J].
Plant Physiol Commun, 1988(2): 12-16. 王宝山. 生物自由基与植物膜伤害[J]. 植物生理学通讯, 1988(2): 12-16. |
| [23] | HODGSON R A J, ORR G R, RAISON J K. Inhibition of photo-synthesis by chilling in the light[J]. Plant Sci, 1987, 49(2): 75-79. DOI:10.1016/0168-9452(87)90002-1 |
| [24] |
GAO W J, LI S F, CHANG S H, et al. The endogenous protective substances and their functional mechanisms in plant resistance to abiotic stress[J].
Plant Physiol Commun, 2006, 42(2): 337-342. 高武军, 李书粉, 常生辉, 等. 植物抵御非生物胁迫的内源性保护物质及其作用机制[J]. 植物生理学通讯, 2006, 42(2): 337-342. |
| [25] |
LI Y F. A preliminary study on the cold resistance of four species Jatropha seedlings[D]. Nanning:Guangxi University, 2010:4-21. doi:10.7666/d.y1739246.
李远发. 低温胁迫对四个不同种源麻风树幼苗生理特性的影响[D]. 南宁: 广西大学, 2010: 4-21. doi: 10.7666/d.y1739246. http://www.cqvip.com/QK/97059X/201105/38485659.html |
| [26] |
YANG S Y. The response of Ardisia mamillata Hance to different light intensities[D]. Ya'an:Sichuan Agricultural University, 2009:16-31.
阳圣莹. 虎舌红对不同光照强度的响应[D]. 雅安: 四川农业大学, 2009: 16-31. |
| [27] | FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Ann Rev Physiol, 1982, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [28] | PEÑUELAS J, FILELLA I, LLUSIÀ J, et al. Comparative field study of spring and summer leaf gas exchange and photobiology of the Mediterranean trees Quercus ilex and Phillyrea latifolia[J]. J Exp Bot, 1998, 49(319): 229-238. |
| [29] | LONG S P, HUMPHRIES S, FALKOWSKI P G. Photoinhibition of photosynthesis in nature[J]. Annu Rev Plant Physiol Mol Biol, 1994, 45: 633-662. DOI:10.1146/annurev.pp.45.060194.003221 |
| [30] |
YANG Y N, PAN Y Z, QI Y C, et al. Effect of shading on physiological and ecological characteristics of Osmanthus fragrans[J].
J Trop Sub-trop Bot, 2017, 25(1): 57-64. 杨亚男, 潘远智, 齐豫川, 等. 遮阴对四季桂生理生态特性的影响[J]. 热带亚热带植物学报, 2017, 25(1): 57-64. DOI:10.11926/jtsb.3634 |
 2017, Vol. 25
2017, Vol. 25


