衰老作为植物生长周期的最后阶段,是植物在长期进化过程中形成的适应性发展,具有重要的生物学意义[1]。但在农业生产上,水稻等禾谷类作物叶片的早衰,会缩短叶片的功能期和籽粒灌浆时间,使干物质的积累减少,影响籽粒的发育并最终导致产量的下降。因此,推迟叶片的衰老启动期或延缓其衰老,对于水稻产量的提高具有重要的意义[2]。
研究表明,植物的生长发育以及叶片的衰老都受到了植物激素的调控[3-4]。乙烯利作为重要的植物生长调节剂,可以通过释放乙烯,促进果实成熟和器官脱落,起到调控植株衰老的作用。Jing等[5]研究表明,外源施加一定浓度的乙烯利能够加速离体叶片中叶绿素和蛋白质的降解,加速叶片衰老的进程。而茉莉酸类化合物(JAs)作为广泛存在于植物体内的一类内源生长物质,能抑制叶绿素的合成和光合作用,促进叶片的衰老和果实的成熟[6]。其中,茉莉酸甲酯(MeJA)是JAs中最具代表性的一种, MeJA作为内源信号分子参与了植物众多的抗性反应,具有重要的胁迫应答和防御调控作用[7]。
抗坏血酸(AsA)作为一种重要的抗氧化剂,在植物体内合成可以直接参与活性氧的清除[8];在体外人工合成的外源抗坏血酸,喷施在植物体上可以抑制脂质过氧化,降低丙二醛含量,从而提高植物的抗氧化能力,延缓植物的衰老[9]。研究表明,在抗坏血酸的合成途径中,L-半乳糖-1, 4-内酯脱氢酶(GLDH)作为关键酶[10],在抗坏血酸含量的调节过程中起着重要作用[11]。目前,水稻的GHLD基因下调株系(GI-2) 已经成功构建,由于其GHLD基因的表达量下降,抗坏血酸的合成受到抑制,因此GI-2中抗坏血酸含量显著低于野生型水稻。本文以水稻株系中花11野生型(ZH-11) 及其抗坏血酸合成关键酶GLDH基因下调株系(GI-2) 为材料,通过测定乙烯利诱导下外源施加AsA与MeJA后水稻叶绿素含量、可溶性蛋白含量以及气体交换参数等指标,研究了AsA与MeJA对乙烯利诱导下水稻叶片早衰的影响,旨在为寻找延缓水稻衰老、提高水稻产量和品质的调节剂提供理论依据。
1 材料和方法 1.1 材料水稻(Oryza sativa)粳稻株系中花11 (ZH-11) 和ZH-11遗传背景下AsA (抗坏血酸)合成关键酶基因GLDH干涉株系GI-2。水稻种子从华南农业大学生命科学学院彭新湘教授实验室获得[12]。
1.2 水稻的培养与处理水稻种子(ZH-11,GI-2) 经5% (V/V)次氯酸钠溶液消毒15~20 min,置于超纯水中浸泡12 h,均播种于培养土上进行催芽及幼苗培养,培养室光强为100 μmol m-2s-1、光周期为16 h/8 h (光/暗)、温度为22℃。待幼苗长至约15 cm时,移栽至盛有试验田泥土的方形盆中,于室外进行常规的水肥管理。待水稻抽穗时,选取长势一致的植株,分别进行蒸馏水处理(CK,喷施蒸馏水)、乙烯利处理(喷施600 mg L-1乙烯利)、AsA处理(喷施600 mg L-1乙烯利和0.005%的AsA),以及MeJA处理(喷施600 mg L-1乙烯利和0.045 mmol L-1的MeJA)。所有喷施的溶液均以蒸馏水为溶剂,并添加等量无水乙醇作为助溶剂,添加等量0.05% (V/V)的吐温20作为粘着剂,喷施时间为中午12:00[13],持续处理20 d,以后每4 d取样1次。
1.3 基因表达量的测定取移栽后30 d的水稻叶片进行基因表达量的测定,GLDH基因引物序列为GLDH-F: 5′-CGGCG-GCATCATTCAGGTT-3′,GLDH-R: 5′-AAGCCCAC-AGCGAGCAAGATA-3′, 内参基因引物序列为OsUBQ-F: 5′-CCAGGACAAGATGATCTGCC-3′, OsUBQ-R: 5′-AAGAAGCTGAAGCATCCAGC-3′。使用7500 Real Time PCR System进行PCR,根据Kenneth等[14]的方法进行分析。
1.4 叶片抗坏血酸含量的测定参照Gillespie等[15]的方法,称取水稻剑叶0.1 g, 用1 mL预冷的6%三氯乙酸充分研磨、震荡混匀, 4℃、16200×g离心10 min,取上清液加入2 mL反应体系中,37℃水浴1 h,用分光光度计检测525 nm的吸光值,每次测定重复3次。
1.5 叶绿素含量的测定参照Arnon[16]的方法,称取水稻剑叶0.1 g,用10 mL的80%丙酮溶液充分研磨,置于摇床上震荡24 h,用分光光度计检测663 nm、645 nm的吸光值,每次测定重复3次。
1.6 叶片光合特性参数曲线于上午9:00-12:00,选取长势一致的两种株系植株各5株,使用LI-COR 6400便携式光合测定系统进行测定,叶室温度设置为30℃,光合有效辐射为800 μmol m-2s-1[17]。记录叶片的净光合速率(Net photosynthetic rate, Pn)、气孔导度(Stomatal conductance, Gs)、胞间CO2浓度(Intercellular CO2 concentration, Ci)以及蒸腾速率(Transpiration rate, Tr)等参数。
1.7 叶片Rubisco蛋白含量的测定称取水稻剑叶0.1 g,用2 mL的蛋白研磨缓冲液充分研磨、充分混匀,4℃、16200×g离心10 min,取上清液,加入等体积的2×蛋白质样品缓冲液, 充分混匀后沸水浴3~5 min,获得的样品进行SDS-page电泳分析。使用Bio-rad凝胶成像系统扫描成像并进行条带灰度分析。
1.8 数据分析采用Excel 2010进行数据处理,使用SPSS 19.0软件进行One-Way ANOVA方差分析, 差异显著性检测采用LSD法进行多重比较。
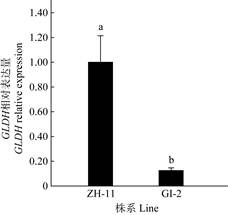
2 结果和分析 2.1 水稻叶片中GLDH基因表达量分析将水稻移栽至室外培养30 d后,对两种株系的水稻叶片进行RT-PCR实时定量检测,结果表明, 抗坏血酸合成关键酶基因GLDH在水稻GI-2中的表达量显著低于野生型水稻ZH-11,仅为野生型水稻ZH-11的13% (图 1),干涉型水稻GI-2确为GLDH基因下调株系。
|
图 1 移栽30 d后水稻叶片GLDH基因的相对表达量。柱上不同字母表示差异显著(P < 0.05)。下同 Fig. 1 GLDH relative expression in rice leaves transplanted after 30 days. The different letters upon column indicate significant difference at 0.05 level. The same is following Figures |
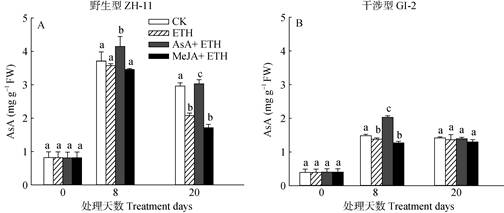
植物细胞内的抗坏血酸是一种抗氧化剂,能有效清除活性氧自由基。对水稻叶片中的抗坏血酸含量进行检测表明,野生型水稻ZH-11 (图 2: A)中的抗坏血酸含量始终高于干涉型水稻GI-2 (图 2: B)。喷施乙烯利后,两种株系水稻的抗坏血酸含量较对照均下降,且野生型水稻ZH-11的下降程度大于GI-2。在此基础上,补充外源AsA,两种株系水稻的抗坏血酸含量均得到较大回升,且干涉型GI-2比野生型ZH-11的上升幅度更大。其中,AsA处理8 d后,ZH-11与GI-2的抗坏血酸含量分别较乙烯利处理提高了16%与48%,达到显著差异(P < 0.05)。而在喷施乙烯利的基础上, 对野生型水稻ZH-11喷施MeJA,其抗坏血酸的含量显著下降, 处理20 d后低于乙烯利处理的18% (图 2: A);与野生型水稻ZH-11相比,干涉型GI-2中抗坏血酸含量在外源MeJA处理后无显著变化。
|
图 2 外源激素对乙烯利处理水稻叶片内抗坏血酸含量的影响 Fig. 2 Effects of exogenous hormones on AsA content in rice leaves treated by ethephon |
从图 3可见,处理20 d后对照与处理的叶片都出现了不同程度的黄化现象。与对照相比,乙烯利处理加剧了水稻ZH-11与GI-2叶片的黄化程度。在喷施乙烯利和AsA后,两种株系水稻的叶面均保持青绿色,黄化程度均小于乙烯利处理,且野生型ZH-11的黄化程度大于干涉型GI-2。而对乙烯利诱导下的ZH-11与GI-2施加MeJA后,两种株系水稻叶片都比乙烯利处理呈现明显的黄化现象,其中,ZH-11的叶片全面黄化失绿,而GI-2的叶面仅部分黄化、叶尖发黄,黄化程度小于ZH-11。

|
图 3 处理20 d后水稻叶片表型的变化。CK:对照; ETH:乙烯利; AsA:乙烯利+AsA; MeJA:乙烯利+ MeJA Fig. 3 Phenotype changes in rice leaves treated for 20 days. CK: Control; ETH: Ethephonr; AsA: Ethephonr+AsA; MeJA: Ethephonr+MeJA |
由表 1可知,野生型水稻ZH-11叶片的叶绿素含量始终高于干涉型GI-2,乙烯利处理两种株系水稻的叶绿素含量均显著下降,且ZH-11的下降幅度大于GI-2。乙烯利和AsA处理20 d后,叶绿素a、b的含量均较乙烯利处理有所增加,且叶绿素a的上升幅度大于叶绿素b,从而使叶绿素a/b上升, 叶片捕获和转化光能的能力有所增强,在一定程度上有利于光合作用的恢复。而乙烯利和MeJA处理则加剧了乙烯利对两种株系水稻的影响,进一步降低了水稻的叶绿素含量,不利于光合作用的正常进行。其中,野生型水稻ZH-11中叶绿素a、叶绿素b分别较乙烯利处理下降了38%与33%,达显著差异(P < 0.05),且下降的幅度均大于干涉型水稻GI-2 (分别比对照下降了34%与25%),说明外源MeJA对ZH-11叶绿素含量的影响大于GI-2。
| 表 1 不同处理对水稻叶片内叶绿素含量的影响 Table 1 Effects of exogenous hormones on content of chlorophyll in rice leaves treated by ethephon |
|
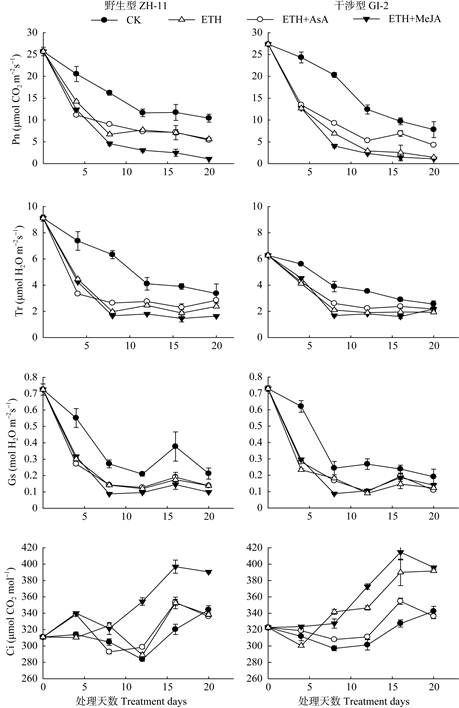
图 4 不同处理对水稻叶片光合性能的影响 Fig. 4 Effects of exogenous hormones treatments on characteristics of photosynthesis in rice leaves treated by ethephon |
从图 5可以看出,乙烯利处理后,ZH-11与GI-2叶片的净光合速率Pn、蒸腾速率Tr、气孔导度Gs均呈现下降趋势,且以处理0~8 d的下降较快。乙烯利和AsA处理4~20 d减缓了两种株系中Pn和Tr的下降速率,且Pn和Tr始终高于乙烯利处理, 但叶片的Gs没有显著变化。与乙烯利处理相比, MeJA处理加快了ZH-11与GI-2叶片气体交换参数的下降速率,其Pn和Tr始终低于乙烯利处理,但对GI-2中的气体交换参数无显著影响。随着处理时间的延长,两种株系叶片内胞间CO2浓度Ci均呈现出先上升后下降的趋势;在乙烯利处理后期,外源AsA的施加减缓了GI-2中Ci的上升速率,在处理后20 d降至对照的86%;而MEJA的处理则加快了两种株系叶片内Ci的上升速率,且对ZH-11的影响要大于GI-2,使得ZH-11内Ci的上升速率快于GI-2。
|
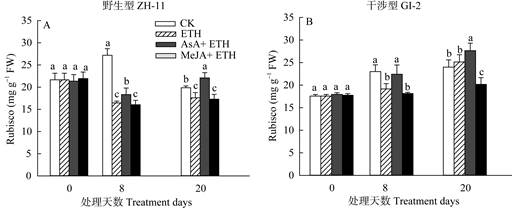
图 5 不同处理水稻叶片内Rubisco含量的影响 Fig. 5 Changes in content of Rubisco in rice leaves under different treatment |
植物叶片内的Rubisco (核酮糖-1, 5-二磷酸羧化酶/加氧酶)是光合作用中碳固定系统的关键酶, 其含量能有效反映碳固定系统的活性。Rubisco含量在ZH-11 (图 5: A)与GI-2 (图 5: B)中的无明显差异,乙烯利处理后,两株系的Rubisco含量均显著下降,且野生型ZH-11的下降幅度更大。乙烯利和AsA处理后,野生型水稻ZH-11的Rubisco含量显著提高,处理20 d后比乙烯利处理的提高了28%,而干涉型水稻GI-2比乙烯利处理的提高了25%。乙烯利和MeJA处理则显著降低了干涉型水稻GI-2的Rubisco含量,处理20 d后比乙烯利处理下降了14%,而野生型水稻ZH-11则无明显差异。
3 讨论叶片衰老是一种复杂的生理生化代谢过程,受到许多内外因子的共同调控[18]。刘道宏等认为,造成叶片衰老的主要原因是由于细胞中活性氧自由基的大量产生且不能被及时清除[19-20]。在细胞内活性氧的清除主要依靠酶促系统与非酶促系统,其中抗坏血酸在这两大系统中均发挥着重要的作用[21]。L-半乳糖途径作为抗环血酸合成的重要途径,其中的L-半乳糖酸-1, 4-内酯脱氢酶(GHLD)是该途径的限速酶,对抗坏血酸合成起到了重要的调节作用。本文通过对GHLD干涉型水稻GI-2进行实时荧光定量PCR分析,其GHLD基因的表达量显著性下调,这与抗坏血酸含量的测定结果相一致(图 2)。此外,在干涉型水稻GI-2中,叶绿素与Rubisco含量也始终低于野生型水稻ZH-11,使GI-2的衰老进程快于ZH-11,这可能与其细胞内抗坏血酸的含量不同有关。
乙烯利作为一种衰老促进素,可以抑制水稻叶片中叶绿素的合成和可溶性蛋白的产生,促进叶片的衰老进程[22-23]。本文选择600 mg L-1的乙烯利对水稻ZH-11与GI-2进行衰老诱导,结果其叶片的黄化进程加快,促进了叶片的提前衰老。在乙烯利诱导的同时,对水稻ZH-11与GI-2补充外源AsA后,其叶内的抗坏血酸含量均显著上升,且ZH-11的上升幅度大于GI-2,同时,外源AsA处理还提高了ZH-11与GI-2的叶绿素含量,使其叶片捕获、转化光能的能力上升,有利于其光合作用的正常进行。周小华等[24]的研究证实,外源AsA被叶片吸收后,可以直接参与ROS和H2O2的清除,对叶绿素等光合器官起到保护作用。与此同时,对ZH-11与GI-2进行外源MeJA的喷施,则显著降低了两株系的叶绿素含量,且对ZH-11的影响大于GI-2。有研究报道,高浓度的MeJA可以显著抑制超氧化物歧化酶(SOD)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)的活性,提高了叶片中H2O2含量,使细胞膜的受伤程度增加,从而促进叶绿素的降解[25-26]。
光合性能是衡量植物衰老的重要指标之一,随着叶片衰老进程的加剧,光合速率逐渐下降。而光合性能的下降主要受到了气孔因素(气孔导度)与非气孔限制因素(如叶绿体结构破坏、膜脂过氧化作用加强等)的影响[27]。本研究结果表明,在乙烯利诱导的同时,施加AsA处理后叶片净光合速率、蒸腾速率和胞间CO2浓度均有所提高,但气孔导度却没有明显变化。由此推断,外源AsA对叶片光合速率的影响,可能不是由于气孔导度的变化而产生的, 而是由于外源AsA对光合器官如叶绿体结构的保护而引起的[28],这与叶绿素含量的变化结果相一致。相反,外源MeJA处理破坏了叶片中叶绿素的结构,使其光合速率下降,加快了叶片的衰老进程[25], 且对野生型ZH-11的影响大于干涉型GI-2。
蛋白质是植物体内的重要组成成分,蛋白质降解尤其是可溶性蛋白的降解是叶片衰老的基本特征之一。Rubisco作为可溶性蛋白的重要组成部分, 是光合作用中决定碳同化速率的关键酶,其降解会导致光合能力的急剧下降,加快叶片的衰老进程[29]。本研究结果表明,喷施AsA后,水稻叶片中Rubisco含量显著高于单纯乙烯利处理的。Desimone等的研究表明,植物体内的活性氧是Rubisco降解的重要调节剂之一[30-31]。通过喷施外源抗氧化剂AsA,能够及时清除了叶内的活性氧自由基,减少了活性氧对Rubisco大亚基的攻击,使其结构稳定性增强, 从而增加Rubisco含量[32]。而外源MeJA处理则降低了ZH-11与GI-2叶片的Rubisco含量,可能是由于高浓度的MeJA抑制了叶片的双梭酸核酮糖梭化酶(RuBPcase)活性,使叶片Rubisco中大小亚基的合成受到了抑制,从而减少了Rubisco的积累[33]。
其中,外源AsA的补充对干涉型水稻GI-2的影响大于野生型水稻ZH-11,可能是由于GI-2中GLDH基因的下调,使其抗坏血酸的含量显著低于野生型ZH-11,处于抗坏血酸缺失状态,因此对外源AsA的补充具有更大的响应。而外源MeJA的处理对野生型水稻ZH-11的影响大于干涉型GI-2的原因,可能是由于外源MeJA会显著抑制APX的活性[26],APX作为植物体内抗坏血酸还原反应的催化剂,其活性极大地影响着抗坏血酸清除H2O2的能力[34]。其中,野生型ZH-11中含有更高的抗坏血酸含量,因此APX的活性受到MeJA的抑制后对ZH-11具有更大的影响。
综上所述,乙烯利诱导下,水稻叶片的衰老进程加快。外源AsA通过增加水稻叶片的抗坏血酸含量,增强了活性氧自由基ROS与H2O2的清除能力,延缓了叶绿素的降解与气体交换参数的下降速率, 提高了可溶性蛋白的含量,从而缓解了乙烯利诱导产生的水稻叶片早衰现象。相反,外源MeJA显著降低了叶内抗坏血酸的含量,使活性氧自由基不能及时的得到清除,破坏了叶绿体与细胞膜的结构, 使叶绿素的降解和气体交换参数的下降速率加快, 从而加剧了乙烯利诱导对水稻叶片衰老的影响。在农业生产上,可以在水稻处理后对其进行外源抗坏血酸的喷施,有利于缓解水稻叶片的早衰现象,促进水稻产量的提高。
| [1] |
ZHANG W X, PENG C R, HU S X, et al. Advances of research on early senescence of rice leaf and phytohormones regulation[J].
Acta Agri Jiangxi, 2007, 19(5): 27-31. 张文学, 彭春瑞, 胡水秀, 等. 水稻叶片早衰及其外源激素的调控研究进展[J]. 江西农业学报, 2007, 19(5): 27-31. DOI:10.3969/j.issn.1001-8581.2007.05.009 |
| [2] |
LU D Z, PAN Y C, MA Y F, et al. Physiological and biochemical studies on leaf senescence at heading and grain formation stage in hybrid rice[J].
Sci Agri Sin, 1988, 21(3): 21-26. 陆定志, 潘裕才, 马跃芳, 等. 杂交水稻抽穗结实期间叶片衰老的生理生化研究[J]. 中国农业科学, 1988, 21(3): 21-26. |
| [3] |
XU Z H, LI J Y. Plant hormones research in China:Past, present and future[J].
Chin Bull Bot, 2006, 23(5): 433-442. 许智宏, 李家洋. 中国植物激素研究:过去、现在和未来[J]. 植物学通报, 2006, 23(5): 433-442. |
| [4] |
GUO W Q, CHEN B L, LIU R X, et al. Effects of nitrogen application rate on cotton leaf antioxidant enzyme activities and endogenous hormone contents under short-term waterlogging at flowering and boll-forming stage[J].
Chin J Appl Ecol, 2010, 21(1): 53-60. 郭文琦, 陈兵林, 刘瑞显, 等. 施氮量对花铃期短期渍水棉花叶片抗氧化酶活性和内源激素含量的影响[J]. 应用生态学报, 2010, 21(1): 53-60. |
| [5] | JING H C, SCHIPPERS J H M, HILLE J, et al. Ethylene-induced leaf senescence depends on age-related changes and OLD genes in Arabidopsis[J]. J Exp Bot, 2005, 56(421): 2915-2923. DOI:10.1093/jxb/eri287 |
| [6] |
HONG Z, ZHANG Y Z, CHEN H B, et al. The physiological function, biological and chemical synthesis of natural physiological active substance of jasmonates and its methyl ester[J].
Pesticides, 2000, 39(5): 8-11. 洪忠, 张永忠, 陈虎保, 等. 天然生理活性物质茉莉酸及其甲酯的生理作用与生物、化学合成[J]. 农药, 2000, 39(5): 8-11. DOI:10.3969/j.issn.1006-0413.2000.05.003 |
| [7] |
WU J S, ZHONG K. The molecular biology research on the action of jasmonates[J].
Chin Bull Bot, 2002, 19(2): 164-170. 吴劲松, 种康. 茉莉酸作用的分子生物学研究[J]. 植物学报, 2002, 19(2): 164-170. DOI:10.3969/j.issn.1674-3466.2002.02.005 |
| [8] | SMIMOFF N. BOTANICAL BRIEFING:The function and metabolism of ascorbic acid in plants[J]. Ann Bot, 1996, 78(6): 661-669. DOI:10.1006/anbo.1996.0175 |
| [9] |
ZHENG Q W, WANG X K, XIE J Q, et al. Effects of exogenous ascorbate acid on membrane protective system of in situ rice leaves under O3 stress[J].
Acta Ecol Sin, 2006, 26(4): 1131-113. 郑启伟, 王效科, 谢居清, 等. 外源抗坏血酸对臭氧胁迫下水稻叶片膜保护系统的影响[J]. 生态学报, 2006, 26(4): 1131-113. DOI:10.3321/j.issn:1000-0933.2006.04.021 |
| [10] | WHEELER G L, JONES M A, SMIRNOFF N. The biosynthetic pathway of vitamin C in higher plants[J]. Nature, 1998, 393(6683): 365-369. DOI:10.1038/30728 |
| [11] | CONKLIN P L. Recent advances in the role and biosynthesis of ascorbic acid in plants[J]. Plant Cell Environ, 2001, 24(4): 383-394. DOI:10.1046/j.1365-3040.2001.00686.x |
| [12] |
YU L, LIU Y H, PENG X X. Cloning, prokaryotic expression of rice L-galactono-1, 4-lactone dehydrogenase gene and preparation of anti-GLDH antibodies[J].
J Hunan Agri Univ (Nat Sci), 2010, 36(4): 381-384, 429. 俞乐, 刘拥海, 彭新湘. 水稻L-半乳糖内酯脱氢酶基因的克隆和原核表达及抗体的制备[J]. 湖南农业大学学报(自然科学版), 2010, 36(4): 381-384, 429. DOI:10.3724/SP.J.1238.2010.00381 |
| [13] | TAMAOKI M, MUKAI F, ASAI N, et al. Light-controlled expression of a gene encoding L-galactono-γ-lactone dehydrogenase which affects ascorbate pool size in Arabidopsis thaliana[J]. Plant Sci, 2003, 164(6): 1111-1117. DOI:10.1016/S0168-9452(03)00122-5 |
| [14] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [15] | GILLESPIE K M, AINSWORTH E A. Measurement of reduced, oxidized and total ascorbate content in plants[J]. Nat Protoc, 2007, 2(4): 871-874. DOI:10.1038/nprot.2007.101 |
| [16] | AMON D I. Copper enzymes in isolated chloroplasts:Polypheno-loxidase in Beta vulgaris[J]. Plant Physiol, 1949, 24(1): 1-15. DOI:10.1104/pp.24.1.1 |
| [17] |
TU Z P, CAI W J, LIN X Z, et al. Photoinhibition and rice productivity[J].
Jiangsu J Agri Sci, 1990, 6(S): 1-15. 屠曾平, 蔡惟涓, 林秀珍, 等. 光抑制与水稻生产力[J]. 江苏农业学报, 1990, 6(S): 1-15. |
| [18] | WEAVER L M, GAN S S, QUIRIN B, et al. A comparison of the expression patterns of several senescence-associated genes in response to stress and hormone treatment[J]. Plant Mol Biol, 1998, 37(3): 455-469. DOI:10.1023/A:1005934428906 |
| [19] |
ZHU C, ZENG G W. Effect of 4PU-30 on leaf senescence and active oxygen metabolism in rice[J].
J Zhejiang Univ (Agri Life Sci), 2000, 26(5): 483-488. 朱诚, 曾广文. 4PU-30对水稻叶片衰老与活性氧代谢的影响[J]. 浙江大学学报(农业与生命科学版), 2000, 26(5): 483-488. DOI:10.3321/j.issn:1008-9209.2000.05.006 |
| [20] |
GUAN J F, MA Z H, LI M X, et al. Inhibitory effects of spermidine on pollen germination and pollen tube elongation of apple and both relation to Ca2+[J].
Plant Physiol Commun, 2000, 36(2): 107-110. 关军锋, 马智宏, 李敏霞, 等. 亚精胺对苹果花粉萌发与花粉管伸长的抑制效应及其与Ca2+的关系[J]. 植物生理学通讯, 2000, 36(2): 107-110. |
| [21] | ASADA K. The water-water cycle as alternative photon and electron sinks[J]. Philos Trans R Soc B Biol Sci, 2000, 355(1402): 1419-1431. DOI:10.1098/rstb.2000.0703 |
| [22] |
NIE X Z, LIU D H, XU Z S. Role of ethylene in the senescence of detached rice leaves[J].
J Huazhong Agri Univ, 1989, 8(3): 218-222. 聂先舟, 刘道宏, 徐竹生. 乙烯在离体水稻叶片衰老中的作用[J]. 华中农业大学学报, 1989, 8(3): 218-222. |
| [23] |
GUO W M, ZENG W Q, CHEN F D. Regulation of ethylene on senescence of cut chrysanthemum flower[J].
J Nanjing Agri Univ, 1997, 20(4): 24-29. 郭维明, 曾武清, 陈发棣. 乙烯对切花菊衰老的调节[J]. 南京农业大学学报, 1997, 20(4): 24-29. DOI:10.7685/j.issn.1000-2030.1997.04.005 |
| [24] |
ZHOU X H, GU Z H, XU H N, et al. The effects of exogenous ascorbic acid on photosynthetic characteristics in Oryza sativa L. under aluminum stress[J].
J Yangzhou Univ (Agri Life Sci), 2015, 36(3): 73-78. 周小华, 谷照虎, 徐慧妮, 等. 外源抗坏血酸AsA对铝胁迫下水稻光合特性的影响[J]. 扬州大学学报(农业与生命科学版), 2015, 36(3): 73-78. |
| [25] |
TANG M L. Effect of MJ on leaf senescence in vitro and mechanism[D]. Baoding:Hebei Agricultural University, 2002:17-20.
唐美玲. 茉莉酸甲酯对离体叶片衰老的影响及其作用机制[D]. 保定: 河北农业大学, 2002: 17-20. http://www.docin.com/p-574599649.html |
| [26] |
JIN P. Study on regulation and mechanisms of postharvest disease and chilling injury of peach fruit after harvest[D]. Nanjing:Nanjing Agricultural University, 2009:44-47.
金鹏. 桃果实采后病害和冷害调控及其机理研究[D]. 南京: 南京农业大学, 2009: 44-47. |
| [27] | FARQUHAR G D, SHARKEY T D. Stomatal conductance and photo-synthesis[J]. Annu Rev Plant Physiol, 1982, 33(4): 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [28] |
XIE J Q, LI G X, WANG X K, et al. Effect of exogenous ascorbic acid on photosynthesis and growth of rice under O3 stress[J].
Chin J Eco-Agri, 2009, 17(6): 1176-1181. 谢居清, 李国学, 王效科, 等. 外源抗坏血酸对臭氧胁迫下水稻光合及生长参数的影响[J]. 中国生态农业学报, 2009, 17(6): 1176-1181. DOI:10.3724/SP.J.1011.2009.01176 |
| [29] | THOMAS H, STODDART J L. Leaf senescence[J]. Annu Rev Plant Physiol, 1980, 31: 83-111. DOI:10.1146/annurev.pp.31.060180.000503 |
| [30] | DESIMONE M, HENKE A, WAGNER E. Oxidative stress induces partial degradation of the large subunit of ribulose-1, 5-bisphosphate carboxylase/oxygenase in isolated chloroplasts of barley[J]. Plant Physiol, 1996, 111(3): 789-796. DOI:10.1104/pp.111.3.789 |
| [31] | ISHIDA H, SHIMIZU S, MAKINO A, et al. Light-dependent fragmentation of the large subunit of ribulose-1, 5-bisphosphate carboxylase/oxygenase in chloroplasts isolated from wheat leaves[J]. Planta, 1998, 204(3): 305-309. DOI:10.1007/s004250050260 |
| [32] |
LI R, ZHOU W, LI L, et al. Changes in relative content of Rubisco large subunit in naturally senescing rice leaves[J].
Chin J Rice Sci, 2009, 23(5): 555-558. 李瑞, 周玮, 李丽, 等. 水稻叶片自然衰老过程中Rubisco大亚基的含量变化[J]. 中国水稻科学, 2009, 23(5): 555-558. DOI:10.3969/j.issn.1001-7216.2009.05.17 |
| [33] |
WU W H, PAN R Z. Effect of jasmonic acid methyl ester on the photosynthesis of rice seedlings[J].
Acta Bot Sin, 1998, 40(3): 256-262. 吴文华, 潘瑞炽. 茉莉酸甲酯对水稻幼苗光合作用的影响[J]. 植物学报, 1998, 40(3): 256-262. |
| [34] |
LIN N, LU H. Research progress in ascorbate peroxidase gene family in plants[J].
J Chengdu Univ (Nat Sci), 2011, 30(2): 97-101. 李娜, 陆海. 植物抗坏血酸过氧化物酶基因家族研究进展[J]. 成都大学学报(自然科学版), 2011, 30(2): 97-101. DOI:10.3969/j.issn.1004-5422.2011.02.001 |
 2017, Vol. 25
2017, Vol. 25


