2. 广东省农业科学院蔬菜研究所, 广州 510640
2. Vegetable Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
丝瓜为葫芦科(Cucurbitaceae)丝瓜属(Luffa)一年生攀援性草本植物,是一种药膳兼用的蔬菜作物。丝瓜属植物有8种,在我国分布有2种:普通丝瓜(L. cylindrical Roem)和有棱丝瓜(L. acutangula Roxb.)。普通丝瓜又名水瓜、天萝瓜,在我国大部分地区均有栽培;有棱丝瓜又名棱角丝瓜、八棱丝瓜,主要在华南地区栽培[1-2]。丝瓜是喜温耐热的短日照植物,最适生长温度为20℃~30℃[3]。
广东处于中国东南沿海低纬地区,夏季炎热, 年均高温天数(日最高气温≥35℃) 14.7 d,日极端最高气温≥37℃,介于37.0℃~41.6℃,温室大棚内温度高达42℃以上[4]。随着极端高温日数和设施栽培的增加,高温已成为影响丝瓜正常生长的主要限制因子。高温胁迫不仅会使植物停止生长, 甚至会引起植株死亡。因此,筛选耐热性强的丝瓜种质对于解决高温胁迫丝瓜生产有着重要的现实意义。
高温胁迫生理研究在其他瓜类作物上已广泛开展,如黄瓜(Cucumis sativus)[5-6]、苦瓜(Momordica charantia)[7]、西瓜(Citrullus lanatus)[8]、节瓜(Benincasa hispida var.chieh-qua)[9]等,且已应用到高产栽培和辅助育种工作中。相对而言,丝瓜的耐热性研究基础十分薄弱。目前有关丝瓜的研究主要集中在育种[2]、药用成分分析[10]、加工工艺[11]、主要农艺性状基因定位[12]等方面,对丝瓜耐热性的研究报道较少,仅郝婷等研究了以丝瓜作砧木对提高黄瓜耐热性的作用[13]。
植物受到高温胁迫后,常通过形态变化、渗透性物质调节、保护酶活性、光合作用等来适应或抵抗高温胁迫[14-18]。因此,本研究以32份有棱丝瓜品种为试验材料,在幼苗期进行人工高温处理,观察热害症状,以期筛选耐热品种,完善丝瓜耐热性鉴定技术,为筛选耐热性有棱丝瓜建立一种简便、快捷的鉴定方法,这对丝瓜耐热种质资源研究与利用具有重要意义,有助于解决目前市场上丝瓜夏季栽培优质耐热品种缺乏的问题。
1 材料和方法 1.1 幼苗耐热性筛选32个有棱丝瓜品种(表 1),均由广东省农科院蔬菜研究所提供。每个品种取200粒种子,置于55℃~ 60℃温水中浸泡30 min,于28℃温水浸种5~6 h后用滤纸吸干种皮水分并晾置1 h,再置于33℃~35℃光照培养箱中催芽[7],出芽率约70%。将出芽种子播于装有基质(营养土:蛭石=8:1) 的32孔穴盘中(每孔穴播1粒出芽种子),置于人工气候室(光照12 h、黑暗12 h、28℃)中育苗。当幼苗长至两叶一心期时,挑选长势一致的幼苗移至培养箱(RXZ型智能人工气候箱,宁波江南仪器厂)中培养(白天30℃,夜间25℃),适应生长1 d后,将温度设置为白天45℃,夜间42℃,相对湿度为75%,光照强度为全光照(171.4 μmol m-2s-1),光照12 h,黑暗12 h,高温处理7 d。
| 表 1 供试有棱丝瓜品种信息 Table 1 Information of Luffa acutangula cultivarstested |
热害指数与耐热隶属度计算 在高温处理过程中,每天观察热害症状并记录,连续观察6 d。参照杨寅桂[19]的方法,记录有棱丝瓜子叶、真叶、心叶及下胚轴的热害程度,并确定整株幼苗的热害等级。热害症状分为5级:0级, 无受害症状; 1级, 1~2片叶变微黄;2级,1~2片叶黄化或1片叶萎蔫;3级,2~3片叶萎蔫或下胚轴大部分失水萎缩;4级,整株叶片萎蔫枯死,下胚轴严重失水萎缩,植株倾倒(表 2)。
| 表 2 有棱丝瓜幼苗热害症状 Table 2 Heat-injury symptoms of Luffa acutangula seedlings |
根据第4天的热害症状计算热害指数[20]:热害指数=(0×S0+1×S1+2×S2+3×S3+4×S4)/(4×N), 式中S0~S4分别为0~4级症状的植株数,N为总株数。用隶属函数法[21]进行耐热性评价:X(u)=(X-Xmin)/ (Xmax-Xmin), 其中,X为某一品种热害指数, Xmax为热害指数最大值,Xmin为热害指数最小值。热害指数与耐热性呈负相关,采用反隶属函数计算耐热隶属度:X(u)′=1-(X-Xmin)/(Xmax-Xmin)。
1.2 对热胁迫的生理响应根据有棱丝瓜苗期耐热性筛选,选取3个品种,即耐热品种WB121,较耐热品种YL8和热敏品种WB105。3个品种各取300粒种子,采用同样的方法进行萌发催芽。待幼苗适应生长1 d后,将温度设置为白天45℃,夜间42℃,相对湿度为75%, 光照强度为全光照(171.4 μmol m-2s-1),光周期为光照12 h,黑暗12 h,高温处理5 d。热处理期间定期加水以保持水分充足。
各品种挑选48株幼苗,其中36株用于测定相对电导率等生理指标。分别在高温处理0、1、3、5 d时取样,每个品种每个取样时间有9株可供采集叶片。剩余的12株幼苗,4株用于测量初始株高与初始鲜重,4株用于拍照(同时用于最后测量株高与鲜重),4株用于测定叶绿素荧光。
每天观察热害症状,计算热害指数[20]。
相对电导率的测定[22] 分别在高温处理0、1、3、5 d采集叶片,每个品种3株,在同一叶位各取1片完全展开叶,3个重复。用直径为0.9 cm的打孔器打取小圆片6片,超纯水冲洗2~3次,吸水纸吸干多余水分,将其轻轻放入盛有10 mL超纯水的15 mL离心管中并完全浸泡在水中,室温下浸泡3 h, 用电导仪测定电导率R1。煮沸30 min,冷却至室温后再测定其电导率R2。以相对电导率表示细胞膜的电解质渗透率:相对电导率(%)=(R1/R2)×100%。
丙二醛(MDA)和可溶性糖含量的测定[23] 分别在高温处理0、1、3、5 d采集叶片,选取植株底端第2片叶,每个品种取3片叶子(取自3株),3个重复。称取0.1 g叶片,加入1.8 mL 10%三氯乙酸研磨至匀浆,匀浆以1611×g离心10 min,取上清液待用。采用硫代巴比妥酸(TBA)比色法测定丙二醛和可溶性糖含量。
保护酶活性的测定[24-25] 分别在高温处理0、1、3、5 d时采集叶片,选取植株底端第2片叶称取0.1 g叶片,每个品种取3片叶子(来自3株),3个重复。加入1 mL酶提取缓冲液并研磨成浆,再加入0.80 mL酶提取缓冲液分2次冲洗研钵,并将洗液全部转移至离心管中,在4℃下12000×g离心20 min, 上清液移入2 mL离心管,置于冰上,用于测定抗氧化酶活性。采用过氧化氢法[26]测定过CAT活性,愈创木酚法[27]测定POD活性,氮基四唑(NBT)法[26]测定SOD活性。
叶绿素荧光参数的测定[28] 使用脉冲调制荧光仪PAM-2100 (Walz, Efeltrich, Germany)测定叶绿素荧光。选取高温处理下生长幼苗的同一叶位的叶片进行测定,每个品种测4株,4个重复。每天测定1次,第5天停止。测定前叶片经过20 min的充分暗适应,测量时先于0.04 μmol m-2s-1弱测量光下测定光系统Ⅱ (PS Ⅱ)反应中心开启时的最小荧光产率Fo, 利用饱和光脉冲6000 μmol m-2s-1 (脉冲时间2 s)测最大荧光Fm, 光化光强度为400~450 μmol m-2s-1。PSII的最大光化学效率(Fv/Fm)、实际光化学量子产量(Yeild)、表观光合电子传递速率(ETR)均由仪器自动给出。
1.3 数据分析采用Excel软件进行数据整理,SPSS 19.0对数据进行统计分析。对各生理指标进行单因素方差分析(One-Way ANOVA),控制变量为温度,观察变量为热害症状、植物表型、生物量及各种生理指标。采用最小显著差异法LSD (Least-significant difference)进行多重比较(α=0.05)。对热害指数与各生理指标之间的相关性进行Pearson相关分析。根据耐热隶属度,采用中间距离法对32个品种的耐热性进行聚类分析。用OriginPro 9.1软件绘图。
2 结果和分析 2.1 热害症状分级有棱丝瓜幼苗整株热害症状分为5级:0级, 无受害症状;1级,1~2片叶变微黄;2级,1~2片叶黄化或1片叶萎蔫;3级,2~3片叶萎蔫或下胚轴大部分失水萎缩;4级,整株叶片萎蔫枯死,下胚轴严重失水萎缩,植株倾倒(图 1)。有棱丝瓜幼苗经过7 d的高温处理,先是子叶、心叶、真叶和下胚轴不断失水,由微黄、黄化到萎蔫、干枯;下胚轴由部分失水到严重失水,植株由直立状态到倾斜或倾倒状态。

|
图 1 有棱丝瓜幼苗热害症状 Fig. 1 Heat-injury symptoms of Luffa acutangula seedlings |
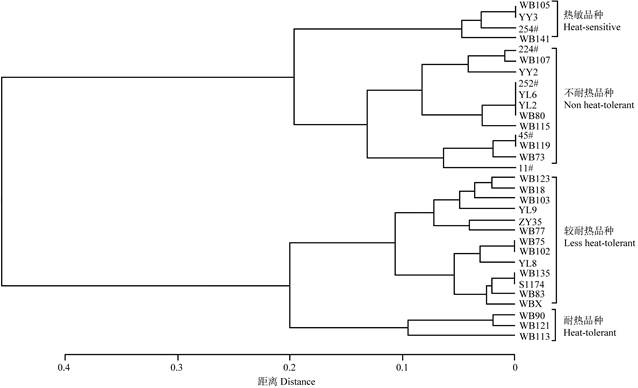
根据耐热隶属度(表 3),采用中间距离法对32个有棱丝瓜品种进行聚类分析,将32个品种划分为耐热品种(3个)、较耐热品种(13个)、不耐热品种(12个)和热敏品种(4个)(图 2)。
| 表 3 有棱丝瓜幼苗热害症状分级及耐热性评价 Table 3 Classification of heat-injury symptoms and thermotolerance evaluation of Luffa acutangula seedlings |
|
图 2 32个有棱丝瓜品种耐热隶属度聚类分析 Fig. 2 Cluster analysis of 32 Luffa acutangula varieties based on thermotolerance membership grade |
热害症状差异 耐热品种WB121、较耐热品种YL8、热敏品种WB105经42℃~45℃高温胁迫5 d后,热害症状差异显著(图 3)。耐热品种WB121对高温耐受性强,叶片变黄、萎蔫较慢,因而热害指数较小(48.44);而热敏品种对高温耐受能力差, 热害指数较大(92.19);较耐热品种YL8的热害指数则居中(68.75)。

|
图 3 高温胁迫下有棱丝瓜幼苗的热害症状 Fig. 3 Heat-injury symptoms of Luffa acutangula seedlings under heat stress |
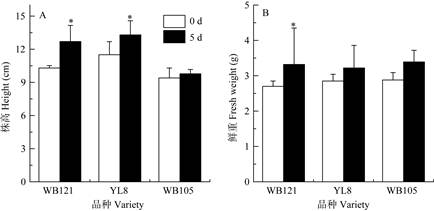
株高、鲜重的变化 高温胁迫5 d后,与初始株高相比,耐热品种WB121和较耐热品种YL8的株高显著增加,分别增长了23.3%和16%,而热敏品种WB105的株高无显著变化,仅增加了4.4%(图 4: A)。此外,耐热品种WB121的鲜重也显著增加,而较耐热品种和热敏品种的鲜重则增加不显著(图 4: B)。可见,高温胁迫对热敏品种的生长抑制作用较大。
|
图 4 高温胁迫下有棱丝瓜幼苗株高和鲜重变化(n=4) *: P < 0.05. Fig. 4 Changes in height and fresh weight of Luffa acutangula seedlings under heat stress (n=4) *: P < 0.05. |
细胞膜透性的变化 在高温胁迫前(0 d),不同耐热性有棱丝瓜品种的相对电导率无显著差异(图 5: A)。高温处理3 d后,热敏品种WB121的相对电导率显著高于耐热品种WB105和较耐热品种YL8。5 d后,3个品种的相对电导率均升至最大, 其中热敏品种WB105的相对电导率增加了113.05%,较耐热品种上升了50.94%,而耐热品种只上升了0.52% (图 5: A)。可见,热敏品种的细胞膜受损严重,透性增加,而耐热品种的细胞膜则保持稳定。

|
图 5 高温胁迫下有棱丝瓜细胞膜稳定性及渗透调节物质的变化(n=3)。RC:相对电导率; MDA:丙二醛; SC:可溶性糖。 Fig. 5 Changes in cell membrane stability and permeable substance of Luffa acutangula seedlings under heat stress (n=3). RC: Relative conductivity; MDA: Malondialdehyde; SC: Soluble carbohydrate |
丙二醛含量的变化 与相对电导率的变化类似(图 5: B)。高温胁迫1 d后,丙二醛含量无显著变化。但高温胁迫3 d后,耐热品种WB121和较耐热品种YL8的丙二醛含量略有下降,而热敏品种WB105的丙二醛含量则表现为线性增加。5 d后,3个品种的丙二醛含量均增加至最大值(图 5: B),其中热敏品种WB105的丙二醛含量最高(266.7%),耐热品种WB121最低(104.9%),较耐热品种YL8则居中(205.3%)。这表明丙二醛含量的增幅与耐热性有一定的关系,耐热品种比不耐热品种增幅小。
可溶性糖含量的变化 与丙二醛含量的变化基本一致。在高温胁迫前(0 d),3个品种的可溶性糖含量差异不显著(图 5: C)。随着高温胁迫时间的延长,各品种的可溶性糖含量均表现出不同程度的增加。高温胁迫1 d,WB105和YL8的可溶性糖含量迅速上升,高温胁迫3 d后,WB105可溶性糖含量继续急剧上升,YL8和WB121的可溶性糖含量也显著上升,但比WB105上升缓慢。高温胁迫5 d, 热敏品种WB105的可溶性糖含量比处理前增加10.7倍,耐热品种和较耐热品种的可溶性糖含量分别增加6.31倍和5.91倍(图 5: C)。这表明,高温胁迫下耐热性弱的品种有可能通过增加可溶性糖含量来提高植物细胞的渗透浓度,增强植物的保水能力,从而提高植物的耐受力。
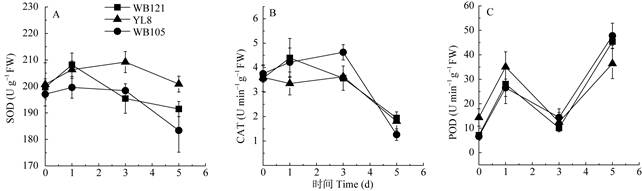
保护酶活性的变化 高温胁迫前,3个品种的SOD、CAT、POD活性差异不显著(图 6)。在高温胁迫过程中,SOD活性大体上呈现先上升后下降的趋势(图 6: A)。高温胁迫第1天,耐热品种的SOD活性达到最高峰,显著高于热敏品种。高温胁迫3~5 d,3个品种的SOD活性呈下降趋势,热敏品种下降至最低值,显著低于耐热品种和较耐热品种(图 6: A)。这可能是由于耐热品种更早提高了SOD活性来清除活性氧,使植株受到的伤害降到最轻,而热敏品种这方面的能力较差,故在高温处理后期,热敏品种的酶活性下降最快,而耐热品种下降较慢。CAT活性也呈现先上升后下降的趋势(图 6: B)。高温胁迫第1天,耐热品种的CAT活性达到最高峰。热敏品种在第3天达到最高峰,且热敏品种的增幅较大。在高温胁迫3~5 d,3个品种的CAT活性呈现下降趋势,热敏品种下降幅度最大(73%),5 d时热敏品种的CAT活性最低,显著低于耐热品种和较耐热品种。POD活性则呈现先上升(1 d)后下降(3 d)再上升(5 d)的趋势,3个品种的POD变化趋势基本一致(图 6: C)。高温胁迫3~5 d, POD活性迅速上升,可能是由于POD对高温的响应与SOD和CAT不同。在SOD和CAT活性下降时,植物通过POD活性升高来弥补对H2O2清除能力的降低。
|
图 6 高温胁迫下有棱丝瓜细胞保护酶活性的变化(n=3)。SOD:超氧化物歧化酶; CAT:过氧化氢酶; POD:过氧化物酶 Fig. 6 Changes in cell antioxidase activity of Luffa acutangula seedlings under heat stress (n=3). SOD: Superoxide dismutase; CAT: Catalase; POD: Peroxidase |
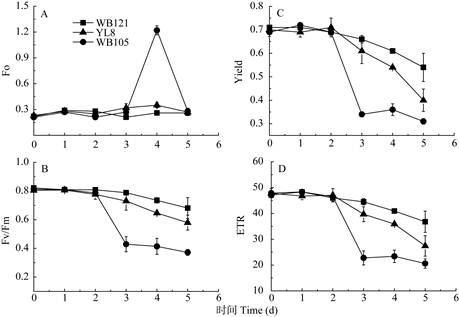
叶绿素荧光参数的变化 Fo是叶绿体类囊体膜结构耐热性的敏感指标。短期高温胁迫1~3 d,3个品种的初始荧光Fo均无显著变化(图 7: A)。第4天时,热敏品种WB105的初始荧光Fo急剧升高(3.52倍),显示光系统Ⅱ受到破坏。耐热品种WB121和较耐热品种YL8的初始荧光Fo则无明显变化。高温胁迫下3个品种的最大光化学效率(Fv/Fm)、实际光量子产量(Yeild)和光合电子传递效率(ETR)变化趋势相似。高温胁迫2 d,3个品种的Fv/Fm、Yeild和ETR开始下降,热敏品种WB105下降的幅度最大,耐热品种WB121下降的幅度最小。高温胁迫5 d,热敏品种WB105的Fv/Fm下降至最低值(-54%),耐热品种WB121的Fv/Fm下降较少(-17%),较耐热品种的Fv/Fm则居中(图 7: B)。Yield也在高温胁迫第3天急剧下降,第5天时下降至最低,其中热敏品种WB105下降了54%,耐热品种WB121下降了24%,较耐热品种YL8下降了42% (图 7: C)。ETR的变化与Yield基本一致(图 7: D)。
|
图 7 高温胁迫下有棱丝瓜幼苗叶绿素荧光参数的变化(n=4)。Fo:初始荧光; Fv/Fm:最大原初光能转化效率; Yield:实际光量子产量; ETR:光合电子传递效率 Fig. 7 Changes in chlorophyll fluorescence parameters of Luffa acutangula seedlings under heat stress (n=4). Fo: Initial fluorescence; Fv/Fm: Optimal/ Maximal quantum yield of PSⅡ; Yield: Actual quantum yield; ETR: Electron transport rate |
Pearson相关分析表明,相对电导率与热害指数呈显著正相关关系(r=0.693*),丙二醛、可溶性糖含量与热害指数呈极显著正相关关系(rMDA=0.814**, rSC=0.899**);叶绿素荧光参数(Fv/Fm, Yield, ETR)与热害指数呈极显著负相关关系(rFv/Fm=-0.892**, rYield=-0.896**, rETR=-0.897**),Fo与热害指数呈显著正相关关系(r=0.781*);3种保护酶活性与热害指数的相关性不显著(rSOD=-0.445, rCAT=-0.441, rPOD= 0.475)。
3 讨论研究丝瓜的热害、耐热机理和筛选耐热材料时,必须进行耐热性鉴定,而评价指标的准确性及合理性是客观评价的关键。耐热性评价涉及形态、渗透调节物质、保护酶活性、光合作用等方面。本研究根据丝瓜幼苗期热害症状分级,计算热害指数,应用隶属函数法和聚类分析法对32个有棱丝瓜品种进行了耐热性鉴定,结果获得耐热品种3个,热敏品种4个。重复试验再次验证了耐热品种与热敏品种的耐热性差异,在处理期间耐热品种的株高与鲜重均显著增加,而热敏品种的株高与鲜重增加均不显著,表明耐热品种在高温胁迫下仍保持生长,而热敏品种的生长可能已经停滞。也有用成株期结果产量来鉴定作物的耐热性[29],但试验历时较长,鉴定成本较高。有研究表明,植物苗期和成株期的耐热性显著相关[29],因而苗期耐热性的筛选是快速、准确鉴定成株耐热性的重要方法之一。
细胞膜系统是热损伤和抗热的中心,细胞膜的热稳定性反映了植物的耐热能力。高温胁迫会使细胞膜发生膜脂过氧化作用,使细胞膜渗透性增加, 电解质外渗[30]。丙二醛是植物细胞膜脂过氧化产物之一,可溶性糖是植物细胞渗透调节物质之一[31]。因此,相对电导率、丙二醛和可溶性糖含量能够反映植物体内膜脂过氧化水平,间接反映热害程度。本研究结果表明,高温胁迫下,耐热的有棱丝瓜品种相对电导率、丙二醛和可溶性糖含量显著低于热敏品种,表明耐热品种细胞膜受损程度较低。这与杨寅桂等[19]和郭培国等[7]的研究结果一致。
自1977年Sullivan首次将电导法用于测定细胞膜热稳定性后,电导率法在耐热性鉴定中得到了广泛的应用[32]。而一些生理生化指标,如保护酶活性的变化却具有很大的不确定性。刘成静等比较了西瓜自根苗和嫁接苗的耐热性及保护酶活性的差异, 发现二者的POD、CAT和SOD均表现为先下降后上升,然后再下降[33]。刘忠国对黄瓜叶片的保护酶研究表明,高温胁迫下黄瓜叶片SOD、POD、CAT活性均上升,耐热品种增幅大于热敏品种[34]。还有研究表明高温胁迫后黄瓜叶片SOD、POD活性上升,CAT活性下降[19],或POD、CAT活性上升, SOD活性下降[32],或SOD、POD、CAT活性均下降[6]。本研究中3种保护酶活性的变化与上述研究均不一致。本研究表明,在高温胁迫前期(3 d),3个有棱丝瓜品种SOD和CAT活性升高,以降低体内活性氧的水平;在高温胁迫后期(5 d),SOD和CAT活性下降,POD活性升高,通过提高POD活性适应高温胁迫,减少膜伤害。耐热品种在高温胁迫早期启动较高的酶活性,热敏品种则相对较晚启动酶活性。在高温胁迫晚期,热敏品种的SOD和CAT活性上升和POD活性下降幅度都大于耐热品种。这可能与试验材料、高温程度和胁迫时间不同有关[6, 30]。可见,保护酶活性具有较大的不稳定性, 不适合作为耐热性鉴定的评价指标。
光合作用是植物对高温最敏感的生理过程之一, 许多植物都有在高温胁迫下发生光抑制的现象[35-36]。热胁迫会导致PSⅡ结构和功能发生改变甚至引起PSII损害[37]。初始荧光(Fo)是PS Ⅱ反应中心处于完全开放时的荧光产量,可以反映叶绿体类囊体膜结构的耐热性[38]。本研究中,高温胁迫条件下热敏品种的Fo显著上升,表明植物叶片PS Ⅱ反应中心或类囊体膜受损。这与苗琛等对高温下甘蓝(Brassica oleracea)叶片超微结构的观察一致,甘蓝热敏品种在38℃~39℃下叶绿体膜断裂解体,类囊体片层松散,排列紊乱[39]。
最大光化学效率(Fv/Fm)不受物种和生长条件影响,在非胁迫条件下极少变化。当受到环境胁迫时,该指标会明显下降,被认为是反映光抑制的可靠指标[40]。本研究中随着高温胁迫时间的延长,3个品种的Fv/Fm显著下降,表明高温阻碍了光合电子传递,导致同化力(NADPH,ATP)合成受阻,进而影响暗反应阶段CO2的固定与同化。ETR和Yield也显著下降,进一步证实光合电子传递受到抑制, PSII光能转换效率降低。但是与热敏品种相比,耐热品种的Fv/Fm、ETR和Yield下降幅度较小,说明高温对其PSII活性中心的损伤较弱,这是耐热品种对高温具有抗性的光合生理原因[41]。张红梅等报道42℃高温胁迫3 d,黄瓜叶片的Fv/Fm、Yeild、ETR均显著降低,热敏品种下降幅度较大[5];郭培国等报道高温胁迫下苦瓜的Fv/Fm下降,耐热的苦瓜具有较高的Fv/Fm值[7]。
总的来讲,热害症状的观察与热害指数的计算是鉴定品种耐热性最直观、可靠的外部形态指标。相对电导率与丙二醛含量可以准确反映细胞膜的热稳定性,而热胁迫下保护酶活性的变化则具有很大的不确定性,叶绿素荧光参数(Fv/Fm、Yield、ETR)可以快速、准确地反映植物热害,相关分析结果也证明了这一点。叶绿素荧光测定技术作为一种无损伤的快速探针用于植物的抗逆生理研究已有大量报道[38, 42]。建议将其应用于丝瓜的耐热性检测,将叶绿素荧光参数(Fv/Fm、Yield、ETR)作为丝瓜种质资源耐热性检测的重要生理指标。
致谢: 感谢华南农业大学统计学专业曾文姬同学协助聚类分析。| [1] |
CHEN C W. ISSR analysis of the germplasm resources genetic diversity of Luffa[D]. Fuzhou:Fujian Agriculture and Forestry University, 2009:1-2.
陈朝文. 丝瓜种质资源遗传多样性的ISSR分析[D]. 福州: 福建农林大学, 2009: 1-2. http://www.wenkuxiazai.com/doc/c90adf020740be1e650e9a09-2.html |
| [2] |
ZHANG L Y, HE Z J, XIANG C P. Analysis of combining ability and genetic parameter for major economic characters in Luffa inbred lines[J].
N Hort, 2009(11): 36-39. 张凌云, 何志俊, 向长萍. 丝瓜自交系主要经济性状配合力及遗传参数分析[J]. 北方园艺, 2009(11): 36-39. |
| [3] |
HE X L, LUO J N, LUO S B, et al. The main physiological charac-teristics of Luffa research progress[J].
Guangdong Agri Sci, 2006(8): 114-116. 何晓莉, 罗剑宁, 罗少波, 等. 丝瓜主要生理特性研究进展[J]. 广东农业科学, 2006(8): 114-116. DOI:10.3969/j.issn.1004-874X.2006.08.047 |
| [4] |
WU H Y, DU Y D. Climatic characteristics and change laws of high temperature in Guangdong during the last 49 years[J].
J Trop Meteor, 2011, 27(3): 427-432. 伍红雨, 杜尧东. 近49年广东高温的气候特征及其变化规律[J]. 热带气象学报, 2011, 27(3): 427-432. |
| [5] |
ZHANG H M, JIN H J, DING X T, et al. Physiological reaction and chlorophyll fluorescence characteristics of Cucumber seedlings under hot stress[J].
J Shanghai Jiaotong Univ (Agri Sci), 2011, 29(5): 61-66. 张红梅, 金海军, 丁小涛, 等. 黄瓜幼苗对热胁迫的生理反应及叶绿素荧光特性[J]. 上海交通大学学报(农业科学版), 2011, 29(5): 61-66. DOI:10.3969/J.ISSN.1671-9964.2011.05.011 |
| [6] |
MA D H, SUN Q X. Effects of temperature stress on membrane protective system of Cucumber seedlings[J].
Acta Bot Boreali-Occid Sin, 2001, 21(4): 656-661. 马德华, 孙其信. 温度逆境对不同品种黄瓜幼苗膜保护系统的影响[J]. 西北植物学报, 2001, 21(4): 656-661. DOI:10.3321/j.issn:1000-4025.2001.04.009 |
| [7] |
GUO P G, LI R H, XIA Y S, et al. Effects of high temperature stress on several physiological traits in Momordica charantia[J].
J Guangzhou Univ (Nat Sci), 2013, 12(2): 24-29. 郭培国, 李荣华, 夏岩石, 等. 高温胁迫对苦瓜生理特性影响的分析[J]. 广州大学学报(自然科学版), 2013, 12(2): 24-29. |
| [8] |
ZHANG L, LI G F, LI W X, et al. Effect of high temperature stress on the growth and physiological property of different watermelon seedlings and their comprehensive assessment[J].
Chin Cucurb Veget, 2015, 28(4): 13-17. 张力, 李桂芬, 李文信, 等. 高温胁迫对不同西瓜幼苗生长和生理特性的影响及综合评价[J]. 中国瓜菜, 2015, 28(4): 13-17. DOI:10.3969/j.issn.1673-2871.2015.04.003 |
| [9] |
XIE D S, PENG Q W, FAN J C, et al. Studies on identity tracts of heat tolerance in chieh-qua[J].
Guangdong Agri Sci, 2005(2): 32-34. 谢大森, 彭庆务, 范吉昌, 等. 节瓜品种耐热性鉴定指标的研究[J]. 广东农业科学, 2005(2): 32-34. DOI:10.3969/j.issn.1004-874X.2005.02.011 |
| [10] |
LIU C J, DONG L M, KANG H Y. Effect of towel gourd extract on learning-memory ability, morphology of brain tissue and immune function in aging mice[J].
Pharmacol Clin Chin Mat Clin Med, 2016, 32(1): 106-110. 刘春杰, 董立珉, 康红钰. 丝瓜提取物对衰老小鼠学习记忆能力、脑组织形态学及免疫功能的影响[J]. 中药药理与临床, 2016, 32(1): 106-110. |
| [11] |
WANG Y Y, YOU X X. Application of towel gourd juice in the processing technology of sponge cake[J].
Food Res Dev, 2016, 37(8): 71-76. 王莹莹, 游新侠. 丝瓜汁在海绵蛋糕制作工艺中的应用[J]. 食品研究与开发, 2016, 37(8): 71-76. DOI:10.3969/j.issn.1005-6521.2016.08.017 |
| [12] |
ZHOU Q Y. Genetic analysis of main agronomic traits and gene localization of seed coat color in Luffa spp.[D]. Nanchang:Jiangxi Agricultural University, 2013:1-4.
周庆友. 丝瓜主要农艺性状的遗传分析及种皮颜色基因定位[D]. 南昌: 江西农业大学, 2013: 1-4. http://cdmd.cnki.com.cn/Article/CDMD-10410-1013343003.htm |
| [13] |
HAO T, DING X T, YU J Z, et al. Effect of towel gourd as rootstock on thermal tolerance of cucumber seedlings[J].
Acta Agri Zhejiang, 2015, 27(3): 365-371. 郝婷, 丁小涛, 余纪柱, 等. 丝瓜作砧木对黄瓜幼苗耐热性的影响[J]. 浙江农业学报, 2015, 27(3): 365-371. DOI:10.3969/j.issn.1004-1524.2015.03.09 |
| [14] | HARSH A, SHARMA Y K, JOSHI U, et al. Effect of short-term heat stress on total sugars, proline and some antioxidant enzymes in moth bean (Vigna aconitifolia)[J]. Ann Agri Sci, 2016, 61(1): 57-64. DOI:10.1016/j.aoas.2016.02.001 |
| [15] | ZHANG X X, ZHOU Q, WANG X, et al. Physiological and transcriptional analyses of induced post-anthesis thermo-tolerance by heat-shock pretreatment on germinating seeds of winter wheat[J]. Environ Exp Bot, 2016, 131: 181-189. DOI:10.1016/j.envexpbot.2016.08.002 |
| [16] |
LIU D L, ZHANG H, HU K Q, et al. Biochemical characters of Lolium perenne under high temperature stress[J].
Acta Agrest Sin, 2013, 21(1): 142-146, 151. 刘大林, 张华, 胡楷崎, 等. 多年生黑麦草在高温胁迫下生理生化特性的变化[J]. 草地学报, 2013, 21(1): 142-146, 151. DOI:10.11733/j.issn.1007-0435.2013.01.021 |
| [17] |
HAO T, DING X T, ZHANG H M, et al. Growth and physiological reaction of different cucurbit crops in the high root-zone temperature stress[J].
Plant Physiol J, 2014, 50(4): 433-438. 郝婷, 丁小涛, 张红梅, 等. 几种瓜类作物对根际高温胁迫的生理响应[J]. 植物生理学报, 2014, 50(4): 433-438. DOI:10.13592/j.cnki.ppj.2013.0427 |
| [18] |
HAO T, ZHU Y L, DING X T, et al. Effects of high temperature stress in rhizosphere on growth, leaf photosynthetic and chlorophyll fluore-scence parameters of five cucurbit crops[J].
J Plant Resour Environ, 2014, 23(2): 65-73. 郝婷, 朱月林, 丁小涛, 等. 根际高温胁迫对5种瓜类作物生长及叶片光合和叶绿素荧光参数的影响[J]. 植物资源与环境学报, 2014, 23(2): 65-73. DOI:10.3969/j.issn.1674-7895.2014.02.10 |
| [19] |
YANG Y G. Studies on the heat tolerance and gene of heat stress response related in cucumber[D]. Nanjing:Nanjing Agricultural University, 2007:22-28.
杨寅桂. 黄瓜耐热性及热胁迫响应基因研究[D]. 南京: 南京农业大学, 2007: 22-28. http://www.docin.com/p-20814786.html |
| [20] |
YANG Y G, LI W G, LOU Q F. Selection of heat tolerant germplasm in cucumber[J].
China Cucurb Veget, 2008, 21(1): 1-3. 杨寅桂, 李为观, 娄群峰, 等. 黄瓜耐热材料筛选[J]. 中国瓜菜, 2008, 21(1): 1-3. DOI:10.3969/j.issn.1673-2871.2008.01.001 |
| [21] |
CHE J L, ZHOU S M, SHANG X H, et al. Identification of heat tolerance in cucumber[J].
Acta Agri Zhejiang, 2012, 24(5): 808-813. 车江旅, 周生茂, 尚小红, 等. 黄瓜种质资源耐热性鉴定[J]. 浙江农业学报, 2012, 24(5): 808-813. DOI:10.3969/j.issn.1004-1524.2012.05.011 |
| [22] |
LIU N, GAO Y B, JIA C X, et al. Changes in POD activity, free proline content and cytomembrane permeability of Lolium multiflorum leaves under different levels of osmotic stress[J].
Plant Physiol Commun, 2000, 36(1): 11-14. 刘宁, 高玉葆, 贾彩霞, 等. 渗透胁迫下多花黑麦草叶内过氧化物酶活性和脯氨酸含量以及质膜相对透性的变化[J]. 植物生理学通讯, 2000, 36(1): 11-14. |
| [23] |
LIN Y, GUO W Z, XU Z H, et al. Cold resistance and changes on MDA and soluble sugar of leaves of Ligustrun lucidum Ait in winter[J].
Chin Agri Sci Bull, 2012, 28(25): 68-72. 林艳, 郭伟珍, 徐振华, 等. 大叶女贞抗寒性及冬季叶片丙二醛和可溶性糖含量的变化[J]. 中国农学通报, 2012, 28(25): 68-72. DOI:10.3969/j.issn.1000-6850.2012.25.013 |
| [24] |
LI H S.
Principles and Techniques of Plant Physiological Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 167-169.
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-169. |
| [25] |
LI H L. The effect and mechanism of exogenous silicon on salt resistance of tomato seedlings[D]. Yangling:Northwest Agriculture and Forestory University, 2015:12-13.
李换丽. 硅对番茄幼苗抗盐性的影响及机理初探[D]. 杨凌: 西北农林科技大学, 2015: 12-13. http://cdmd.cnki.com.cn/Article/CDMD-10712-1015332943.htm |
| [26] | AL-AGHABARY K, ZHU Z J, SHI Q H. Influence of silicon supply on chlorophyll content, chlorophyll fluorescence, and antioxidative enzyme activities in tomato plants under salt stress[J]. J Plant Nutri, 2005, 27(12): 2101-2115. DOI:10.1081/PLN-200034641 |
| [27] | ZHU Z J, WEI G Q, LI J, et al. Silicon alleviates salt stress and increases antioxidant enzymes activity in leaves of salt-stresseded cucumber (Cucumis sativus L.)[J]. Plant Sci, 2004, 167(3): 527-533. DOI:10.1016/j.plantsci.2004.04.020 |
| [28] |
KE Z H, ZENG Q T, HE Y W, et al. Effects of simulated SO2 pollution on eight common fruit trees of Guangdong Province[J].
Guangdong Agri Sci, 2013, 40(2): 32-36. 柯展鸿, 曾庆婷, 何月雯, 等. 模拟SO2污染对广东8种常见果树的胁迫效应[J]. 广东农业科学, 2013, 40(2): 32-36. DOI:10.3969/j.issn.1004-874X.2013.02.013 |
| [29] |
MENG L B, QIN Z W, LIU H Y. High temperature influence on the yield and appearance index of different species of cucumber[J].
N Hort, 2004(3): 52-53. 孟令波, 秦智伟, 刘宏宇. 高温对黄瓜不同品种产量及形态指标的影响[J]. 北方园艺, 2004(3): 52-53. DOI:10.3969/j.issn.1001-0009.2004.03.035 |
| [30] |
WU Y B, YE B. Effects of combined elevated temperature and drought stress on anti-oxidative enzyme activities and reactive oxygen species metabolism of Broussonetia papyrifera seedlings[J].
Acta Ecol Sin, 2016, 36(2): 403-410. 吴永波, 叶波. 高温干旱复合胁迫对构树幼苗抗氧化酶活性和活性氧代谢的影响[J]. 生态学报, 2016, 36(2): 403-410. DOI:10.5846/stxb201409201862 |
| [31] |
LI X L, WANG Y, SUN M, et al. Response of physiology of ground-cover chrysanthemum and Its relative germplasm with different heat and humidity resistance to heat and humidity stress[J].
J NE For Univ, 2014(5): 43-46. 李贤利, 王亚, 孙明, 等. 不同耐湿热性地被菊品种及近缘种对湿热胁迫的生理反应[J]. 东北林业大学学报, 2014(5): 43-46. DOI:10.3969/j.issn.1000-5382.2014.05.011 |
| [32] |
WANG Z C. Studies on identification of heat and water logging tolerance of cucumber and selection of tolerance germplasm[D]. Wuhan:Huazhong Agricultural University, 2008:18-20.
汪祖程. 黄瓜耐热耐渍性指标鉴定及抗性材料筛选的研究[D]. 武汉: 华中农业大学, 2008: 18-20. http://cdmd.cnki.com.cn/Article/CDMD-10504-2008202899.htm |
| [33] |
LIU C J, WANG C Q, JIAO Z G, et al. Study on heat resistance and protective enzyme of grafted watermelon seedlings under high temperature stress[J].
J Changjiang Veget, 2009, 2(4): 50-53. 刘成静, 王崇启, 焦自高, 等. 高温胁迫下西瓜嫁接苗耐热性和保护酶活性的研究[J]. 长江蔬菜, 2009, 2(4): 50-53. DOI:10.3865/j.issn.1001-3547(x).2009.02.015 |
| [34] |
LIU Z G. The study on thermotolerance of Cucumber seedlings under high temperature stress[D]. Taian:Shandong Agricultural University, 2010:23-24.
刘忠国. 高温胁迫对黄瓜幼苗耐热性的研究[D]. 泰安: 山东农业大学, 2010: 23-24. |
| [35] | HASANUZZAMAN M, NAHAR K, ALAM M M, et al. Physiological, biochemical and molecular mechanisms of heat stress tolerance in plants[J]. Int J Mol Sci, 2013, 14(5): 9643-9684. DOI:10.3390/ijms14059643 |
| [36] | CRAFTS-BRANDER S J, SALVUCCI M E. Rubisco activase constrains the photosynthetic potential of leaves at high temperature and CO2[J]. Proc Natl Acad Sci USA, 2000, 97(24): 13430-13435. DOI:10.1073/pnas.230451497 |
| [37] | CRAFTS-BRANDER S J, SALVUCCI M E. Sensitivity of photo-synthesis in a C4 plant, maize, to heat stress[J]. Plant Physiol, 2002, 129(4): 1773-1780. DOI:10.1104/pp.002170 |
| [38] |
GAO Y, GAO Z K, ZHANG X H, et al. Heat shock stress on photosystem Ⅱ in white cucumbers probed by the fast fluoresence rise OJIP[J].
Acta Ecol Sin, 2009, 29(6): 3335-3341. 高玉, 高志奎, 张晓慧, 等. 通过快速荧光动力学曲线探测白黄瓜光系统Ⅱ的热激胁迫效应[J]. 生态学报, 2009, 29(6): 3335-3341. DOI:10.3321/j.issn:1000-0933.2009.06.067 |
| [39] |
XU C Z, QUAN S W, ZHU L, et al. Studies on the diurnal variation of chlorophyll fluorescence parameters in different walnut cultivars[J].
Chin Agri Sci Bull, 2015, 31(7): 6-12. 徐崇志, 全绍文, 朱玲, 等. 不同核桃品种叶绿素荧光动力学参数比较研究[J]. 中国农学通报, 2015, 31(7): 6-12. |
| [40] |
MIAO C, LI R Q, WANG J B. Leaf structural changes of Brassica campestris and B. oleracea in response to heat stress[J].
J Wuhan Bot Res, 1994, 12(3): 207-211. 苗琛, 利容千, 王建波. 热胁迫下不结球白菜和甘蓝叶片组织结构的变化[J]. 武汉植物学研究, 1994, 12(3): 207-211. |
| [41] | LAI C H, HE J. Physiological performances of temperate vegetables with response to chronic and acute heat stress[J]. Amer J Plant Sci, 2016, 7(14): 2055-2071. DOI:10.4236/ajps.2016.714185 |
| [42] |
ZHAO L L, WU J H, WANG P C, et al. Effect of high temperature stress on photosynthetic and chlorophyll fluorescence of Festuca arundinacea[J].
Acta Agrest Sin, 2015, 23(4): 811-817. 赵丽丽, 吴佳海, 王普昶, 等. 高羊茅种质光合及叶绿素荧光参数对高温胁迫的响应[J]. 草地学报, 2015, 23(4): 811-817. DOI:10.11733/j.issn.1007-0435.2015.04.021 |
 2017, Vol. 25
2017, Vol. 25


