2. 西南林业大学生命科学学院, 昆明 650224
2. College of Life Science, Southwest Forestry University, Kunming 650224, China
紫杉醇(药品名:Taxol,通用名:Paclitaxel)是一种具有抗癌活性的紫杉烷类二萜化合物,1971年首次发现于短叶红豆杉(Taxus brevifolia)中[1]。1992年,紫杉醇被美国FDA批准上市。目前,市场上的紫杉醇主要是从大规模人工栽培的红豆杉属(Taxus)植物中提取,且难以满足市场需求。1993年,Stierle等首次报道了产紫杉醇的内生真菌[2]。这引起研究者的极大兴趣和热情,因为真菌发酵生产紫杉醇具有生产周期短,无需占用大量土地资源,可进行大规模工业化生产,且生产过程可调控等优点,具有巨大的应用前景。
在红豆杉属植物的紫杉醇生物合成途径中,二萜类的通用前体香叶基香叶基焦磷酸(Geranyl geranyl diphosphate, GGPP)经紫杉二烯合成酶(Taxadiene synthase, TS)催化合成紫杉二烯,再经过羟基化反应和酰基转移反应,形成10-去乙酰巴卡亭Ⅲ (10-Deacetyl baccatin Ⅲ, 10-DAB),10-DAB在10-去乙酰巴卡亭Ⅲ-10-O-乙酰基转移酶(DBAT)作用下合成巴卡亭Ⅲ[3],经巴卡亭Ⅲ:3-氨基-3-苯基丙酰转移酶(BAPT)将氨基苯丙酰基移到巴卡亭Ⅲ的C-13侧链[4],最后经3′-N-去苯甲酰-2′-脱氧紫杉醇苯甲酰转移酶(DNTNBT)使侧链C-3′氨基发生苯甲酰化反应合成紫杉醇[5]。此外,10-DAB可作为另一种重要的抗癌药多西紫杉醇(多西他赛)(Docetaxel/taxotere)的半合成前体,其疗效好于紫杉醇,1996年经美国FDA批准上市。近年来的研究表明,巴卡亭Ⅲ和10-DAB也具有显著的抗癌活性[6-7]。因此,从红豆杉中,在筛选产紫杉醇的内生真菌的基础上,筛选产巴卡亭Ⅲ和10-DAB有利于阐明内生真菌的紫杉醇生物合成途径,也具有重要的应用前景。
目前,对红豆杉中内生真菌的筛选主要集中于产紫杉醇的内生真菌,而对产巴卡亭Ⅲ和产10-DAB的内生真菌的筛选研究仅有少量报道[8-12]。本研究通过大规模筛选,以期从南方红豆杉(Taxus chinensis var. mairei)中获得产紫杉醇、产巴卡亭Ⅲ及产10-DAB的内生真菌,为紫杉烷类抗癌药研究提供新的来源。
1 材料和方法 1.1 材料南方红豆杉(Taxus chinensis var. mairei)经允许于2014年12月采自于广东省韶关市乳源县大桥镇和平村的南方红豆杉森林公园。为获得具生物多样性的内生真菌,采集不同地点和不同树龄的南方红豆杉幼茎、叶片和少量树皮,装入密封塑料袋带回实验室备用。采集地位于北纬25°06′36″~25°06′44″,东经113°09′31″~113°09′37″,SG、SL、SK和SJ分别表示4个采集地点的树皮,JA、JB、JC、JD和JE分别表示5个采集点的幼茎,YA、YB、YC、YD和YE表示5个采集点幼茎上的叶片,MA、MB、MC、MD和ME表示5个采集点叶片的研磨物。所获得的内生真菌以上述代号加编号表示。
紫杉醇标准品购自中国食品药品检定研究院, 纯度为99.6%,巴卡亭Ⅲ和10-去乙酰巴卡亭Ⅲ标准样品购自上海同田生物技术股份有限公司,两者纯度均为98.0%。
1.2 内生真菌的分离和纯化及保藏将采摘的南方红豆杉树皮、幼茎及叶片分别用75%乙醇浸泡30 s,弃乙醇后用0.1%升汞溶液浸泡8 min,无菌水冲洗5次,用无菌滤纸吸干表面水分,用无菌解剖刀将树皮切成约1 cm2小片,幼茎切成0.5 cm长小段,每个叶片切成2至3段,同时,消毒叶片置于无菌研钵中研磨成浆,分别接种于添加100 mg L–1硫酸链霉素和100 mg L–1氨苄青霉素钠的PDA固体平板培养基上,于28℃恒温箱中培养。为了排除非内生真菌干扰,将冲洗材料的无菌水也接种于PDA平板培养基上观察是否有真菌长出。
培养1周后每个平板上生长多个内生真菌菌落,采用菌丝顶端纯化法,将菌落顶端菌丝挑出接种于新的PDA固体培养基上培养,直至长出单个菌落,然后接种到PDA斜面培养基上,按1.1节中的方法编号,并常温保存于本实验室中。对于经鉴定可产紫杉烷的内生真菌暂时保藏于冰箱中备用。
1.3 产紫杉烷内生真菌的初筛将纯化的内生真菌接种于PDA平板培养基上培养以活化菌株。活化后接种于装有250 mL YES液体培养基的500 mL三角瓶中,置于AW-211C大容量恒温培养震荡器中,于28℃、150 r min–1下培养7 d。过滤收集菌丝体,置于-18℃冰箱中冷冻。将解冻后的菌丝体置于研钵中研磨成匀浆,加入适量水和等体积的乙酸乙酯,萃取3次,合并3次上清液,置于旋转蒸发仪中,经80℃减压蒸发浓缩得浓缩提取液。
用毛细点样管将样品浓缩液以及紫杉醇、巴卡亭Ⅲ和10-DAB标准样品点样于自制的制备型GF254薄层层析硅胶板上,在封闭的层析缸中展层,展层剂为二氯甲烷:甲醇(20:1),在三用紫外分析仪下观察是否有与紫杉醇、巴卡亭Ⅲ和10-DAB具有相近Rf值的样品,用刀片刮下样品中与标样Rf值相近的硅胶条带,置于1.5 mL的EP管中,加色谱甲醇溶解,离心,取上清液,再重复离心和取上清液操作2次,合并3次的上清液,将上清液放于通风橱中挥发至1 mL。将样品液置于UV-2550型紫外-可见分光光度计下于200~300 nm范围内进行紫外扫描,检测273 nm的光吸收[1],用于筛选产紫杉醇样品。
1.4 产紫杉烷内生菌的复筛和含量及紫杉烷的鉴定经薄层层析和紫外吸收分析的样品提取液体积调整至0.5 mL,然后用0.22 μm的微孔滤膜过滤。紫杉醇、巴卡亭Ⅲ和10-DAB标准样配制成一定浓度后也经微孔滤膜过滤。产紫杉烷的内生真菌的复筛和含量采用高效液相色谱(High performance liquid chromatograph, HPLC)分析。采用安捷伦1220液相色谱仪,色谱柱为ZORBAX Eclipse Plus C18 (4.6 mm× 250 mm, 5μm)。紫杉醇的检测:流动相为甲醇:水(65:35),流速1 mL min–1,检测波长227 nm,柱温45℃,进样量为10 µL。设置甲醇:水梯度洗脱以分离巴卡亭Ⅲ、10-DAB和紫杉醇, 洗脱时间和洗脱剂分别为:0 min,35:65; 2~5 min, 55:45; 6~ 23 min,65:35;24~40 min,100:0,柱温40℃,其他条件与紫杉醇相同。为进一步分离巴卡亭Ⅲ和10-DAB,设置甲醇:水=50:50作为洗脱剂, 其他条件同梯度洗脱。待测样品中的紫杉醇、巴卡亭Ⅲ和10-DAB含量需要制作标准曲线。先将紫杉醇、巴卡亭Ⅲ和10-DAB配制成10 μg mL–1的母液,然后将母液分别稀释成1、2、3、4和6 μg mL–1,分别进行HPLC分析,根据保留时间和标样浓度对应的峰面积获得回归曲线, 根据回归方程计算样品中的紫杉醇、巴卡亭Ⅲ和10-DAB含量和浓度。
质谱分析和检测采用maXis impact超高分辨质谱仪(德国Brucker公司),高分辨质谱条件为喷雾压力:0.3 Bar,干燥温度:180℃,干燥压力:4.0 L min–1, 喷雾电压:3500 V,离子源:ESI。测试工作在华南理工大学分析测试中心完成。
2 结果和分析 2.1 产紫杉烷内生真菌的分离及初步筛选在PDA平板培养基中加入100 mg L–1硫酸链霉素和100 mg L–1氨苄青霉素钠分别抑制革兰氏阳性和革兰氏阴性细菌的生长。此外,将冲洗材料的无菌水接种于PDA平板培基上培养,结果无真菌生长,说明所分离纯化的真菌为内生真菌,而非外源的污染真菌,同时也说明,升汞处理8 min可杀灭外源真菌。本文从4个地点采集树皮和5个地点采集幼茎和叶片,共分离纯化了491株内生真菌。
样品浓缩液经硅胶薄层层析,在样品中有与紫杉醇标样的Rf值相近的条带(图片未示),且数量较多,但难以判断这些内生真菌是否为产紫杉醇内生真菌。同时紫杉醇标样与巴卡亭Ⅲ标样的Rf值相近,难于区分,但两者的Rf值与10-DAB的Rf值易于区分。将与紫杉醇标样Rf值相近的硅胶条带刮下来,经溶解后再进行紫外吸收分析,根据紫杉醇在227 nm处有最大吸收外,在273 nm处也有1个次吸收峰,结果有139株内生真菌在273 nm有明显或不明显的紫杉醇吸收峰(图片未示)。对于巴卡亭Ⅲ和10-DAB来说,在273 nm没有次吸收峰,通过薄层层析,收集与标样巴卡亭Ⅲ和10-DAB的Rf值相近的条带286个(图片未示)。
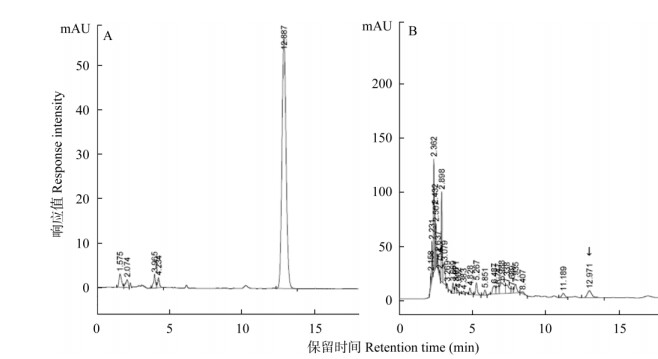
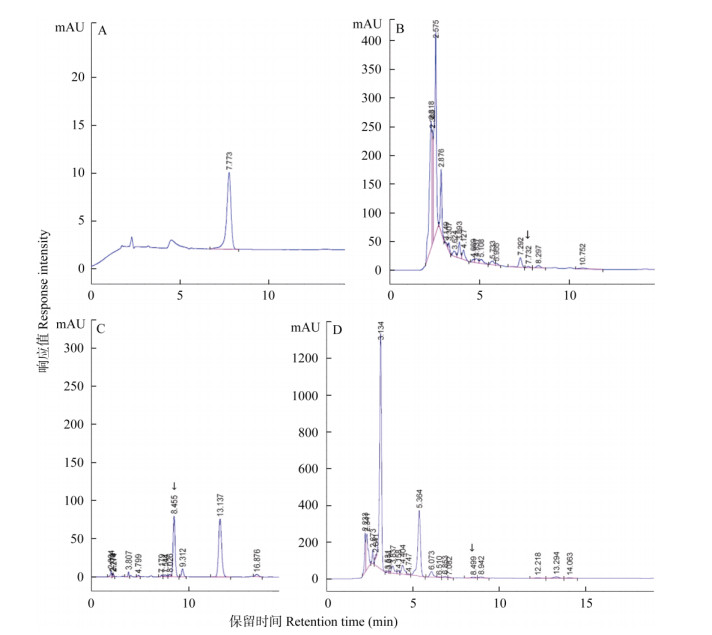
2.2 通过HPLC分析对产紫杉烷类菌株进行复筛和紫杉烷含量测定经HPLC分析,当流动相为甲醇:水=65:35,柱温40℃时,紫杉醇的保留时间(Retention time)为12.971 min (图 1),而巴卡亭Ⅲ和10-DAB的保留时间较早(图未示),且有很多杂质峰与巴卡亭Ⅲ峰和10-DAB峰混和在一起,不易区分,难于鉴定产巴卡亭Ⅲ菌株和产10-DAB菌株,甚至造成错误判断。当流动相为甲醇:水=55:45,柱温35℃时,巴卡亭Ⅲ和10-DAB的保留时间分别为7.77 min和5.66 min,且能较好地与杂质峰分开(图 2)。
|
图 1 紫杉醇的HPLC分析。A:标样; B: SJ17菌株。 Fig. 1 HPLC analysis of taxol. A: Standard sample; B: SJ17 strain. |
|
图 2 巴卡亭Ⅲ和10-DAB的HPLC。A:巴卡亭Ⅲ标样; B:JA13菌株中的巴卡亭Ⅲ; C: 10-DAB标样; D: MC15菌株中的10-DAB。 Fig. 2 Baccatin Ⅲ and 10-DAB by HPLC. A: Standard baccatin Ⅲ; B: Baccatin Ⅲ in JA13 strain; C: Standard 10-DAB; D: 10-DAB in MC15 strain. |
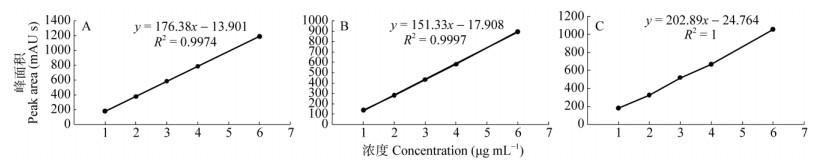
结果表明,有4株菌株可产紫杉醇、巴卡亭Ⅲ和10-DAB,8株菌株能产紫杉醇和巴卡亭Ⅲ,1株菌株能产紫杉醇和10-DAB,1株菌株能产巴卡亭Ⅲ和10-DAB,仅能产紫杉醇的菌株为6株,仅产巴卡亭Ⅲ的菌株为5株(表 1)。因篇幅所限,本文仅展示有代表性的产紫杉醇、产巴卡亭Ⅲ和产10-DAB各1株菌株的HPLC检测结果(图 1, 2)。为检测各菌株中紫杉醇、巴卡亭Ⅲ和10-DAB的含量, 分别制作紫杉醇、巴卡亭Ⅲ和10-DAB的标准曲线,得到回归曲线和回归方程(图 3),根据回归方程分别计算各菌株的紫杉醇、巴卡亭Ⅲ和10-DAB的产量(表 1)。
|
图 3 紫杉醇(A)、巴卡亭Ⅲ (B)和10-DAB(C)的回归曲线和回归方程 Fig. 3 Regression curve and regression equation of taxol (A), baccatin Ⅲ (B) and 10-DAB (C). |
| 表 1 内生真菌的紫杉烷产量(μg L–1) Table 1 Taxane yield (μg L–1) of endophytic fungi |
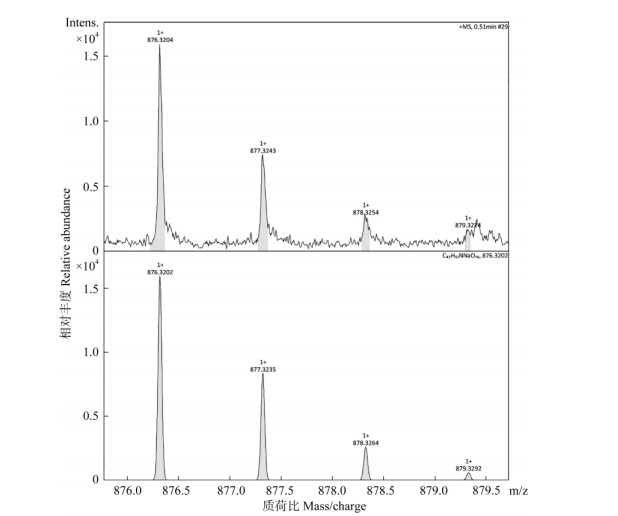
经HPLC分析,上述25菌株在与3个标样相同保留时间上均有离子峰,可初步判断为产紫杉烷的内生真菌。本研究通过高分辨质谱对这25个菌株的样品提取液进行了3个紫杉烷类化合物分析,紫杉醇标样的离子特征峰为[M + Na]+= 876.3218 (图未显示), 其分子式C47H51NO14,分子量853.92,在质谱数据库中的紫杉醇离子特征峰为[M + Na]+=876.3202,两者相差0.0016,即在小数点后第3位数或第4位数有变化。对于表 1中检测的19株可能产紫杉醇的内生真菌,其样品提取液经Na+轰击后,紫杉醇样品的离子特征峰在876.3179~876.3221之间(图片未示),因此可判断这19株菌株为产紫杉醇的内生真菌。对于样品提取液中的巴卡亭Ⅲ和10-DAB的鉴定,也采用类似的鉴定方法,即样品中的巴卡亭Ⅲ和10-DAB的离子特征峰与质谱数据库中的离子特征峰的相对分子质量仅在小数点后第3位数或第4位数有变化。结果表明,表 1中所筛选的18株产巴卡亭Ⅲ和6株产10-DAB的内生真菌均含有巴卡亭Ⅲ或10-DAB (图 4~6)。
|
图 4 高分辨质谱检测SJ17样品提取液中的紫杉醇。上: SJ17菌株; 下:质谱数据库。 Fig. 4 Taxol in extract of SJ17 strain detected by high resolution mass spectrum. Upper: SJ17 strain; Lower: Database of mass spectrum. |
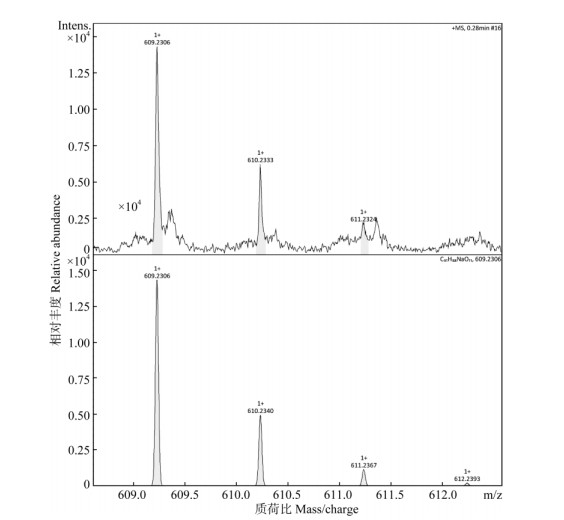
|
图 5 高分辨质谱检测JA13样品提取液中的巴卡亭Ⅲ。上: JA13菌株; 下:质谱数据库。 Fig. 5 Baccatin Ⅲ in extract of JA13 strain detected by high resolution mass spectrum. Upper: JA3 strain; Lower: Database of mass spectrum. |
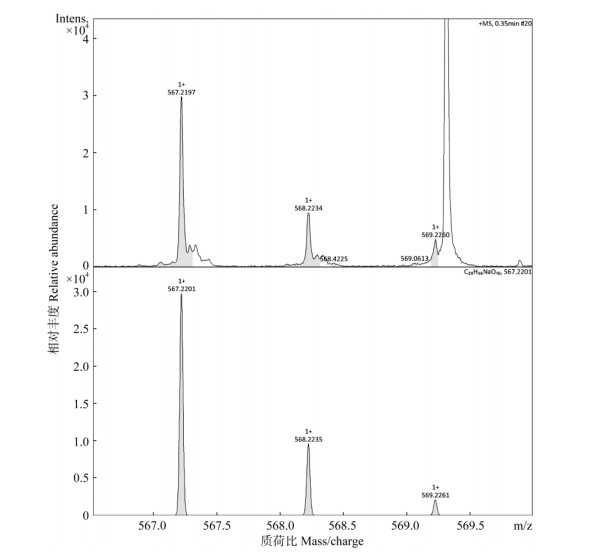
|
图 6 高分辨质谱检测JA5样品提取液中的10-DAB。上:JA5菌株;下:质谱数据库。 Fig. 6 10-DAB in extract of JA5 strain detected by high resolution mass spectrum. Upper: JA5 strain; Lower: Database of mass spectrum. |
目前,对产紫杉醇内生真菌的筛选和研究主要是基于这些真菌可产紫杉醇,可以通过大规模工业化生产,成为红豆杉的替代者。对于产巴卡亭Ⅲ或产10-DAB内生真菌的筛选,主要是基于巴卡亭Ⅲ或10-DAB成为抗癌药紫杉醇或多西紫杉醇进行半合成的前体[13-15]。虽然巴卡亭Ⅲ或产10-DAB具有作为一种抗癌药的潜力,但这需要大量的前期基础研究和较长时间的临床试验。
本研究中,从南方红豆杉中筛选出多达25株产紫杉烷的内生真菌,这在以前的研究中很少见。主要原因一是严格按内生真菌的分离方法进行分离,剔除了非内生真菌,提高了成功率;二是从5个采样点采集红豆杉3个部位样品,通过分离纯化,获得了491个内生真菌,保证了内生真菌的多样性;三是以前的研究仅以筛选产紫杉醇的内生真菌为目的,本研究除筛选产紫杉醇的内生真菌外,还筛选紫杉醇生物合成途径的前体巴卡亭Ⅲ和10-DAB, 扩大了筛选范围。
从以往的研究来看,除从红豆杉属植物中分离获得产紫杉醇的内生真菌外,从非红豆杉植物中也分离获得了较多产紫杉醇的内生真菌[16]。但非红豆杉植物本身不像红豆杉属植物可产紫杉醇,为何会出现这种情况?显然,不能用内生真菌与红豆杉植物长期共生获得红豆杉的紫杉醇生物合成途径基因来解释。最近的基因组学研究表明,非红豆杉属植物欧榛(Corylus avellana)的内生青霉菌(Penicillium aurantiogriseum)和红豆杉产紫杉醇的内生真菌各自具有独立的紫杉醇生物合成进化途径[17]。目前,对内生真菌中的紫杉醇生物合成途径了解得较少。我们认为,不排除红豆杉的内生真菌具有独立的紫杉醇合成进化途径,但更多的是内生真菌通过长期共生,获得红豆杉的紫杉醇生物合成基因。南方红豆杉中产紫杉烷的内生真菌是否具有与红豆杉一致的紫杉醇生物合成途径,需要在生化和分子水平上深入研究。我们相信,还有许多内生真菌还具有紫杉醇生物合成途径的中间产物,仅仅是没有检测而已。随着对产紫杉烷内生真菌的基因组学、生化和分子生物学的深入研究,可阐明内生真菌中紫杉醇生物合成途径与红豆杉中紫杉醇生物合成途径的关系,也有利于阐明产紫杉烷的内生真菌与红豆杉属植物或非红豆杉属植物的共生关系。
对于内生真菌中紫杉醇或紫杉烷的检测主要是基于HPLC或LC-MS技术,而LC-MS被认为是一种更可靠的分析检测技术。传统的薄层层析检测和紫外吸收分析由于方法本身的局限性以及可靠性受到限制,而成为一种辅助性筛选方法。由于目前还尚未建立一种可靠的高通量筛选产紫杉醇或紫杉烷的内生真菌方法,因此,用传统方法对本研究的491株内生真菌进行初步筛选,工作量很大。另一方面,利用HPLC进行分析检测,既可用于产紫杉烷的内生真菌进行复筛,也可用于测定样品中的紫杉醇或紫杉烷的含量。从这种意义上来说,薄层层析初筛显得很有必要。与传统质谱相比,对紫杉烷的检测采用高分辨质谱,分辨力更高,省去了HPLC分析,且结果更可靠[18-19]。事实上,对内生真菌中的紫杉醇或紫杉烷的检测,无论使用哪一种方法均是一种基于现代分析检测技术的“间接”方法。到目前为止,还没有从内生真菌中分离获得足够纯的紫杉醇或紫杉烷类化合物,对其进行核磁共振分析等波谱学分析,以及进行结构解析,从而“直接”确定内生真菌中的紫杉醇或紫杉烷的分子结构。
| [1] | WANI M C, TAYLOR H L, WALL M E, et al. Plant antitumor agents: Ⅵ. Isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia[J]. J Amer Chem Soc, 1971, 93(9): 2325-2327. DOI:10.1021/ja00738a045 |
| [2] | STIERLE A, STROBEL G, STIERLE D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J]. Science, 1993, 260(5105): 214-216. DOI:10.1126/science.8097061 |
| [3] | WALKER K, CROTEAU R. Molecular cloning of a 10-deacetylbaccatin Ⅲ-10-O-acetyl transferase cDNA from Taxus and functional expression in Escherichia coli[J]. Proc Natl Acad Sci USA, 2000, 97(2): 583-587. DOI:10.1073/pnas.97.2.583 |
| [4] | WALKER K, FUJISAKI S, LONG R, et al. Molecular cloning and heterologous expression of the C-13 phenylpropanoid side chain-CoA acyltransferase that functions in taxol biosynthesis[J]. Proc Natl Acad Sci USA, 2002, 99(20): 12715-12720. DOI:10.1073/pnas.192463699 |
| [5] | WALKER K, LONG R, CROTEAU R. The final acylation step in taxol biosynthesis: cloning of the taxoid C13-side-chain N-benzoyltrans ferase from Taxus[J]. Proc Natl Acad Sci USA, 2002, 99(14): 9166-9171. DOI:10.1073/pnas.082115799 |
| [6] | LEE Y H, LEE Y R, PARK C S, et al. Baccatin Ⅲ, a precursor for the semisynthesis of paclitaxel, inhibits the accumulation and suppressive activity of myeloid-derived suppressor cells in tumor-bearing mice[J]. Inter Immunopharmacol, 2014, 21(2): 487-493. DOI:10.1016/j.intimp.2014.06.012 |
| [7] | CHAKRAVARTHI B V, SUJAY R, KURIAKOSE G C, et al. Inhibition of cancer cell proliferation and apoptosis-inducing activity of fungal taxol and its precursor baccatin Ⅲ purified from endophytic Fusarium solani[J]. Cancer Cell Int, 2013, 13(1): 105 DOI:10.1186/1475-2867-13-105 |
| [8] |
YANG L, LIU J J, YANG D L, et al. Screening of endophytic fungi producing baccatin Ⅲ from Taxus yunnanensis and preliminary optimization of the culture media[J].
Prog Mod Biomed, 2007, 7(5): 692-695. 杨磊, 刘佳佳, 杨栋梁, 等. 红豆杉内生真菌中巴卡亭Ⅲ产生菌的筛选及培养基的初步优化[J]. 现代生物医学进展, 2007, 7(5): 692-695. DOI:10.3969/j.issn.1673-6273.2007.05.017 |
| [9] |
ZHENG W L, ZHOU X W, ZHU H F, et al. Identification and isolation of a baccatin Ⅲ-producing endophytic fungus[J].
J Anhui Agri Sci, 2010, 38(25): 13612-13616. 郑文龙, 周选围, 朱慧芳, 等. 一株产巴卡亭Ⅲ红豆杉内生真菌的分离与鉴定[J]. 安徽农业科学, 2010, 38(25): 13612-13616. DOI:10.3969/j.issn.0517-6611.2010.25.024 |
| [10] | LI Y C, YANG J, ZHOU X R, et al. Isolation and identification of a 10-deacetyl baccatin-Ⅲ-producing endophyte from Taxus wallichiana[J]. Appl Biochem Biotechn, 2015, 175(4): 2224-2231. DOI:10.1007/s12010-014-1422-0 |
| [11] | JIAN Z Y, MENG L, XU G F, et al. Isolation of an endophytic fungus producing baccatin Ⅲ from Taxus wallichiana var. mairei[J]. J Ind Microbiol Biotechn, 2013, 40(11): 1297-1302. DOI:10.1007/s10295-013-1320-4 |
| [12] | SREEKANTH D, SYED A, SARKAR S, et al. Production, purification and characterization of taxol and 10DAB Ⅲ from a new endophytic fungus Gliocladium sp. isolated from the Indian yew tree, Taxus baccata[J]. J Microbiol Biotechn, 2009, 19(11): 1342-1347. |
| [13] | HEINIG U, SCHOLZ S, JENNEWEIN S. Getting to the bottom of taxol biosynthesis by fungi[J]. Fungal Div, 2013, 60(1): 161-170. DOI:10.1007/s13225-013-0228-7 |
| [14] | CROTEAU R, KETCHUM R E B, LONG R M, et al. Taxol biosyn-thesis and molecular genetics[J]. Phytochem Rev, 2006, 5(1): 75-97. DOI:10.1007/s11101-005-3748-2 |
| [15] | THORET S, GUÉRITTE F, GUÉNARD D, et al. Semisynthesis and biological evaluation of a novel D-seco docetaxel analogue[J]. Org Lett, 2006, 8(11): 2301-2304. DOI:10.1021/ol060531d |
| [16] | GOND S K, KHARWAR R N, WHITE Jr J F. Will fungi be the new source of the blockbuster drug taxol[J]. Fungal Biol Rev, 2014, 28(4): 77-84. DOI:10.1016/j.fbr.2014.10.001 |
| [17] | YANG Y F, ZHAO H N, BARRERO R A, et al. Genome sequencing and analysis of the paclitaxel-producing endophytic fungus Penicillium aurantiogriseum NRRL 62431[J]. BMC Genom, 2014, 15: 69 DOI:10.1186/1471-2164-15-69 |
| [18] |
LIU M Z. Isolation of paclitaxel-producing endofungus from Taxus chinensis var. mairei[J].
J Trop Subtrop Bot, 2011, 19(4): 360-364. 刘明志. 南方红豆杉产紫杉醇内生真菌的分离[J]. 热带亚热带植物学报, 2011, 19(4): 360-364. DOI:10.3969//j.issn.1005-3395.2011.04.014 |
| [19] |
LIU M Z, DUAN Z G, LÜ Z C, et al. Identification of a high paclitaxel-producing endophytic fungus J11[J].
Chin J Biochem Mol Biol, 2014, 30(10): 1031-1038. 刘明志, 段中岗, 吕镇城, 等. 高产紫杉醇内生真菌J11的鉴定[J]. 中国生物化学与分子生物学报, 2014, 30(10): 1031-1038. DOI:10.13865/j.cnki.cjbmb.2014.10.12 |
 2017, Vol. 25
2017, Vol. 25


