鸡冠花 (Celosia cristata) 是苋科 (Amaranthaceae) 青葙属一年生草本花卉, 原产非洲、亚洲热带地区[1], 行种子繁殖, 可布置花坛和花境, 也可盆栽及作切花材料, 是城市园林景观绿化建设中的优良地被植物, 因其耐热、抗热的特性成为高温地区耐热草花引种的重要材料[2]。
随着温室效应和城市热岛效应的不断加剧, 以及我国设施栽培面积的不断加大, 使得高温成为花卉设施栽培中最常见的逆境因子。高温逆境不仅会使花卉的外观形态结构发生变化, 同时也会降低花卉的观赏价值和使用价值[3], 此外, 高温还严重影响花卉种子萌发和生长发育[4-6]。已有研究表明, 高温不仅会降低种子活力, 抑制种子萌发[7-8], 但多集中在蔬菜[7-8]和粮食[9-10]等作物。另外, 高温还对植株抗氧化系统产生一定的影响, 金春燕等[11]的研究表明, 高温导致番茄 (Lycopersicon esculentum) 发芽10 d的早期幼苗丙二醛 (MDA) 含量、超氧化物歧化酶 (SOD)、过氧化物酶 (POD) 和过氧化氢酶 (CAT) 活性升高, 其升幅与品种耐热性强弱有关; 而陶俊等[12]的研究表明, 高温处理一品红 (Euphorbia pulcherrima) 幼苗2 d, 除叶片POD活性持续增加外, CAT、SOD活性与MDA含量均呈先升高后降低的趋势。目前, 关于鸡冠花耐热性研究主要集中在幼苗耐热生理机理方面, 且高温处理时间较长[2], 由于鸡冠花在晚春、夏季与早秋保护地育苗栽培中, 极易出现短期异常高温天气, 但是, 其种子在短期极端高温条件下的萌发特性如何?可耐高温程度如何?短期极端高温处理的萌发幼苗保护酶活性及膜脂过氧化反应如何变化?尚不可知。为此, 本文以‘世纪’系列玫红色鸡冠花种子为试验材料, 通过粗选试验与精确试验相结合的方法, 系统研究短期极端高温对鸡冠花种子发芽特性、萌发幼苗保护酶活性及膜脂过氧化作用的影响, 以其筛选出促进鸡冠花种子萌发的极端高温, 同时也为设施栽培条件下鸡冠花工厂化育苗、鸡冠花耐热性品种的初步选育以及热带、亚热带地区景观植物的选育和配制奠定理论基础和提供技术支持。
1 材料和方法 1.1 试验材料鸡冠花 (Celosia cristata) 种子是由安徽科技学院花卉基地提供的栽培范围较广的‘世纪’系列玫红色品种, 种子系经低温储藏当年采收的干燥种子。
1.2 萌发试验粗选试验 选取饱满、大小一致的鸡冠花种子经1% KMnO4溶液消毒10 min后, 洗去表面浮色, 分别投入40℃、45℃、50℃、55℃、60℃、65℃的恒温水浴锅中处理30 min, 以室温25℃为对照, 然后置于室温下浸种8 h[13]。每处理随机选取300粒种子, 置于12 cm×12 cm底部放有双层湿润滤纸的发芽盒中, 置于28℃恒温培养箱内催芽, 每天视水分缺失情况采用称重法补充水分[14]。3次重复, 以种子胚根突破种皮约0.20 cm为发芽标准[15], 每天调查发芽情况, 根据发芽情况确定鸡冠花种子耐受高温范围。
精确试验 同样方法选取种子和消毒, 将种子分别投入60℃、61℃、62℃、63℃、64℃、65℃的恒温水浴锅中处理30 min, 以室温25℃为对照, 每处理随机选取1000粒种子, 30%用于发芽指标的测定, 70%用于生理指标的测定。每天调查发芽情况, 待对照有75%种子出芽后, 将发芽盒置于光周期12 h d-1, 昼/夜温度为28℃/18℃, 光照强度为220 μmol m-2s-1的光照培养箱中[16]。处理第7天测定发芽种子的SOD、POD、CAT活性、MDA含量、根系活力、叶绿素含量、主根长、下胚轴长及侧根数量等指标。每处理10次重复。
1.3 方法发芽势、发芽率、发芽指数等的计算按下式[17-18]进行, 适当改动。发芽势 (GE)=前3 d发芽种子数/种子总数×100%, 发芽率 (GP)=7 d内发芽种子数/种子总数×100%, 相对发芽率 (RGP)=处理发芽率/对照发芽率×100%, 发芽指数 (GI)=∑(Gt/Dt), 相对发芽指数 (RGI)=处理发芽指数/对照发芽指数× 100%, 相对伤害率 (RHP)=(对照发芽粒数-处理发芽粒数)/对照发芽粒数×100%, 式中, Gt指发芽天数内总的发芽数, Dt指鸡冠花种子的发芽天数, 长度单位为cm。
叶绿素采用80%丙酮浸泡法测定[19], 准确称取新鲜子叶0.1 g, 加入10 mL 80%丙酮溶液封口浸泡至子叶发白, 提取液在663 nm、646 nm、470 nm下进行比色测定。
根系活力采用TTC法测定[19], 准确称取0.4 g根系, 加入0.4% TTC和磷酸缓冲液 (pH 7.0) 的等量混合液10 mL, 37℃保温4 h后, 加入2 mL 1 mol L-1 H2SO4, 取出根系吸干后, 加入10 mL 95%的乙醇提取24~36 h, 于485 nm下进行比色测定。
SOD、POD、CAT、MDA提取液制备:准确称取0.5 g子叶加入1 mL磷酸缓冲液 (0.05 mol L-1, pH=7.8), 冰浴研磨, 倒入离心管中, 研磨后分别再加入1 mL与2 mL缓冲液清洗研钵, 再倒入离心管中, 4℃下8050×g离心20 min, 上清液即为提取液。
SOD活性测定采用氮蓝四唑NBT还原法[20], 取型号相同的试管, 试管中加入50 μL提取液 (2支对照试管中各加入磷酸缓冲液50 μL), 分别加3 mL反应液, 其中1支对照试管置于暗处, 其余各管于220 μmol m-2s-1日光下反应20~30 min。反应结束后, 以不照光的对照管作空白, 于560 nm下比色测定吸光度。
POD活性用愈创木酚法测定[20], 取50 μL提取液, 再加入3 mL反应混合液 (0.02 mol L-1, pH 6.0磷酸缓冲液50 mL、H2O2 0.019 mL、愈创木酚0.028 mL的混合液), 动力学法测定30 s内酶活性, 酶活性以U min-1g-1FW表示。
CAT活性用过氧化氢法测定[20], 取100 μL提取液加入3 mL反应液 (0.01 mol L-1, pH 7.0磷酸缓冲液20 mL与5 mL 0.1 mol L-1 H2O2的混合液), 动力学法测定, 活性以U min-1g-1 FW表示。
MDA含量测定用硫代巴比妥酸 (TBA) 法[20], 取上清液1 mL, 加入2 mL 0.67% TBA, 封口沸水浴15 min, 迅速冷却 (用冷水冲泡), 倒入离心管中, 900×g下离心20 min, 取上清液于600 nm、532 nm、450 nm处进行比色测定。
1.4 数据分析采用Microsoft Excel 2010进行平均值和标准偏差的计算并制图, 采用SPSS 17.0软件Duncan法进行差异显著性分析。
2 结果和分析 2.1 种子对短期高温忍受能力的筛选由图 1: A可以看出, 除65℃处理外, 随处理温度的逐渐升高, 鸡冠花种子相对发芽率总体呈现先升高后降低而后趋于平缓的变化趋势。40℃~55℃处理后2 d, 鸡冠花种子的相对发芽率均达到峰值, 分别为120.20%、135.35%、145.79%、114.14%;而60℃处理后3 d, 鸡冠花种子的相对发芽率达到峰值, 为98.70%, 之后, 40℃~60℃处理下鸡冠花种子相对发芽率逐渐降低而后趋于平稳, 至处理后7 d, 分别为111.52%、115.94%、120.42%、106.10%和97.44%。而65℃处理后1 d的种子相对发芽率为19.84%, 之后逐渐降低, 至处理后7 d仅为7.04%。说明40℃~60℃能促进鸡冠花种子萌发, 而65℃严重抑制萌发, 因此, 再调查60℃~65℃温度区间的鸡冠花种子发芽率等指标。

|
图 1 短暂高温对鸡冠花种子相对发芽率的影响 Fig. 1 Effects of short-term high temperature on relative germination rate of Celosia cristata seeds |
从图 1: B可以看出, 随着温度的升高, 鸡冠花种子相对发芽率总体呈先升高后降低并趋于平缓的变化趋势。60℃处理后2 d, 鸡冠花种子的相对发芽率达到峰值, 为121.86%, 至处理后7 d, 相对发芽率仍有101.68%。而61℃处理后1 d, 鸡冠花种子的相对发芽率达到峰值, 为55.56%, 显著低于60℃处理, 至处理后7 d仅为27.10%; 62℃、63℃、64℃和65℃处理的鸡冠花种子相对发芽率较低, 分别于处理后1 d、1 d、2 d和7 d达到峰值, 相对发芽率分别为34.92%、22.56%、12.79%和6.81%, 均显著低于60℃处理。这说明60℃处理能促进鸡冠花种子萌发, 而61℃~65℃处理显著抑制其发芽。
2.3 短期极端高温对种子发芽势、相对发芽指数与相对伤害率的影响从图 2可以看出, 60℃处理的鸡冠花种子发芽势与对照差异不大, 说明60℃高温处理能促进鸡冠花种子发芽。随处理温度的升高发芽势迅速降低, 65℃处理的种子发芽势仅为2.22%, 远低于对照和60℃处理, 说明61℃~65℃处理显著抑制鸡冠花种子萌发。鸡冠花种子相对发芽指数的变化趋势与发芽势基本一致, 说明60℃能促进鸡冠花种子萌发, 而61℃~65℃抑制种子萌发。
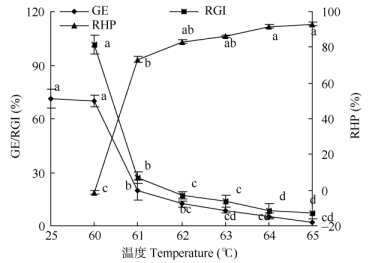
|
图 2 高温对鸡冠花种子发芽势 (GE)、相对发芽指数 (RGI) 和相对伤害率 (RHP) 的影响。不同字母表示差异显著 (P < 0.05), 下同。 Fig. 2 Effects of high temperature on germination energy (GE), relative germination index (RGI) and relative harm rate (RHP) of Celosia cristata seeds. Different letters indicate significant differences at 0.05 level. The same is following Figures. |
从图 2还可以看出, 随着处理温度的升高, 鸡冠花种子的相对伤害率呈逐渐升高的趋势。60℃处理对鸡冠花种子相对伤害率为负值, 仅为-1.41%; 61℃处理的相对伤害率为73.24%; 64℃处理的相对伤害率为91.55%, 均远高于60℃处理, 说明鸡冠花种子可耐60℃高温处理, 而61℃~65℃处理对种子伤害极大。
2.4 短期极端高温对鸡冠花幼苗主根长度、下胚轴长度与侧根数的影响从图 3可见, 随着处理温度的升高, 鸡冠花幼苗主根长度与下胚轴长度均低于对照。60℃处理的鸡冠花幼苗主根长度与下胚轴长度略低于对照, 但差异不大; 而61℃~65℃处理的显著低于对照, 其中64℃和65℃处理, 由于鸡冠花种子发芽受限严重, 其主根长度与下胚轴长度可忽略不计。由图 3还可以看出, 随着温度的升高, 鸡冠花幼苗的侧根数逐渐降低。60℃处理的幼苗侧根数略低于对照, 但差异不大; 63℃处理的, 由于主根生长受抑严重, 导致侧根没有萌发。说明60℃对鸡冠花幼苗主根、下胚轴以及侧根的生长抑制程度较弱。

|
图 3 高温对鸡冠花幼苗主根、下胚轴长度和侧根数的影响 Fig. 3 Effects of high temperature on taproot and hypocotyl length, number of lateral roots of Celosia Cristata seedlings |
从图 4可见, 随着温度的升高, 鸡冠花幼苗叶绿素含量逐渐降低。60℃处理的叶绿素含量仅比对照低8.83%, 差异不显著。温度升高叶绿素含量迅速降低, 63℃处理的叶绿素含量比对照低91.83%, 差异显著; 而64℃和65℃处理, 由于鸡冠花种子发芽受限非常严重, 叶绿素含量均为0, 说明60℃高温对鸡冠花幼苗生长抑制作用较弱。从图 4还可以看出, 随着处理温度的升高, 根系活力的变化趋势与叶绿素含量基本一致, 60℃处理的幼苗根系活力仅比对照低16.63%, 温度升高根系活力迅速下降, 63℃~65℃的根系活力为0, 说明60℃对根系活力抑制作用较弱。
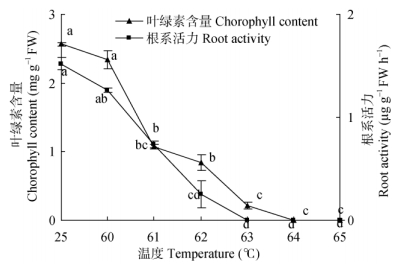
|
图 4 高温对鸡冠花幼苗叶绿素含量和根系活力的影响 Fig. 4 Effects of high temperature on chlorophyll content and root activity of Celosia cristata seedlings |
从图 5可见, 随处理温度的升高, 鸡冠花幼苗的SOD活性呈先升高后降低的趋势。61℃处理的幼苗SOD活性最高, 显著高于对照123.81%;但62℃与63℃处理的SOD活性仍显著高于对照; 而60℃处理仅高于对照4.97%, 与对照差异不显著。POD活性与SOD活性的变化基本一致, 63℃处理的最高, 显著高于对照230.01%, 而60℃~62℃处理的POD活性均显著高于对照。而CAT活性变化趋势虽也呈现先升高后降低的趋势, 但仅以60℃处理的最高, 显著高于对照22.40%; 63℃处理的CAT活性降至最低, 显著低于对照31.25%。从图 5还可以看出, 随着处理温度的升高, 鸡冠花幼苗MDA含量亦逐渐升高。61℃处理的幼苗MDA含量增幅较快, 显著高于对照77.55%; 62℃与63℃处理的虽显著高于对照, 但增幅较慢; 而60℃处理的MDA含量与对照差异不显著。由于64℃与65℃处理的鸡冠花种子活力较差, 生长极差, 因此未进行鸡冠花幼苗保护酶活性及MDA含量的测定。

|
图 5 高温对鸡冠花幼苗SOD、POD、CAT活性和MDA含量的影响 Fig. 5 Effects of high temperature on SOD, POD, CAT activities and MDA content of Celosia cristata seedlings |
在影响种子萌发的众多环境因子之中, 温度是主要的影响因子之一[21]。前期对番茄 (Lycopersicon esculentum)[22]、早熟禾 (Poa annua)[23]、叶用莴苣 (Lactuca sative)[8]等的研究表明, 当温度高于植物的适宜发芽温度时, 种子的相对发芽率、发芽势、相对发芽指数等反映种子萌发整齐度与发芽速度的指标均随着温度的升高而降低。章玉平等[24]的研究表明, 60℃处理鸡冠花种子20 min, 种子存活率为0, 而本研究结果却表明, 60℃对鸡冠花种子相对发芽率、发芽势与相对发芽指数影响不大, 可能与所选鸡冠花品种不同有关, 但随着温度的逐渐升高 (61℃~65℃), 由于高温突破了种子的承受极限, 导致大部分种子发芽严重受限。本研究结果还表明, 60℃对鸡冠花种子相对伤害率为负值, 仅为-1.41%, 这可能与鸡冠花种子属于油质种子, 其脂肪含量较高, 经充分干燥后其耐高温能力也有所增强有关[25]; 之后随着温度的升高其相对伤害率迅速升高, 说明60℃能促进鸡冠花种子萌发, 这也与相对发芽率、发芽势、相对发芽指数等指标相吻合。
高温严重影响植物根系的生长、根系功能的发挥[26]及叶绿素的合成[27]。本研究结果表明, 短暂高温 (61℃~65℃) 不仅严重影响鸡冠花早期幼苗的主根长度、下胚轴长度, 还严重影响其侧根的生长, 导致根系吸收能力降低, 进而影响根系活力与叶绿素的合成, 但60℃处理对鸡冠花早期幼苗根系生长的影响不大, 根系吸收能力较旺盛, 促进植株生长, 利于叶绿素的合成, 说明鸡冠花种子可耐60℃极端高温的短期处理。
在正常条件下, 植物体内活性氧的产生与清除维持动态平衡, 但受到高温、干旱、盐渍等逆境胁迫时, 植物会产生大量活性氧, 形成氧化损伤[28-29], 而SOD、POD与CAT等是植物体内重要的活性氧清除酶, 可有效清除活性氧自由基[30], 其中SOD能歧化超氧阴离子, 生成H2O2和O2, 是抗氧化系统的第一道防线; POD和CAT是清除活性氧的主要酶类, 降低氧化损伤。在植物与高温逆境的互作当中, 活性氧清除酶类的变化亦不同[31]。王凯红等[32]的研究表明, 杜鹃 (Rhododendron simsii) 幼苗遭受高温胁迫后, 其叶片CAT活性随胁迫温度的升高而增加, 而SOD活性则逐渐降低; 而陶俊等[12]的研究却表明一品红 (Euphorbia pulcherrima) 幼苗经短期高温处理后, 其叶片CAT活性在胁迫初期迅速升高, 而后持续降低, 而SOD活性与POD活性却增加, 但SOD活性与对照差异不大; 彭华婷等[33]的研究也表明, 大花三色堇 (Viola tricolor var. hortensis) 经高温胁迫后, 其叶片CAT活性显著降低, 而SOD活性则升高; 李永红等[34]的研究表明, 鸡冠花幼苗经热胁迫处理后, 其叶片SOD活性呈先升高后降低的趋势。本研究结果发现, 鸡冠花种子经短期高温处理后, 随着温度的升高, 早期幼苗SOD、POD与CAT活性均呈先上升后下降的趋势, 但CAT活性降低程度与速率显著高于SOD与POD, 说明高温对CAT较SOD与POD敏感, 高温提早加剧了CAT的热变性, 使其钝化并逐渐失活[35]。SOD、POD与CAT活性的下降说明高温打破了活性氧的产生与清除的动态平衡, 造成活性氧大量积累, 引起氧化胁迫, 进而引起膜质过氧化反应, 导致膜结构的完整性被破坏, 使膜脂过氧化终产物即MDA含量逐渐增加, 进而导致植物代谢紊乱, 加速根系与叶片的老化, 导致根系活力下降, 同时影响叶绿素的合成, 这与Zhao等[36]和Haba等[37]的研究结果基本一致。因此, 在晚春、夏季及早秋等容易出现短期高温的设施栽培条件下, 应注意选择耐高温能力较好的鸡冠花种子进行育苗; 同时也应注意避免鸡冠花种子的高温曝晒, 以免降低种子活力。
| [1] |
WENG D B, WANG H F. The effect of high altitude treatment on antioxidation activity of water extract from Celosia argentea L. (yellow flower)[J].
J Trop Subtrop Bot, 2004, 12(4): 341-344. 翁德宝, 汪海峰. 高空气球搭载实验对普通鸡冠花抗氧化作用的诱变效应[J]. 热带亚热带植物学报, 2004, 12(4): 341-344. DOI:10.3969/j.issn.1005-3395.2004.04.009 |
| [2] |
WEI Y X, LI Y H, GU M, et al. Relationship between the tolerance to high temperature stress and superoxide dismutases in Celosia cristata[J].
Acta Bot Boreali-Occid Sin, 2008, 28(10): 2055-2061. 魏玉香, 李永红, 谷茂, 等. 鸡冠花幼苗热胁迫耐性与其SOD之间的关联[J]. 西北植物学报, 2008, 28(10): 2055-2061. DOI:10.3321/j.issn:1000-4025.2008.10.021 |
| [3] |
LI Y H, WEI Y X. A simple method to evaluate the high temperature tolerance of Celosia cristata[J].
Bull Bot Res, 2009, 29(1): 91-95. 李永红, 魏玉香. 鸡冠花耐热性评价方法研究[J]. 植物研究, 2009, 29(1): 91-95. |
| [4] |
XIAO G J, ZHANG Q, WANG J. Impact of global climate change on agro-ecosystem: A review[J].
Chin J Appl Ecol, 2007, 18(8): 1877-1885. 肖国举, 张强, 王静. 全球气候变化对农业生态系统的影响研究进展[J]. 应用生态学报, 2007, 18(8): 1877-1885. |
| [5] | DOBSON A P, BRADSHAW A D, BAKER A J M. Hopes for the future: Restoration ecology and conservation biology[J]. Science, 1997, 277(5325): 515-522. DOI:10.1126/science.277.5325.515 |
| [6] | DAILY G C, EHRLICH P R. Managing earth's ecosystems: An interdisciplinary challenge[J]. Ecosystem, 1999, 2(4): 277-280. DOI:10.1007/s100219900075 |
| [7] |
SHEN D T, LIU X S, TANG D M, et al. Germination characteristics and heat tolerance in seeds of Spinacia oleracea L. under various high-temperature stresses[J].
J Shanghai Jiaotong Univ (Agri Sci), 2012, 30(4): 31-38. 沈丹婷, 刘晓嵩, 唐东梅, 等. 高温胁迫下菠菜种子萌发特性及耐热性[J]. 上海交通大学学报 (农业科学版), 2012, 30(4): 31-38. DOI:10.3969/J.ISSN.1671-9964.2012.04.006 |
| [8] |
ZHANG Q, HAN Y Y, FAN S X, et al. Germination characteristics of Lactuca sative L. under different heat stress[J].
Acta Agric Boreali-Occid Sin, 2010, 19(5): 171-176. 张侨, 韩莹琰, 范双喜, 等. 高温胁迫下不同品种叶用莴苣种子萌发特性[J]. 西北农业学报, 2010, 19(5): 171-176. DOI:10.3969/j.issn.1004-1389.2010.05.038 |
| [9] |
NING D K, XIE L Y, YANG Z Z, et al. Effect of temperature increasing on germination of maize seeds[J].
J Maize Sci, 2013, 21(2): 102-105, 111. 宁大可, 谢立勇, 杨振中, 等. 温度升高对玉米种子萌发的影响[J]. 玉米科学, 2013, 21(2): 102-105, 111. DOI:10.3969/j.issn.1005-0906.2013.02.020 |
| [10] |
MA J H, WANG H F, WANG Y G, et al. Effects of high temperature aging on germination and physiological characteristics of different cotton varieties[J].
Cott Sci, 2005, 17(1): 42-46. 马金虎, 王宏富, 王玉国, 等. 高温老化对棉花种子发芽及生理特性影响的研究[J]. 棉花学报, 2005, 17(1): 42-46. DOI:10.3969/j.issn.1002-7807.2005.01.009 |
| [11] |
JIN C Y, GUO S R, ZHU L Y, et al. Effects of high temperature on seed germination and seedling growth and antioxidant system of tomato[J].
Acta Agri Shanghai, 2011, 27(2): 92-95. 金春燕, 郭世荣, 朱龙英, 等. 高温对番茄种子萌发及早期幼苗生长和抗氧化系统的影响[J]. 上海农业学报, 2011, 27(2): 92-95. DOI:10.3969/j.issn.1000-3924.2011.02.022 |
| [12] |
TAO J, YU J, YU L Q, et al. Effects of short-term high temperature stress on antioxidant system in poinsettia[J].
Acta Hort Sin, 2008, 35(11): 1681-1684. 陶俊, 俞菊, 俞丽琴, 等. 短期高温胁迫对一品红幼苗抗氧化系统的影响[J]. 园艺学报, 2008, 35(11): 1681-1684. |
| [13] |
LI Y, SHEN Y Y, YAN S G. Comparative studies of effect of NaCl stress on the seed germination of 5 forage species[J].
Pratac Sci, 1997, 14(2): 50-53. 李昀, 沈禹颖, 阎顺国. NaCl胁迫下5种牧草种子萌发的比较研究[J]. 草业科学, 1997, 14(2): 50-53. |
| [14] |
CHEN H Y, ZHANG J H, CHEN Y P, et al. Effects of NaCl stress on germination characteristics of radish (Raphanus sativus L.) cultivars[J].
Jiangxi Sci, 1999, 17(2): 96-99. 陈火英, 张建华, 陈云鹏, 等. NaCl胁迫对不同品种萝卜种子发芽特性的影响[J]. 江西科学, 1999, 17(2): 96-99. DOI:10.3969/j.issn.1001-3679.1999.02.006 |
| [15] |
LIANG H Y, ZHANG X P, HU Z C. Effect of Ca2+ on germination of impatiens seeds under salt stress[J].
Jiangsu Agri Sci, 2011, 39(6): 327-329. 梁海英, 张雪平, 胡志超. Ca2+对盐胁迫下凤仙花种子发芽的影响[J]. 江苏农业科学, 2011, 39(6): 327-329. DOI:10.3969/j.issn.1002-1302.2011.06.131 |
| [16] |
ZHU S Y, ZHANG X L, LUO T K, et al. Response of cauliflower seed vigor, antioxidant enzyme activity and seedling photosynthetic pigment to NaCl stress[J].
China Veget, 2012, 1(2): 41-47. 朱世杨, 张小玲, 罗天宽, 等. 花椰菜种子活力和抗氧化酶活性及幼苗光合色素对NaCl胁迫的响应[J]. 中国蔬菜, 2012, 1(2): 41-47. |
| [17] |
LIU H L, LI J F, XU X Y, et al. Influence of salt concentration on germination of different tomato seeds[J].
J NE Agri Univ, 2008, 39(5): 28-33. 刘洪兰, 李景富, 许向阳, 等. NaCl胁迫对不同番茄种子萌芽的影响[J]. 东北农业大学学报, 2008, 39(5): 28-33. DOI:10.3969/j.issn.1005-9369.2008.05.007 |
| [18] |
JIA S S, GAO Q H, ZHANG X P, et al. Influence of salt stress on germination characteristics of Celosia cristata and Calendula officinalis seeds[J].
J Anhui Sci Techn Univ, 2013, 27(6): 34-38. 贾双双, 高青海, 张雪平, 等. NaCl胁迫对鸡冠花和金盏菊种子发芽特性的影响[J]. 安徽科技学院学报, 2013, 27(6): 34-38. |
| [19] |
GAO J F.
Experimental Guidance for Plant Physiology[M]. Beijing: Higher Education Press, 2006: 57, 74.
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 57, 74. |
| [20] |
ZHAO S J, SHI G A, DONG X C.
Techniques of Plant Physiological Experiment[M]. Beijing: China Agricultural Science and Technology Press, 2002: 95-97.
赵世杰, 史国安, 董新纯. 植物生理学实验指导[M]. 北京: 中国农业科学技术出版社, 2002: 95-97. |
| [21] |
WANG J N, LI D L. Seed germination reponses of four Limonium species to temperature[J].
Pratac Sci, 2012, 29(2): 249-254. 王俊年, 李得禄. 4种补血草属植物种子发芽对温度的响应[J]. 草业科学, 2012, 29(2): 249-254. |
| [22] |
HE J Y, WANG J T, BAI X M, et al. Effects of temperature on seed germination characteristics of eight wild Poa germplasm[J].
Pratac Sci, 2013, 30(3): 383-389. 贺佳圆, 王靖婷, 白小明, 等. 温度对8个野生早熟禾材料萌发特性的影响[J]. 草业科学, 2013, 30(3): 383-389. |
| [23] |
ZHANG Y P, ZHONG Z C. Effect of extremely higher temperature on germination and seedling growth of Celosiae cristatae[J].
Chin Agri Sci Bull, 2009, 25(19): 174-177. 章玉平, 钟志超. 极端高温处理对鸡冠花种子萌发与生长的影响[J]. 中国农学通报, 2009, 25(19): 174-177. |
| [24] | TAHIR I S A, NAKATA N, YAMAGUCHI T, et al. Influence of high shoot and root-zone temperatures on growth of three wheat genotypes during early vegetative stages[J]. J Agron Crop Sci, 2008, 194(2): 141-151. DOI:10.1111/j.1439-037X.2008.00298.x |
| [25] |
ZHANG R S, ZHANG S, LI D Z, et al. Primary report on heat tolerance of rape seed[J].
J Inner Mongolia Agri Univ, 2005, 26(4): 125-126. 张润生, 张胜, 李得宙, 等. 油菜种子耐高温研究初报[J]. 内蒙古农业大学学报, 2005, 26(4): 125-126. DOI:10.3969/j.issn.1009-3575.2005.04.035 |
| [26] | XU Q Z, HUANG B R, WANG Z L. Photosynthetic responses of creeping bentgrass to reduced root-zone temperatures at supraoptimal air temperature[J]. J Amer Soc Hort Sci, 2002, 127(5): 754-758. |
| [27] | TOMÁNKOVÁ K, LUHOVÁ L, PETŘIVALSKÝ M, et al. Bioche-mical aspects of reactive oxygen species formation in the interaction between Lycopersicon spp. and Oidium neolycopersici[J]. Physiol Mol Plant Pathol, 2006, 68(1/2/3): 22-32. DOI:10.1016/j.pmpp.2006.05.005 |
| [28] |
HU X H, LI Y, ZOU T C. Studies on physiological responses to aluminum stress of Plantago asiatica[J].
J Trop Subtrop Bot, 2014, 22(5): 495-501. 胡雪华, 李蕴, 邹天才. 车前对铝胁迫生理响应的研究[J]. 热带亚热带植物学报, 2014, 22(5): 495-501. DOI:10.3969/j.issn.1005-3395.2014.05.011 |
| [29] |
LUO Y L, BI T J, SU Z L, et al. Physiological response of Kalanchoe tubiflora leaves to drought stress and rewatering[J].
J Trop Subtrop Bot, 2014, 22(4): 391-398. 罗银玲, 毕婷菊, 苏志龙, 等. 棒叶落地生根对干旱与复水的生理响应[J]. 热带亚热带植物学报, 2014, 22(4): 391-398. DOI:10.3969/j.issn.1005-3395.2014.04.010 |
| [30] | SIDDIQUI M H, AL-KHAISHANY M Y, AL-QUTAMI M A, et al. Morphological and physiological characterization of different geno-types of Faba bean under heat stress[J]. Saudi J Biol Sci, 2015, 22(5): 656-663. DOI:10.1016/j.sjbs.2015.06.002 |
| [31] |
CUI M, WEI J J, SU X X, et al. Effect of high temperature on the lipid peroxidation and protein expression in cowpea leaves[J].
J SW Univ (Nat Sci), 2016, 38(4): 21-27. 崔萌, 魏娟娟, 苏晓星, 等. 高温对豇豆叶片细胞膜脂过氧化和蛋白质表达的影响[J]. 西南大学学报 (自然科学版), 2016, 38(4): 21-27. DOI:10.13718/j.cnki.xdzk.2016.04.003 |
| [32] |
WANG K H, LIU X P, ZHANG L H, et al. Physiological-biochemical response of five species in Rhododendron L. to high temperature stress and comprehensive evaluation of their heat tolerance[J].
J Plant Resour Environ, 2011, 20(3): 29-35. 王凯红, 刘向平, 张乐华, 等. 5种杜鹃幼苗对高温胁迫的生理生化响应及耐热性综合评价[J]. 植物资源与环境学报, 2011, 20(3): 29-35. DOI:10.3969/j.issn.1674-7895.2011.03.005 |
| [33] |
PENG H T, GAO Y, DU H M, et al. Effects of heat stress on related physiological indexes of pansy cultivar seedlings[J].
J Shanghai Jiaotong Univ (Agri Sci), 2012, 30(6): 66-71. 彭华婷, 高悦, 杜红梅, 等. 高温胁迫对大花三色堇幼苗相关生理指标的影响[J]. 上海交通大学学报 (农业科学版), 2012, 30(6): 66-71. DOI:10.3969/J.ISSN.1671-9964.2012.06.0013 |
| [34] |
LI Y H, WEI Y X. Relationship between the tolerance difference to high temperature stress and superoxide dismutases (SODs) in different cultivars of Celosia cristata[J].
J Agri Biotechn, 2009, 17(1): 126-131. 李永红, 魏玉香. 鸡冠花品种间耐热差异与超氧化物歧化酶 (SODs) 之间的关联[J]. 农业生物技术学报, 2009, 17(1): 126-131. DOI:10.3969/j.issn.1674-7968.2009.01.021 |
| [35] |
YANG Z, LI S Y, WANG J, et al. Experimental study on the loss of cabbage seed vitality during high temperature drying process[J].
Acta Agri Boreali-Sin, 2007, 22(5): 67-70. 杨昭, 李思远, 王娟, 等. 高温干燥对白菜种子生命物质破坏机理的研究[J]. 华北农学报, 2007, 22(5): 67-70. |
| [36] | ZHAO H, DAI T B, JING Q, et al. Leaf senescence and grain filling affected by post-anthesis high temperatures in two different wheat cultivars[J]. Plant Growth Regul, 2007, 51(2): 149-158. DOI:10.1007/s10725-006-9157-8 |
| [37] | de la HAHA P, de la MATA L, MOLINA E, et al. High temperature promotes early senescence in primary leaves of sunflower (Helianthus annuus L.) plants[J]. Can J Plant Sci, 2014, 94(4): 659-669. DOI:10.4141/cjps2013-276 |
 2017, Vol. 25
2017, Vol. 25


