2. 福建省精密仪器农业测试实验室, 福州 350003;
3. 福建省武夷山生物研究所, 福建 武夷山 354300
2. Precise Measurement of Agriculture, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China;
3. Wuyihshan Biological Institute of Fujian Province, Wuyishan 354300, Fujian, China
土壤微生物是土壤生态系统的重要组分之一, 它与土壤活性和土壤肥力有着密切关系, 在土壤形成与发育、物质转化和能量传递等过程中发挥着重要作用, 是评价土壤健康的重要指标之一[1]。土壤微生物群落结构和多样性能够反映土壤环境质量的变化过程, 并揭示微生物的生态功能差异, 具有丰富的科学内涵及生态服务功能[2], 对保持土壤质量和生态系统稳定性有着重大意义[3]。因此, 土壤微生物群落结构和多样性对气候变化 (如温度升高、降水格局变化等) 和各种土壤理化因子的响应和适应成为全球变化生态学研究的核心问题[4]。
武夷山国家自然保护区作为世界同纬度带现存面积最大、保存最完整的中亚热带森林生态系统, 植被具有明显的垂直分布谱带, 许多学者从不同角度对其开展了研究[5-7]。庄铁诚等[8]利用平板涂布的方法比较了春末和秋末两个季节武夷山常绿阔叶林土壤中细菌、放线菌和丝状真菌的动态变化; 何容等[9]分析了武夷山不同海拔及植被土壤微生物量的季节动态及主要影响因子; 吴则焰等[10]运用磷脂脂肪酸标记法 (PLFA) 研究了武夷山不同海拔植被带 (常绿阔叶林、针叶林、亚高山矮林、高山草甸) 土壤微生物群落的结构特征。但是由于试验方法的局限性, 这些研究结果都未能全面而客观地描述武夷山常绿阔叶林土壤中微生物的种类, 群落结构等。
土壤微生物多样性的研究方法很多, 但传统的筛选培养方法仅限于对环境中极少部分可培养微生物类群的研究[11], 因此, 近年来, 非培养技术如变性梯度凝胶电泳PCR-DGGE和末端限制性片段长度多态性T-RFLP[12]等分子生物学方法, 以及脂肪酸甲酯FAME和磷脂脂肪酸PLFA等细胞组分分析方法[13]被引入到土壤微生物多样性研究中。高通量测序技术 (Next generation sequencing, NGS) 由于产生的数据量大、测序周期短、准确率高以及成本低等优点, 而在微生物生态学的研究中凸显出明显的优越性[14]。在该技术中, Pyrosequencing测序技术和Illumina Miseq测序技术都已应用于土壤微生物多样性分析, 但Illumina Miseq技术具有更高的测序深度、更好的测序质量, 且成本更低, 因此应用更加广泛[15]。本研究拟采用Illumina Miseq PE300测序技术研究不同季节武夷山常绿阔叶林土壤微生物群落组成和多样性, 探讨土壤微生物群落多样性对季节变化的响应规律, 以期进一步揭示中亚热带森林生态系统植物多样性与土壤微生物多样性的耦合关系, 为更好地维持武夷山自然生态系统平衡提供理论依据。
1 材料和方法 1.1 试验地概况研究地点位于武夷山市星村镇四新村附近, 现为武夷山生物多样性观测样地, 样地所在区域原为国有“四新林业”采育场, 一直开展商业性采伐作业, 2000年划归武夷山风景名胜区管理委员会管理, 2001年至2002年对杉木等树种进行间伐, 后实施封山育林, 现属于九曲溪生态保护区。地理坐标为27°35′ 24.23′′ N, 117°45′55.43′′ E, 海拔约450~580 m。该区域属典型的亚热带季风湿润气候, 年均温17.0℃~18.4℃, 年均相对湿度75%~84%, 年降水量1800 mm, 年均日照时数1910.2 h, 无霜期227~246 d。常绿阔叶林是武夷山的地带性森林植被, 分布面积很大, 主要分布于海拔1200 m以下, 呈复层结构, 优势种为米槠 (Castanopsis carlesii)、甜槠 (C. eyrei)、木荷 (Schima superba) 等, 种类组成复杂; 土壤以山地黄壤和红壤为主, 土层厚≥80 cm, 枯枝落叶层厚3~4 cm。
1.2 土壤样品采集试验于2014年9月至2015年6月根据不同季节 (秋季为2014年9月22日、冬季为2014年12月22日, 春季为2015年3月19日、夏季为2015年6月23日) 分别采集武夷山常绿阔叶林表层 (0~10 cm) 土壤, 共采样4次, 在同一海拔选取具有代表性的3个样地, 每个样地采用五点法取样。先除去表层凋落物, 再用无菌土壤取样器采集样土, 并按照同比例混匀, 混合土样时剔除石砾和树根, 均匀后装入无菌自封袋内, 放在4℃冷藏箱保存并尽快带回实验室。将土样无菌条件下充分混匀, 过2 mm筛后分为2份。一份放在-70℃冰箱中保存, 用于土壤微生物多样性分析; 另一份自然风干后过筛, 用于土壤理化性质分析。
1.3 土壤理化性质测定参照《土壤农化分析》[16]进行土壤理化性质测定。土壤总有机碳采用重铬酸钾氧化-外加热法测定, 土壤全氮采用凯氏定氮法测定; 土壤pH采用电位法测定; 土壤铵态氮采用氯化钾浸提-靛酚蓝比色法测定; 土壤有效钾采用冷硝酸浸提-火焰光度法测定; 土壤湿度采用烘干法测定; 土壤温度利用土壤温湿度计测定。
1.4 土壤微生物多样性分析土壤总DNA的提取 利用Power Soil DNA Isolation Kit (MO BIO Laboratories Inc. USA) 试剂盒, 对每个季节的3个样地土壤分别按说明书提取土壤总DNA。土壤总DNA保存于-70℃冰箱待用。
PCR扩增和测序 以土壤总DNA作为模板, 利用特异引物对338F (5′-ACTCCTACGGGAGGC-AGCA-3′) 和806R (5′-GGACTACHVGGGTWTCTA-AT-3′) 扩增细菌16S rDNA基因V3~V4区; 同时利用特异引物对Arch519F (5′-CAGCCGCCGCGGTA-A-3′) 和Arch915R (5′-GTGCTCCCCCGCCAATTC-CT-3′) 扩增古菌16S rDNA基因V3~V4区。引物由上海美吉生物医药科技有限公司合成, 同时在前引物5′端添加Barcode序列区分样品。反应体系参考蔡艳等[18]的方法。每个样品3次重复, 将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测, 使用AxyPrepDNA凝胶回收试剂盒 (AXYGEN公司) 切胶回收PCR产物, Tris-HCl洗脱, 1.5%琼脂糖凝胶电泳检测。16S rRNA基因V3~V4区测序文库构建和Illumina Miseq测序由上海美吉生物医药科技有限公司完成。
生物信息分析方法 序列分析利用QIIME software package和UPARSE pipeline来完成。原始序列去掉接头、5′端添加的Barcode序列和引物序列, 利用QIIME的默认参数过滤掉低质量、具有嵌合体结构的序列; 然后利用UPARSE软件生成OUT (Operational taxonomic units)(序列相似度≥97%), 利用RDP从每个OTU中选择一条序列作为OTU代表; 根据获得的OTU数据, 以测序样本的序列数为横坐标, OTU值作为纵坐标绘出每个样品的稀释曲线, 同时根据样本中所共有和独有的OTU数目作OTU分布Venn图。同时对数据进行冗余分析 (Redun-dancy analysis, RDA), 它是一种直接梯度分析方法, 能从统计学的角度来评价一个或一组变量与另一组多变量数据之间的关系。生物多样性指数Chao指数和Shannon指数由mothur软件完成, Chao指数是用来估计群落中物种总数的指数, Shannon指数是用来估算样品中物种多样性的指数。
多样本相似度树状图构建, 利用描述群落组成关系和结构的算法计算样本间的距离, 即根据β-多样性距离矩阵进行层次聚类分析, 使用非加权组平均法UPGMA (Unweighted pair group method with arithmetic mean) 算法构建树状结构, 得到便于可视化分析的树状关系形式图。
2 结果和分析 2.1 土壤的理化性质不同季节土壤的部分理化性质见表 1。土壤pH为3.68~3.98, 表明武夷山常绿阔叶林土壤为典型的南方酸性土壤。土壤平均含水量均大于30.50%, 以秋季最低。各季节土壤主要营养成分含量的差异性分析表明, 总有机碳和全氮含量均为春季 > 秋季 > 夏季 > 冬季; 速效磷含量为秋季 > 冬季 > 春季 > 夏季; 有效钾含量为春季 > 秋季 > 冬季 > 夏季。土壤温度表现为夏季 > 春季 > 秋季 > 冬季。其中有效钾夏季与其他季节的差异显著, 冬季和夏季的土壤温度呈显著差异, 秋季土壤pH与其他季节差异显著, 其他理化指标在四季内均无显著差异。
| 表 1 武夷山常绿阔叶林土壤基本理化性质的季节变化 Table 1 Seasonal variation of physico-chemical properties of evergreen broad-leaved forest soils in Wuyi Mountain |
表 2为武夷山常绿阔叶林土壤样品中的有效细菌和古菌16S rDNA V3~V4区序列的数量, 平均长度和土壤微生物多样性。细菌Chao指数表现为夏季 > 秋季 > 冬季 > 春季, 土壤细菌Chao指数在夏季最高, 但不同季节间差异不显著 (P > 0.05);虽然夏季的Chao指数较高, 但Shannon指数却比春季低0.21, 表明春季细菌的多样性和菌群结构更加丰富。古菌Shannon指数表现为春季 > 秋季 > 夏季 > 冬季, 其中夏季的Chao指数和Shannon指数分别比冬季高21.7%和0.27, 表现出显著性差异 (P < 0.05)。
| 表 2 数据统计及α-多样性指数 Table 2 Data statistics and α-diversity of 16S rRNA gene sequences |
统计多个样本中共有和独有的OTU数目并作Venn图 (图 1)。春夏秋冬4个样品中细菌分别含有792、781、778和793个OTUs, 一共含有840个不同的OTUs, 其中698个OTUs是共有的, 占83.1%;古菌分别含有101、101、99、106个OTUs, 一共含有120个不同的OTUs, 其中84个OTUs是共有的, 占70.0%。
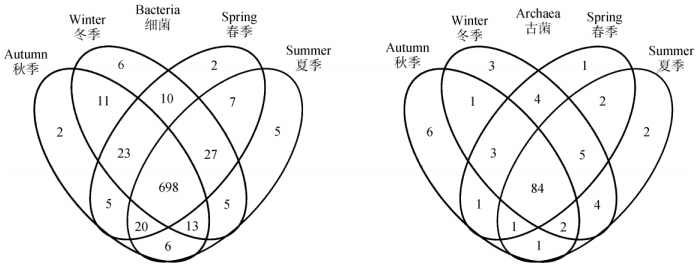
|
图 1 四季细菌和古菌组成的Venn分析 Fig. 1 Venn analysis of bacteria and archaea community in four seasons |
对每个有效序列进行从门 (Phylum) 到属 (Genus) 的注释分类, 在门水平上的群落结构见图 2。细菌共鉴定出23门, 其中酸杆菌门 (Acidobacteria)、放线菌门 (Actinobacteria)、绿弯菌门 (Chloroflexi)、蓝细菌门 (Cyanobacteria)、浮霉菌门 (Planctomycetes)、变形菌门 (Proteobacteria) 和疣微菌门 (Verruco-microbia) 等7门细菌总量分别占秋季、冬季、春季、夏季土壤细菌的96.1%、94.8%、94.0%、94.5%。酸杆菌门含量最为丰富, 其包含的有效序列 (58632) 和OTUs (581) 分别占总数的38.82%和18.47%;第二丰富的门为变形菌门, 其包含的有效序列 (52517) 和OTUs (1026) 分别占总数的34.77%和32.63%。值得一提的是, 武夷山常绿阔叶林土壤中酸杆菌门细菌的丰富度相对最高 (即含有最多有效的16S rDNA克隆序列), 可能与该地区的酸性土壤密切相关。虽然酸杆菌门含有较多的克隆序列, 但其在OTUs种类多样性上远远低于变形菌门 (低13.16%), 而一般土壤样品中的变形菌门细菌是最丰富的, 这说明武夷山常绿阔叶林土壤又具有一般土壤微生物群落组成的共性[18]。
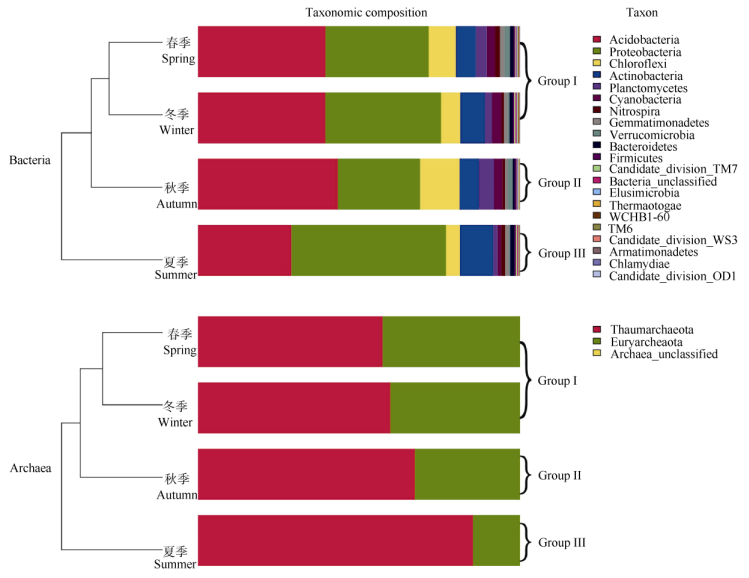
|
图 2 门水平上的聚类树与柱状图组合分析 Fig. 2 Cluster tree and histogram of dominant phylum |
本研究共鉴定出159科, 其中Acetobacteraceae、Acidothermaceae、Anaerolineaceae、Bradyrhizobiaceae、Burkholderiaceae、Caulobacteraceae、Chitinophagaceae、Gemmatimonadaceae、Haliangiaceae、Hyphomicrobiaceae、sedis、Rhodospirillaceae、Thermotogaceae、Xanthobac-teraceae、Xanthomonadales_uncultured和Xiphine-matobacteraceae等20科的细菌克隆数均超过100个, 且为土壤的优势菌群。
在武夷山常绿阔叶林土壤中鉴定出古菌2门, 分别为广古菌门 (Euryarchaeota) 和奇古菌门 (Thaumarchaeota)。其中广古菌门包含的有效序列 (23827) 和OTUs (216) 分别占总数的32.35%和53.07%;奇古菌门包含的有效序列 (49785) 和OTUs (178) 分别占总数的67.59%和43.73%。有17科古菌被鉴定出, 其中Terrestrial_group_norank、Terrestrial_Miscellaneous_GpTMEG、Miscellaneous_ Crenarchaeotic_Group_norank、South_African_Gold_ Mine_Gp_1SAGMCG-1_norank、Thaumarchaeota_ unclassified、Soil_Crenarchaeotic_GroupSCG_incertae_ sedis、South_African_Gold_Mine_Gp_1SAGMCG-1_ incertae_sedis等7科古菌克隆数均超过100个, 为土壤中的优势古菌群。
从细菌属和古菌属的热图和聚类树可见 (图 2, 3), 在细菌群落结构中, 含量超过1%的属有Subgroup_2_norank、Candidatus Solibacter、Acido-bacteriaceae Subgroup 1 uncultured、JG37-AG-4 norank、DA111 norank、Acidothermus Xanthomo-nadales Proteobacteria norank、Bradyrhizobium Proteobacteria、Xanthobacteraceae Proteobacteria uncultured、WD272 norank、Bryobacter、alphaI cluster norank、Burkholderia和Acidimicrobiales norank。武夷山常绿阔叶林同样也拥有大量的酸杆菌门细菌, 其中Candidatus Solibacter、Acidobacteriaceae Sub-group 1 uncultured和Bryobacter属总含量分别占各季节总克隆数的21.08%、20.13%、21.65%、20.03%; Bryobacter属目前只有1种Bryobacter aggregatus[20], 且分离自千里之外的西伯利亚的酸性水藓泥炭沼泽地, 由此可见武夷山常绿阔叶林与西伯利亚的酸性水藓泥炭沼泽地可能在生态学上具有一定的相似性, 同时表明该物种具有广泛的生存环境, 可能是一种潜在的微生物资源。Candidatus_Solibacter在春秋冬3个季节的含量相当 (9.67%~9.77%), 低于夏季的含量 (14.07%); Acidobacteriaceae_Subgroup_1_ uncultured的含量为冬季 (8.76%) > 秋季 (8.35%) > 春季 (7.39%) > 夏季 (3.03%)。慢性根瘤菌 (Bradyr-hizobium) 是一类土壤革兰氏阴性菌, 在生物固氮方面具有重要的生态价值, 其含量为夏季 (5.08%) > 冬季 (3.84%) > 春季 (3.24%) > 秋季 (2.67%); Acidothermus的含量为夏季 (5.97%) > 冬季 (4.69%) > 秋季 (3.65%) > 春季 (3.51%), 另外未知菌群Subgroup_2_norank和JG37-AG-4_norank的季节性变化较大, 分别为5.88%~14.28%和2.71%~8.02%。
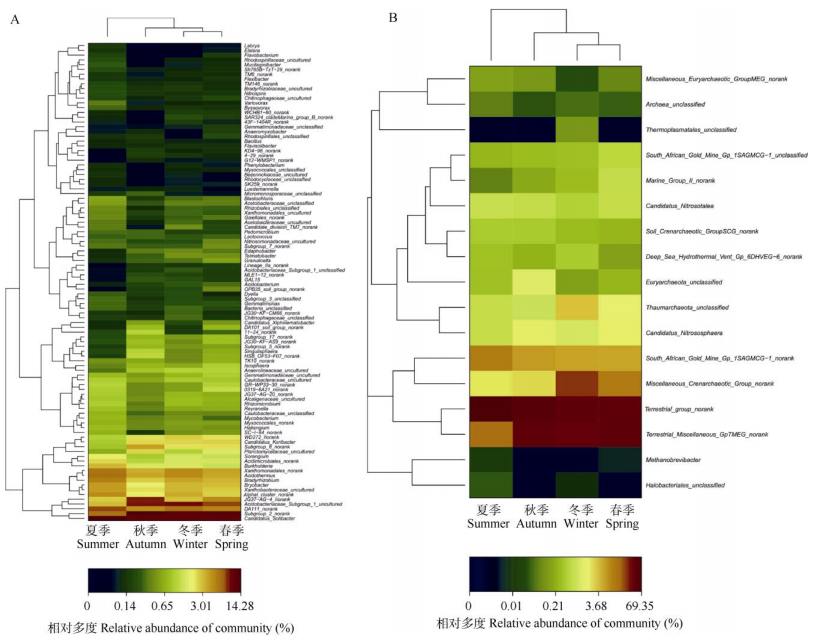
|
图 3 属水平上的热图和聚类树分析 Fig. 3 Heatmap and clustering tree analysis of dominant genera |
古菌类群包括奇古菌门和广古菌门, 其中奇古菌门包含Miscellaneous_Crenarchaeotic_Group_norank、Soil_Crenarchaeotic_GroupSCG_norank、South_African_ Gold_Mine_Gp_1SAGMCG-1_norank、South_African_ Gold_Mine_Gp_1SAGMCG-1_unclassified、Terrestrial_ Miscellaneous_GpTMEG_ norank、Thaumarchaeota_ unclassified和Terrestrial_ group_norank共7个类群; 广古菌门包含Candidatus_ Nitrososphaera、Candidatus_ Nitrosotalea、Deep_Sea_Hydrothermal_Vent_Gp_ 6DHVEG-6_norank、Euryar chaeota_unclassified、Halobacteriales_unclassified、Marine_Group_Ⅱ_norank、Methano brevibacter、Miscellaneous_Euryarchaeotic_ GroupMEG_norank和Thermoplasmatales_unclassified共9个类群。分别以Terrestrial_group_norank、Terre-strial_Miscellaneous_GpTMEG_norank和Miscella-neous_Crenarchaeotic_Group_norank为优势种群。四季中Terrestrial_group_norank的含量为夏季 (69.35%) > 冬季 (47.87%) > 春季 (35.82%) > 秋季 (35.43%); Terrestrial_Miscellaneous_GpTMEG_norank的含量为春季 (40.76%) > 冬季 (37.73%)>秋季 (31.01%) > 夏季 (13.31%); South_African_Gold_Mine_ Gp_1SAGMCG-1_norank含量为夏季 (10.95%) > 冬季 (6.30%) > 春季 (5.31%) > 秋季 (5.73%)。
微生物群落结构分析表明, 武夷山常绿阔叶林土壤在不同季节的核心微生物组 (Core microbiome) 基本能保持稳定, 从而有利于发挥其生态功能, 对维持生态系统平衡具有重要意义。但每个季节由于土壤理化条件的差异, 也孕育出了独特的微生物群落, 为不同季节发挥其生态功能提供了保障; 武夷山常绿阔叶林土壤中的细菌和古菌群落组成在属水平上随着季节的变化呈现出明显的动态变化; 属水平的聚类树分析结果表明, 春季和冬季的细菌和古菌群落组成最为接近, 而夏季与其他3个季节的差异最大 (图 3); 从门水平的聚类树分析可以看出, 春季和冬季的细菌和古菌群落组成最为接近, 可能与这2个季节的温度相近有关, 而夏季与其他3个季节的差异最大 (图 2)。表明温度可能是影响土壤微生物群落结构的重要环境因子。
2.4 不同季节微生物菌群相似度分析细菌和古菌群落结构相似度可以通过门水平的聚类树进行分析 (图 2), 4个季节的细菌和古菌均可以聚类为3个类群 (groups), Group Ⅰ包含春季和冬季, Group Ⅱ和Group Ⅲ分别为夏季和秋季。其中, 不同季节的细菌群落结构相似度关系与基于进化距离矩阵的主坐标分析 (Principle coordinate analysis, PCoA) 结果一致 (图 4)。在图 4中, 1个点代表 1个样品 (每个季节均有3个样品), 两个点之间的距离越近, 说明两个样品的微生物群落差异越小。可以看出, 春季和冬季的细菌群落组成聚集在同一个象限, 说明它们之间的进化距离最近。PCoA分析结果表明, PC1贡献度为66.71%, PC2贡献度为22.67%, 具有统计学意义。从细菌群落组成的聚类分析和多样品相似度分析结果来看, 4个季节中, 春季与冬季的细菌群落组成最相近, 其次是秋季, 而夏季差异最大。

|
图 4 基于16S rRNA序列的PCoA分析 Fig. 4 Principal coordinate analysis (PCoA) of bacteria and archaea based 16S rRNA sequence |
对武夷山常绿阔叶林土壤中细菌与古菌群落结构与季节变化中环境因子的关联性分别进行了RDA分析 (图 5)。结果表明, 不同的环境因子对细菌和古菌的影响不同, 而且不同季节的主要影响因子也存在差异。对于细菌来说, 影响最大的环境因子是pH, 而对于古菌, 影响最大的环境因子是有机碳含量。
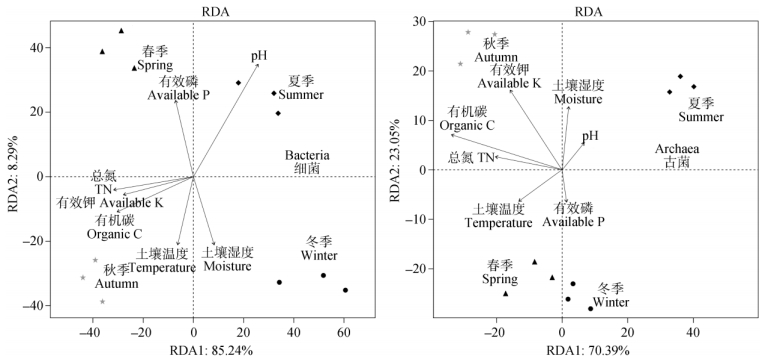
|
图 5 细菌和古菌群落结构与土壤理化性质的关联性分析 Fig. 5 Redundancy analysis of the relatedness between community structure of bacteria and archaea and soil physic-chemical properties |
应用Heatmap分析武夷山常绿阔叶林土壤中主要细菌与古菌群落与季节变化中环境因子的关联性 (图 6)。图中红色部分表示正相关, 蓝色部分表示负相关。结果表明, 细菌中与pH正相关的OTUs有6个, 且它们的亲缘关系比较近, 都属于未培养的种属; 与有效钾正相关的有Granulicella和Isosphaera; 与总氮正相关的是一类未知种属; 只有一个未知菌属与土壤湿度呈负相关。古菌中与pH正相关的OTUs有3个, 均属于不可培养的种属; 有效钾同时影响两个种群, 分别为正相关和负相关; 总氮和有机碳分别与2个和1个种群负相关。

|
图 6 热图分析主要的古菌和细菌OTUs与环境因子相关性 Fig. 6 Heatmap correlation between dominant OTUs of bacteria and archaea and soil physic-chemical properties |
土壤微生物在生态系统的能量流动和物质循环过程中具有重要的意义[20]。目前, 研究微生物多样性最广泛的方法之一是扩增并测序部分16S rRNA基因, 在16S rRNA基因的9个高变区 (V1~V9) 中, V3~V4是最准确且能识别到属水平的可变区。本文采用Illumina公司Miseq测序仪对武夷山常绿阔叶林土壤微生物多样性的季节动态进行了初步分析, 对于不同季节的土壤细菌和古菌测序深度平均分别达到35000~40000条和14000~24000条序列, 文库的覆盖率 (Coverage) 均达到99.8%以上, 说明测序几乎包含了样品中所有的细菌和古菌, 适合分析微生物的多样性。虽然本次调查采集的阔叶林土壤面积有限, 但样品采集仍具有一定代表性, 因此本研究结果在一定程度上反映了武夷山常绿阔叶林土壤菌群结构特征及其对季节动态的响应。
本研究在武夷山森林土壤中, 细菌共检测出酸杆菌门、放线菌门、绿弯菌门和蓝藻门等23门; 古菌共检测出奇古菌和广古菌2门 (图 2)。酸杆菌门是最丰富的细菌类群, 这与很多研究结果一致[21-22]。Singh等[23]报道我国云南哀牢山常绿阔叶林中酸杆菌是土壤中含量最丰富的细菌类群, 但是Zhang等[24]对湖北神农架的落叶阔叶林研究表明变形菌门是含量最丰富的类群, 这说明森林植被类型可能也是影响土壤细菌群落的重要因素[25]。刘兴等[26]报道, 在贵州喀斯特不同植被演替群落中, 变形菌门是土壤中最丰富的细菌类群; Shen等[27]报道在我国长白山高原地带变形菌门是土壤中最丰富的细菌类群。在本研究中, 武夷山常绿阔叶林在春秋冬季变形菌门含量次于酸杆菌门居第二位, 唯有夏季变形菌门含量高于酸杆菌门。杨官品等[28]认为, 土壤细菌具有非常丰富的多样性, 不同类型的土壤中存在各自的优势细菌类群, 又有相似的细菌类群; 同时季节变化对武夷山常绿落叶林土壤细菌具有影响。庄铁诚等[8]的研究结果表明不同森林类型土壤优势菌属有所差异, 主要为芽孢杆菌属 (Bacillus)、微球菌属 (Micrococcus)、黄单胞菌属 (Xanthomonas)、假单胞菌属 (Pseudomonas) 和产碱杆菌属 (Alcaligenes) 等, 和本研究结果不一致, 这可能是由于采样区域植物群落或土壤间的异质及分析方法的不同所造成的。任健等[29]报道海南东寨港红树林土壤的古菌菌落主要为泉古菌界 (Crenarchaeota) 和广古菌, 与袁红朝等[30]对稻田土壤的研究一致, Kemnit等[31]在酸性温带土壤中也检测到高丰度的泉古菌, 而本研究中最丰富的古菌类群是奇古菌, 说明武夷山常绿阔叶林有其独特的古菌菌群结构; 据报道洋山深水港海域表层海水中也含有奇古菌和广古菌[32], 这两者是否有某种联系还有待进一步研究。
不同季节土壤温度、湿度、通气、酸碱度、有机和无机养分等因素的改变都会影响微生物菌落结构[33], 但对微生物菌群结构的影响因素, 不同研究的结论有所不同[34-35]。Rasche等[36]提出湿度和温度是影响温带森林土壤微生物的主要环境因子, 但Baldrian等[37]的研究表明, 季节性的湿度变化并不会影响土壤中的微生物量和多种细胞外酶的活性。何容等[9]对亚热带武夷山土壤微生物量的季节变化规律及其主要影响因子的研究表明, 其与土壤温度、土壤有机碳、土壤全氮、凋落物输入量等因子的相关性并不显著, 土壤有效碳含量、土壤湿度是调控武夷山森林土壤微生物量季节变异的重要生态因子。这与本文结果不一致, 可能是由于所采用的方法和时间地理位置等不同所致。Nacke等[38]的研究表明, 德国土壤细菌群落的结构在很大程度上受树种和土壤pH影响; 在不同的空间尺度上, pH对土壤细菌的多样性和群落组成均有很大影响[39], 这与本研究结果相辅相成。袁红朝等[30]报道稻田土壤中古菌多样性与有效碳和总氮含量呈显著正相关, 与本研究结果基本一致, 古菌对营养物质和环境因素高度响应的原因可能是由于他们代谢的多样性和对环境变化的高度适应能力[36]。
综上所述, 武夷山常绿阔叶林土壤含有丰富的细菌和古菌资源, 且未知菌属占有相当大的比例; 细菌和古菌菌落结构随季节变化发生显著变化, 细菌多样性主要受到土壤pH的影响, 古菌多样性主要受到碳源的影响。武夷山常绿阔叶林土壤pH偏低 ( < 4.0), 在一定程度上影响了微生物的丰度。本研究为进一步认识武夷山常绿阔叶林土壤微生物多样性提供了理论依据, 土壤微生物群落多样性对季节的变化规律也为武夷山国家自然保护区的经营与管理提供了科学依据。
| [1] |
Ye X F, Zhang Y J, Lu X M, et al. Research advance on relationship between the soil microbes and soil nutrition[J].
Chin J Soil Sci, 2009, 40(6): 237-241. 叶协锋, 张友杰, 鲁喜梅, 等. 土壤微生物与土壤营养关系研究进展[J]. 土壤通报, 2009, 40(6): 237-241. |
| [2] |
LIN X G, HU J L. Scientific connotation and ecological service function of soil microbial diversity[J].
Acta Pedol Sin, 2008, 45(5): 892-900. 林先贵, 胡君利. 土壤微生物多样性的科学内涵及其生态服务功能[J]. 土壤学报, 2008, 45(5): 892-900. DOI:10.3321/j.issn:0564-3929.2008.05.016 |
| [3] | WITT C, SETÄLÄ H. Do plant species of different resource qualities form dissimilar energy channels below-ground[J]. Appl Soil Ecol, 2010, 44(3): 270-278. DOI:10.1016/j.apsoil.2010.01.004 |
| [4] |
LIU S R, WANG H, LUAN J W. A review of research progress and future prospective of forest soil carbon stock and soil carbon process in China[J].
Acta Ecol Sin, 2011, 31(19): 5437-5448. 刘世荣, 王晖, 栾军伟. 中国森林土壤碳储量与土壤碳过程研究进展[J]. 生态学报, 2011, 31(19): 5437-5448. |
| [5] |
JIN Y H, WANG J S, LI L G, et al. Soil enzyme activities in typical vegetation zones along an altitude gradient in Wuyi Mountains[J].
Chin J Ecol, 2011, 30(9): 1955-1961. 金裕华, 汪家社, 李黎光, 等. 武夷山不同海拔典型植被带土壤酶活性特征[J]. 生态学杂志, 2011, 30(9): 1955-1961. |
| [6] |
DING H, FANG Y M, YANG Q, et al. Community characteristics of a mid-subtropical evergreen broad-leaved forest plot in the Wuyi Mountains, Fujian Province, Southeastern China[J].
Biodiv Sci, 2015, 23(4): 479-492. 丁晖, 方炎明, 杨青, 等. 武夷山中亚热带常绿阔叶林样地的群落特征[J]. 生物多样性, 2015, 23(4): 479-492. DOI:10.17520/biods.2015021 |
| [7] |
DING H, YANG Y F, XU H G, et al. Species composition and community structure of the typical evergreen broad-leaved forest in the Wuyi Mountains of southeastern China[J].
Acta Ecol Sin, 2015, 35(4): 1142-1154. 丁晖, 杨云方, 徐海根, 等. 武夷山典型常绿阔叶林动态监测样地:物种组成与群落结构[J]. 生态学报, 2015, 35(4): 1142-1154. DOI:10.5846/stxb201305050924 |
| [8] |
ZHUANG T C, LIN P, CHEN R H. A preliminary investigation on dominant genera of heterotrophic bacteria and filamentous fungi in soils under different types of forest on Wuyi Mountain, Fujian[J].
Acta Pedol Sin, 1998, 35(1): 119-123. 庄铁诚, 林鹏, 陈仁华. 武夷山不同类型森林土壤细菌、丝状真菌优势菌属的初步研究[J]. 土壤学报, 1998, 35(1): 119-123. DOI:10.11766/trxb199701060117 |
| [9] |
HE R, WANG G B, WANG J S, et al. Seasonal variation and its main affecting factors of soil microbial biomass under different vegetations along an elevation gradient in Wuyi Mountains of China[J].
Chin J Ecol, 2009, 28(3): 394-399. 何容, 王国兵, 汪家社, 等. 武夷山不同海拔植被土壤微生物量的季节动态及主要影响因子[J]. 生态学杂志, 2009, 28(3): 394-399. |
| [10] |
WU Z Y, LIN W X, CHEN Z F, et al. Phospholipid fatty acid analysis of soil microbes at different elevation of Wuyi Mountains[J].
Sci Silv Sin, 2014, 50(7): 105-112. 吴则焰, 林文雄, 陈志芳, 等. 武夷山不同海拔植被带土壤微生物PLFA分析[J]. 林业科学, 2014, 50(7): 105-112. DOI:10.11707/j.1001-7488.20140715 |
| [11] | SMALLA K, OROS-SICHLER M, MILLING A, et al. Bacterial diversity of soils assessed by DGGE, T-RFLP and SSCP fingerprints of PCR-amplified 16S rRNA gene fragments: Do the different methods provide similar results[J]. J Microbiol Methods, 2007, 69(3): 470-479. DOI:10.1016/j.mimet.2007.02.014 |
| [12] | HIRSCH P R, MAUCHLINE T H, CLARK I M. Culture-independent molecular techniques for soil microbial ecology[J]. Soil Biol Biochem, 2010, 42(6): 878-887. DOI:10.1016/j.soilbio.2010.02.019 |
| [13] | DRENOVSKY R E, ELLIOTT G N, GRAHAM K J, et al. Comparison of phospholipid fatty acid (PLFA) and total soil fatty acid methyl esters (TSFAME) for characterizing soil microbial communities[J]. Soil Biol Biochem, 2004, 36(11): 1793-1800. DOI:10.1016/j.soilbio.2004.05.002 |
| [14] | LEE O O, WANG Y, YANG J K, et al. Pyrosequencing reveals highly diverse and species-specific microbial communities in sponges from the Red Sea[J]. ISME J, 2011, 5(4): 650-664. DOI:10.1038/ismej.2010.165 |
| [15] | GOŁĘBIEWSKI M, DEJA-SIKORA E, CICHOSZ M, et al. 16S rDNA pyrosequencing analysis of bacterial community in heavy metals polluted soils[J]. Microb Ecol, 2014, 67(3): 635-647. DOI:10.1007/s00248-013-0344-7 |
| [16] |
BAO S D.
Soil Agricultural Chemistry analysis[M]. Beijing: China Agriculture Press, 2000: 40.
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000: 40. |
| [17] |
CAI Y, HAO M D, ZHANG L Q, et al. Effect of cropping systems on microbial diversity in black loessial soil tested by 454 sequencing technology[J].
Acta Agron Sin, 2015, 41(2): 339-346. 蔡艳, 郝明德, 张丽琼, 等. 应用454测序技术分析种植制度对黑垆土微生物多样性的影响[J]. 作物学报, 2015, 41(2): 339-346. DOI:10.3724/SP.J.1006.2015.00339 |
| [18] |
CAO R, ZHANG J C, SI D Y, et al. Seasonal dynamics of soil microbial biomass under different forest types in Fengyang Mountain of Zhejiang[J].
China For Sci Techn, 2014, 28(6): 41-45. 曹容, 张金池, 司登宇, 等. 浙江凤阳山不同林地类型土壤微生物季节动态[J]. 林业科技开发, 2014, 28(6): 41-45. DOI:10.13360/j.issn.1000-8101.2014.06.010 |
| [19] | KULICHEVSKAYA I S, SUZINA N E, LIESACK W, et al. Bryobacter aggregatus gen. nov., sp. nov., a peat-inhabiting, aerobic chemo-organotroph from subdivision 3 of the Acidobacteria[J]. Inter J Syst Evol Microbiol, 2010, 60(2): 301-306. DOI:10.1099/ijs.0.013250-0 |
| [20] | ŠTURSOVÁ M, ŽIFČÁKOVÁ L, LEIGH M B, et al. Cellulose utilization in forest litter and soil: Identification of bacterial and fungal decomposers[J]. FEMS Microbiol Ecol, 2012, 80(3): 735-746. DOI:10.1111/j.1574-6941.2012.01343.x |
| [21] | BALDRIAN P, KOLAŘÍK M, ŠTURSOVÁ M, et al. Active and total microbial communities in forest soil are largely different and highly stratified during decomposition[J]. ISME J, 2012, 6(2): 248-258. DOI:10.1038/ismej.2011.95 |
| [22] | JONES R T, ROBESON M S, LAUBER C L, et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. ISME J, 2009, 3(4): 442-453. DOI:10.1038/ismej.2008.127 |
| [23] | SINGH D, SHI J L, ADAMS J M. Bacterial diversity in the mountains of south-west China: climate dominates over soil parameters[J]. J Microbiol, 2013, 51(4): 439-471. DOI:10.1007/s12275-013-2446-9 |
| [24] | ZHANG Y G, CONG J, LU H, et al. An integrated study to analyze soil microbial community structure and metabolic potential in two forest types[J]. PLoS One, 2014, 9(4): e93773 DOI:10.1371/journal.pone.0093773 |
| [25] |
BI J T, HE D H. Research advances in effects of plant on soil microbial diversity[J].
Chin Agri Sci Bull, 2009, 25(9): 244-250. 毕江涛, 贺达汉. 植物对土壤微生物多样性的影响研究进展[J]. 中国农学通报, 2009, 25(9): 244-250. |
| [26] |
LIU X, WANG S J, LIU X M, et al. Compositional characteristics and variations of soil microbial community in Karst Area of Puding County, Guizhou Province, China[J].
Earth Environ, 2015, 43(5): 490-497. 刘兴, 王世杰, 刘秀明, 等. 贵州喀斯特地区土壤细菌群落结构特征及变化[J]. 地球与环境, 2015, 43(5): 490-497. DOI:10.14050/j.cnki.1672-9250.2015.05.002 |
| [27] | SHEN C C, XIONG J B, ZHANG H Y, et al. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain[J]. Soil Biol Biochem, 2013, 57: 204-211. DOI:10.1016/j.soilbio.2012.07.013 |
| [28] |
YANG G P, NAN L, JIA H B, et al. Bacterial genetic adversity in soils and their correlation with vegetation[J].
Acta Genet Sin, 2000, 27(3): 278-282. 杨官品, 男兰, 贾海波, 等. 土壤细菌遗传多样性及其与植被类型相关性研究[J]. 遗传学报, 2000, 27(3): 278-282. |
| [29] |
REN J, YAN B, HONG K. Comparison of bacterial and archaeal community of mangrove soil under different vegetation in Dong-zhaigang, Hainan Island[J].
Acta Microbiol Sin, 2012, 52(6): 736-743. 任健, 阎冰, 洪葵. 海南东寨港红树林不同植被土壤微生物群落结构比较[J]. 微生物学报, 2012, 52(6): 736-743. |
| [30] |
YUAN H Z, WU H, GE T D, et al. Effects of long-term fertilization on bacterial and archaeal diversity and community structure within sub-tropical red paddy soils[J].
Chin J Appl Ecol, 2015, 26(6): 1807-1813. 袁红朝, 吴昊, 葛体达, 等. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报, 2015, 26(6): 1807-1813. |
| [31] | KEMNITZ D, KOLB S, CONRAD R. High abundance of Crenar-chaeota in a temperate acidic forest soil[J]. FEMS Microbiol Ecol, 2007, 60(3): 442-448. DOI:10.1111/j.1574-6941.2007.00310.x |
| [32] |
SUN G W, XIAO J Z, CHEN X B, et al. Archabacterial diversity features in surface seawater of Yangshan Deep-water Port[J].
J Microbiol, 2014, 34(5): 13-20. 孙国伟, 肖劲洲, 陈小兵, 等. 洋山深水港海域表层海水中古菌多样性特点[J]. 微生物学杂志, 2014, 34(5): 13-20. DOI:10.3969/j.issn.1005-7021.2014.05.003 |
| [33] | THOMS C, GLEIXNER G. Seasonal differences in tree species' influence on soil microbial communities[J]. Soil Biol Biochem, 2013, 66: 239-248. DOI:10.1016/j.soilbio.2013.05.018 |
| [34] | LIPSON D A. Relationships between temperature responses and bacterial community structure along seasonal and altitudinal gradients[J]. FEMS Microbiol Ecol, 2007, 59(2): 418-427. DOI:10.1111/j.1574-6941.2006.00240.x |
| [35] | WILLIAMS M A, JANGID K, SHANMUGAM S G, et al. Bacterial communities in soil mimic patterns of vegetative succession and ecosystem climax but are resilient to change between seasons[J]. Soil Biol Biochem, 2013, 57: 749-757. DOI:10.1016/j.soilbio.2012.08.023 |
| [36] | RASCHE F, KNAPP D, KAISER C, et al. Seasonality and resource availability control bacterial and archaeal communities in soils of a temperate beech forest[J]. ISME J, 2011, 5(3): 389-402. DOI:10.1038/ismej.2010.138 |
| [37] | BALDRIAN P, ŠNAJDR J, MERHAUTOVÁ V, et al. Responses of the extracellular enzyme activities in hardwood forest to soil temperature and seasonality and the potential effects of climate change[J]. Soil Biol Biochem, 2013, 56: 60-68. DOI:10.1016/j.soilbio.2012.01.020 |
| [38] | NACKE H, THÜRMER A, WOLLHERR A, et al. Pyrosequencing-based assessment of bacterial community structure along different management types in German forest and grassland soils[J]. PLoS One, 2011, 6(2): e17000 DOI:10.1371/journal.pone.0017000 |
| [39] | ROUSK J, BÅÅTH E, BROOKES P C, et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. ISME J, 2010, 4(10): 1340-1351. DOI:10.1038/ismej.2010.58 |
 2017, Vol. 25
2017, Vol. 25


