纤维素酶是一种多组分的复合酶系[1], 目前确定含有3种主要组分:内切葡聚糖酶 (Endoglu-canase, EG, EC 3.2.1.4)、外切葡聚糖酶 (Exoglucanase, EXG, EC 3.2.1.91) 和β-葡萄糖苷酶 (β-Glucosidase, BG, EC 3.2.1.21)。内切葡聚糖酶能随机切割纤维素链生成各种糖或者寡糖, 并产生额外的外切作用位点, 而外切葡聚糖酶作用于纤维素链生成可溶的纤维糊精和纤维二糖; β-葡萄糖苷酶能水解纤维二糖和寡糖生成葡萄糖[2-3]。纤维素酶能够促进细胞间物质和水分的运转, 调控植物的伸长、成熟与脱落, 如降解细胞壁物质软化果实等, 在植物的生长发育中发挥着重要作用[4-5]。
茶树 (Camellia sinensis) 是我国重要的经济作物, 主要生长在气候湿热的热带、亚热带地区。茶树新梢是茶树重要的组织部位, 无论是在生长发育过程中, 还是在茶叶加工过程中都具有重要作用。有研究表明纤维素酶在茶叶加工过程中能够提高茶叶内含物的含量[6], 促使可溶性糖类较多的积累, 为茶叶奠定物质基础。另外β-葡萄糖苷酶与芳樟醇、香叶醇等茶叶香气的生成密切相关, 且参与了茶树对病虫害的防御反应[7-8]。目前关于茶树纤维素酶的研究大多集中在β-葡萄糖苷酶, 而关于茶树鲜叶中内切葡聚糖酶和外切葡聚糖酶的研究鲜有报道。因此, 本研究分析内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶在茶树新梢中的活性变化, 另对GenBank中登录的茶树纤维素酶相关基因进行搜索和半定量RT-PCR分析, 为研究纤维素酶在茶叶品质形成和茶树生长发育过程中的作用提供理论参考。
1 材料和方法 1.1 材料以茶树[Camellia sinensis (L.) O. Kuntze]品种‘凫早2号’(‘Fuzao No. 2’, FZ)、‘平阳特早’ (‘Ping-yang Tezao’, PT)、‘舒茶早’(‘Shuchazao’, SC) 为供试材料。样品于2016年4月采自安徽省黄山市试验茶园中的5年生茶树植株。
1.2 叶片粗酶液的提取准确称取茶树新鲜叶片2 g, 加入20 mL的100 mmol L-1柠檬酸三钠-柠檬酸缓冲液 (pH 5.0)、等量不溶性聚乙烯吡咯烷酮 (Polyvingypyrrolidone, PVPP) 和0.5 g石英砂置于冰上研磨至糊状。匀浆液以8000×g于4℃下离心5 min, 取上清液再于4℃下以10000×g离心10 min, 上清液即为粗酶液[9]。
1.3 纤维素酶活性测定内切葡聚糖酶活性测定采用DNS法[10], 反应体系为: 200 μL酶液、200 μL 5 g L-1羧甲基纤维素钠和600 μL 100 mmol L-1柠檬酸三钠-柠檬酸缓冲液 (pH 5.0), 49℃反应2 h后, 加入3 mL DNS试剂, 煮沸10 min, 用酶标仪Multiskan GO于540 nm下测吸光值, 以反应前加3 mL DNS试剂终止反应为对照。外切葡聚糖酶和β-葡萄糖苷酶活性测定时, 底物分别为10 mmol L-1PNPC和10 mmol L-1 p-NPG, 反应体系和条件与内切葡聚糖酶相同, 反应结束后, 加入2.5 mL的1 mol L-1Na2CO3终止反应, 用酶标仪Multiskan GO于405 nm下测定吸光值, 以反应前加2.5 mL Na2CO3终止反应为对照[11]。
内切葡聚糖酶活性根据还原糖标准曲线计算, 以1 mL粗酶液10 min催化生成1 μmol葡萄糖为1个酶活单位[U (10 min)-1mL-1]。外切葡聚糖酶和β-葡萄糖苷酶活性用对硝基苯酚标准曲线计算, 以1 mL粗酶液10 min催化生成1 μmol对硝基苯酚为1个酶活单位[U (10 min)-1mL-1]。
1.4 纤维素酶相关基因的半定量RT-PCR分析利用Primer Premier 6软件设计半定量引物 (表 1), 总RNA提取试剂为RNAiso for Polysaccharide-rich Plant Tissue, 反转录试剂盒为PrimeScriptTM 1st Strand cDNA Synthesis Kit, PCR使用高保真Ex-Taq DNA聚合酶, 目的条带大小用DL500 DNA Marker衡量, 以上试剂均购自TaKaRa公司。以甘油醛-3-磷酸脱氢酶 (Glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 基因为内参基因进行RT-PCR扩增。PCR反应程序为: 94℃变性3 min; 94℃ 30 s, 60℃ 30 s, 72℃ 1 min, 30个循环; 72℃延伸5 min。PCR扩增在Apollo ATC201/401 PCR仪上进行, 扩增产物采用2%琼脂糖凝胶电泳检测。用定量软件Image J计算所检测基因的相对表达量。
| 表 1 茶树纤维素酶相关基因RT-PCR引物序列 Table 1 Primer sequence of cellulase-related gene in Camellia sinensis |
采用Excel 2007进行数据整理, DPS处理系统对数据进行单因素方差分析。所有数据均为3次重复的平均值。
2 结果和分析 2.1 新梢的纤维素酶活性从图 1可见, ‘平阳特早’和‘凫早2号’的新梢嫩度低于‘舒茶早’, 前两者新梢展开度更高。从图 2可见, 内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶活性在3个茶树品种不同嫩度新梢中差异显著。内切葡聚糖酶和外切葡聚糖酶在‘平阳特早’和‘凫早2号’的一芽三叶中活性最高, 而在‘舒茶早’的一芽一叶中活性最高。β-葡萄糖苷酶活性在3个茶树品种都是一芽三叶中最低。3个茶树品种新梢中的β-葡萄糖苷酶活性比外切葡聚糖酶活性高, 如‘凫早2号’一芽一叶、一芽二叶、一芽三叶中的β-葡萄糖苷酶活性分别为0.058、0.030、0.031 U (10 min)-1mL-1, 而外切葡聚糖酶活性则只有0.013、0.012、0.016 U (10 min)-1mL-1。

|
图 1 不同茶树品种新梢。A: ‘平阳特早’; B: ‘舒茶早’; C: ‘凫早2号’。 Fig. 1 Shoots of different tea cultivars. A: 'Pingyang Tezao'; B: 'Shuchazao'; C: 'Fuzao No. 2'. |

|
图 2 茶树新梢中纤维素酶活性。OLB:一芽一叶; TLB:一芽二叶; TLAB:一芽三叶; PT: ‘平阳特早’; SC: ‘舒茶早’; FZ: ‘凫早2号’。柱上不同字母表示差异显著 (P < 0.05)。下图同。 Fig. 2 Cellulase activities in shoots of three tea cultivars. OLB: One leaf with a bud; TLB: Two leaves with a bud; TLAB: Three leaves with a bud; PT: 'Pingyang Tezao'; SC: 'Shuchazao'; FZ: 'Fuzao No. 2'. Different letters above column indicate significant difference at 0.05 level. The same is following Figures. |
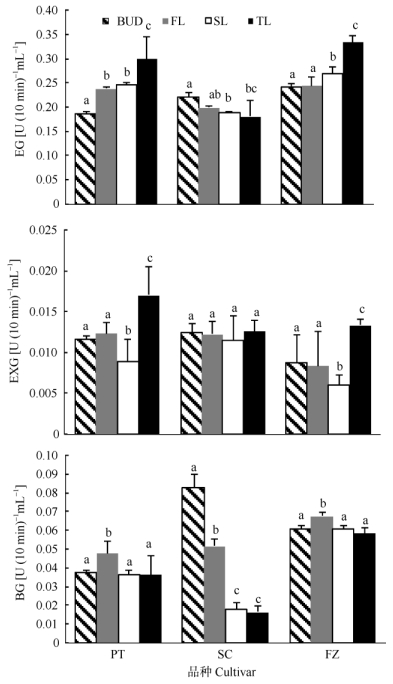
将茶树一芽三叶不同部位分别进行纤维素酶活性测定。结果表明, ‘平阳特早’与‘凫早2号’的内切葡聚糖酶活性随叶片成熟度的增加而升高, 表现为芽 < 第一叶 < 第二叶 < 第三叶, 与‘舒茶早’呈现相反趋势 (图 3)。3个茶树品种外切葡聚糖酶活性都是以第二叶最低, 第三叶最高。在‘舒茶早’中β-葡萄糖苷酶活性随叶片嫩度降低而降低, 表现为芽 > 第一叶 > 第二叶 > 第三叶, 而‘平阳特早’和‘凫早2号’都是以第一叶的酶活性最高。
|
图 3 茶树一芽三叶不同部位纤维素酶活性。BUD:芽; FL:第一叶; SL:第二叶; TL:第三叶。 Fig. 3 Cellulase activities in different parts of three leaves with a bud. BUD: Bud; FL: 1st leaf; SL: 2nd leaf; TL: 3rd leaf. |
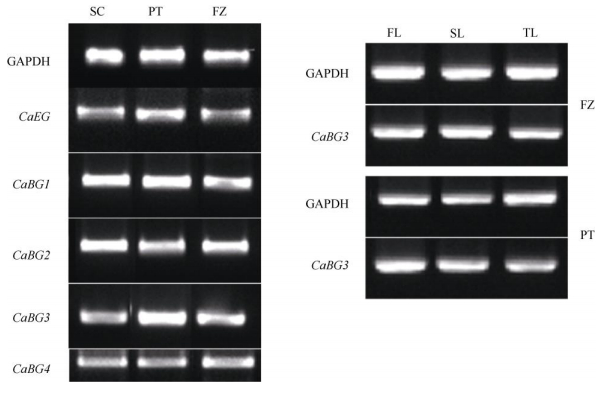
为了解茶树纤维素酶在mRNA水平的表达情况, 通过Primer Premier 6设计半定量引物, 对GenBank中搜索到的5个茶树纤维素酶相关基因进行半定量RT-PCR分析, 包括4个β-葡萄糖苷酶基因和1个内切葡聚糖酶基因, 未找到茶树外切葡聚糖酶基因序列。5个茶树纤维素酶相关基因分别命名为CaBG1 (登录号: AM285295.2)、CaBG2 (登录号: KF933435.1)、CaBG3 (登录号: AF537127.1)、CaBG4 (登录号: HQ679938.2) 和CaEG (登录号: KF750634.1)。RT-PCR结果表明, 5个茶树纤维素酶相关基因在3个茶树品种中均有表达 (图 4)。以‘舒茶早’的基因表达量为相对值1, 用定量软件Image J计算, 这5个基因在‘平阳特早’和‘凫早2号’中的表达量分别为1.30和1.04 (CaEG)、1.14和1.01 (CaBG1)、0.97和1.02 (CaBG2)、1.54和1.28 (CaBG3)、1.30和1.89 (CaBG4), 这与图 4的结果一致。同源基因CaBG3与CaBG4在3个茶树品种新梢中的表达量与其他3个基因存在显著差异。对同源基因CaBG3在新梢不同部位中的表达量进行RT-PCR分析, 结果表明, 以第一叶的表达量为1, ‘平阳特早’第二叶和第三叶表达量分别为0.93和0.77, ‘凫早2号’是1.05和0.86。
|
图 4 茶树纤维素酶相关基因表达的RT-PCR分析。FL:第一叶; SL:第二叶; TL:第三叶。 Fig. 4 Expression of cellulase-related genes in Camellia sinensis by RT-PCR. FL: 1st leaf; SL: 2nd leaf; TL: 3rd leaf. |
β-葡萄糖苷酶活性在‘平阳特早’和‘凫早2号’中均表现为第一叶 > 第二叶 > 第三叶, 半定量RT-PCR结果表明,‘平阳特早’β-葡萄糖苷酶同源基因CaBG3表达量呈现相同趋势, 这说明β-葡萄糖苷酶基因CaBG3表达量与酶活性变化趋势相同。
3 讨论 3.1 纤维素酶活性差异与茶叶品质高等植物细胞壁是由纤维素、半纤维素、果胶物质等大分子组成, 纤维素是细胞壁的骨架[12]。纤维素酶作为细胞壁代谢水解酶参与植物的生长发育过程。在果实软化过程中, 随着果实成熟度增加, 纤维素酶活性上升, 纤维素、半纤维素等细胞壁物质发生降解, 产生糖类等物质[13-14]。在茶叶加工过糖苷酶, 茶树鲜叶中的糖苷类香气前体可以水解生成相应的醇类香气, 增加茶叶香气, 提升茶叶品质。对茶树品种‘龙井43’和‘毛蟹’的研究表明, β-葡萄糖苷酶活性在幼嫩部位高, 表现为芽 > 第一叶 > 第二叶 > 第三叶, 且不同品种间的β-葡萄糖苷酶活性差异大[15]。本试验中, 茶树品种‘舒茶早’与前者研究结果一致。内切葡聚糖酶和外切葡聚糖酶在‘平阳特早’和‘凫早2号’中都是随着叶片成熟度增加而增加, 以第三叶的酶活性最高, 而β-葡萄糖苷酶活性则是以第一叶的活性最高。目前在名优茶加工中, 有追求鲜叶原料越来越小、越来越嫩的现象, 而根据本研究结果, 名优茶加工并非原料越嫩越好, 也许适当选取有一定成熟度的新梢制茶, 品质会更醇厚。
3.2 纤维素酶活性与基因表达差异分析每种酶都是基因表达的最终产物, 而且多数并不是单一基因表达的结果, 而是基因家族表达的结果。内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶都有基因家族。在拟南芥 (Arabidopsis thaliana) 中, 有25个内切葡聚糖酶同工酶基因以及47个β-葡萄糖苷酶同工酶基因[16]。通过Gen-Bank仅搜索到5个茶树纤维素酶相关基因序列, 其中葡萄糖苷酶4个, 内切葡聚糖酶1个。与其他物种相比, 茶树中被鉴定出的纤维素酶相关基因太少, 还有待深入研究。在茶树品种‘龙井43’中, β-葡萄糖苷酶基因的表达以第三叶 > 第二叶 > 一芽一叶, 酶活性则为一芽一叶 > 第二叶 > 第三叶, 基因表达量与酶活性呈现相反趋势[17]。本研究中β-葡萄糖苷酶基因AF537127在‘平阳特早’中的表达量与酶活性变化趋势相同, 即基因表达量高, 酶活性高, 而‘凫早2号’中基因表达量和酶活性变化趋势之间并没有明显的相关性, 这可能是只对单一基因的表达量进行分析, 并没有涉及同工酶基因的定量分析所导致的。另外, 从基因表达到酶活性涉及到一系列过程, 如基因的翻译、蛋白质的修饰等, 这些因素都有可能造成基因表达量与酶活性之间的差异。
综上所述, 茶树新梢中纤维素酶活性不仅在品种间存在差异, 在品种内不同部位也存在差异, 这种差异与纤维素酶相关基因表达差异之间并没有明显的相关性。根据新梢不同部位中纤维素酶活性差异可以为制茶过程中鲜叶的选取提供参考。另外, 纤维素酶活性与基因表达差异也涉及到茶树的生长发育状态, 以后可以通过同工酶基因的克隆以及定量分析不同时期、不同生态条件下纤维素酶基因表达量来确定两者之间的关系。
| [1] | LIBERTINI E, LI Y, MCQUEEN-MASON S J. Phylogenetic analysis of the plant endo-β-1, 4-glucanase gene family[J]. J Mol Evol, 2004, 58(5): 506-515. DOI:10.1007/s00239-003-2571-x |
| [2] | WOODWARD J. Synergism in cellulase systems[J]. Bioresour Techn, 1991, 36(1): 67-75. DOI:10.1016/0960-8524(91)90100-X |
| [3] | TOMME P, WARREN R A J, GILKES N R. Cellulose hydrolysis by bacteria and fungi[J]. Adv Microb Physiol, 1995, 37: 1-81. DOI:10.1016/S0065-2911(08)60143-5 |
| [4] |
GONG Y L, WEI C, WANG Z B, et al. Research progress of cellulase and pectinase in the extraction of tea leaves[J].
J Tea Sci, 2013, 33(4): 311-321. 龚玉雷, 魏春, 王芝彪, 等. 生物酶在茶叶提取加工技术中的应用研究[J]. 茶叶科学, 2013, 33(4): 311-321. DOI:10.3969/j.issn.1000-369X.2013.04.005 |
| [5] |
PENG L T, RAO J P, YANG S Z, et al. Changes in cell wall components and related hydrolytic enzymes in fruit softening[J].
J Trop Subtrop Bot, 2002, 10(3): 271-280. 彭丽桃, 饶景萍, 杨书珍, 等. 果实软化的胞壁物质和水解酶变化[J]. 热带亚热带植物学报, 2002, 10(3): 271-280. DOI:10.3969/j.issn.1005-3395.2002.03.014 |
| [6] |
TANG H, YANG W L, WEN H T. Dynamic changes in cellulase activity and related biochemical components during oolong tea processing[J].
Tea Commun, 2003(2): 19-21. 唐颢, 杨伟丽, 文海涛. 乌龙茶加工中纤维素酶的活性与相关生化成分的动态变化[J]. 茶叶通讯, 2003(2): 19-21. |
| [7] | TAKEO T. Variation in amounts of linalol and geraniol produced in tea shoots by mechanical injury[J]. Phytochemistry, 1981, 20(9): 2149-2151. DOI:10.1016/0031-9422(81)80104-5 |
| [8] | YANG Z Y, BALDERMANN S, WATANABE N. Recent studies of the volatile compounds in tea[J]. Food Res Int, 2013, 53(2): 585-599. DOI:10.1016/j.foodres.2013.02.011 |
| [9] |
JIANG C J, LI Y Y, WAN X C, et al. The daily change of β-glucosidase activity in bud-leaf of tea[J].
J Plant Physiol, 2000, 36(4): 324-326. 江昌俊, 李叶云, 宛晓春, 等. 茶芽叶中β-葡萄糖苷酶活性的日变化[J]. 植物生理通讯, 2000, 36(4): 324-326. |
| [10] | ANDREWS P K, LI S L. Cell wall hydrolytic enzyme activity during development of nonclimacteric sweet cherry (Prunus avium L.) fruit[J]. J Hort Sci Biotechn, 1995, 70(4): 561-567. DOI:10.1080/14620316.1995.11515327 |
| [11] |
JIANG C J, LI Y Y. The research about determination condition of β-d-glucosidase in tea[J].
J Anhui Agri Univ, 1999, 26(2): 212-215. 江昌俊, 李叶云. 茶叶中β-d-葡萄糖苷酶活性测定条件的研究[J]. 安徽农业大学学报, 1999, 26(2): 212-215. |
| [12] | HENDRIKS A T W M, ZEEMAN G. Pretreatments to enhance the digestibility of lignocellulosic biomass[J]. Bioresour Techn, 2009, 100(1): 10-18. DOI:10.1016/j.biortech.2008.05.027 |
| [13] |
SHE W Q, ZHAO X L, PAN D M, et al. Relationship between cell wall metabolism and fruit juicy sac granulation during fruit mature stage of Pummelo [Citrus grandis(L.) Osbeck 'Guanxi-miyou'][J].
J Trop Subtrop Bot, 2008, 16(6): 545-550. 佘文琴, 赵晓玲, 潘东明, 等. 细胞壁代谢与琯溪蜜柚果实成熟过程汁胞粒化的关系[J]. 热带亚热带植物学报, 2008, 16(6): 545-550. |
| [14] |
CHEN Y H, ZHANG H, LIN H T, et al. Effect of 1-methylcyclo-propene (1-MCP) on softening and cell wall metabolism of harvested Averrhoa carambola fruits[J].
J Trop Subtrop Bot, 2013, 21(6): 566-571. 陈艺晖, 张华, 林河通, 等. 1-甲基环丙烯处理对采后杨桃果实软化和细胞壁代谢的影响[J]. 热带亚热带植物学报, 2013, 21(6): 566-571. DOI:10.3969/j.issn.1005-3395.2013.06.011 |
| [15] |
LUO Y P, DONG S S, TONG Q Q, et al. Variation of β-glucosidase activity during the development of the shoots of seven tea cultivars[J].
J Tea Sci, 1997, 17(S1): 25-28. 骆耀平, 董尚胜, 童启庆, 等. 7个茶树品种新梢生育过程中β-葡萄糖苷酶活性变化[J]. 茶叶科学, 1997, 17(S1): 25-28. |
| [16] | XU Z W, ESCAMILLA-TREVIÑO L, ZENG L H, et al. Functional genomic analysis of Arabidopsis thaliana glycoside hydrolase family 1[J]. Plant Mol Biol, 2004, 55(3): 343-367. DOI:10.1007/s11103-004-0790-1 |
| [17] |
CHEN L, ZHAO L P, MA C L, et al. Differential expression analysis of β-glucosidase and β-primeverosidase genes in tea plant (Camellia sinensis)[J].
Acta Hort Sin, 2009, 36(1): 87-92. 陈亮, 赵丽萍, 马春雷, 等. 茶树β-葡萄糖苷酶和β-樱草糖苷酶基因表达差异分析[J]. 园艺学报, 2009, 36(1): 87-92. DOI:10.3321/j.issn:0513-353X.2009.01.014 |
 2017, Vol. 25
2017, Vol. 25


