2. 中国科学院大学, 北京 100049;
3. 新疆大学生命科学与技术学院, 乌鲁木齐 830046
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Life Science and Technology, Xinjiang University, Urumqi 830046, China
火绒草[Lentopodium lenotopodioides (Willd.) Beauv.]为菊科 (Asteraceae) 火绒草属植物,多年生草本,株高5~45 cm,生长于我国新疆、甘肃、青海、陕西、内蒙、河北、山东、山西等省区海拔100~3200 m的干旱草原、黄土坡地、石砾地、山区草地[1]。火绒草地上部入药,在《卫生部药品标准·蒙药分册》和《内蒙古药材标准》均有收载,蒙古名为查干-阿荣,有清肺、止咳、燥肺脓等功效[2]。火绒草有抗炎、抗菌、抗氧化、降血糖、利尿等药理作用, 已报道的化学成分主要为黄酮 (苷) 类,还有苯丙素类、甾醇类、生物碱类等[2-4]。
前期研究结果表明,新疆天山产火绒草含水乙醇提取物可显著降低腹腔注射链脲佐菌素致高血糖小鼠的空腹血糖值[5]。为此,我们对该提取物的化学成分进行了研究,从中分离鉴定了8个苯丙素类化合物,其中6个为首次从该植物中报道,并测定了这些化合物对α-葡萄糖苷酶的抑制活性。
1 材料和方法 1.1 材料试验用全草于2013年6月下旬在乌鲁木齐市南山小渠子 (海拔1800 m) 采集,经新疆大学生命科学与技术学院植物学教研室索菲娅副教授和逯永满实验师鉴定为火绒草[Lentopodium lenotopodioides (Willd.) Beauv.]。清洗泥土,阴干,粉碎。
青岛谱科分离材料公司柱层析硅胶 (100~200目);烟台江友硅胶开发公司薄层层析HSGF254硅胶板;瑞典GE Healthcare Bio-Sciences AB公司葡聚糖凝胶LH-20;美国康宁公司Costar 3599型96孔细胞培养板。
1.2 仪器和试剂日本岛津公司LC-6AD高效液相色谱仪和RID-10A视差检测器;利穗科技 (苏州) 公司EZ Purifier 100中压纯化系统;日本东京理化公司N-1100旋转蒸发仪,配以日本Ulvac Kiko公司DTC-22B真空泵和郑州长城科工贸公司DSB-5/10低温冷却液循环泵;上海沪西分析仪器公司BSZ-100自动部份收集器;美国应用生物系统公司MDS SCIEX API 2000 LC-MS/MS质谱 (MS) 仪,电喷雾 (ESI) 电离源; 瑞士布鲁克公司Ascend-500核磁共振仪,以美国Sigma-Aldrich公司氘代甲醇 (CD3OD) 为溶剂,化学位移 (δ, ppm) 值以甲醇残留峰3.31(氢谱) 和49.0(碳谱) 为参照;美国铂金埃尔默公司341旋光仪;德国艾本德公司移液枪;日本三洋电子公司MCO-15AC CO2培养箱;瑞士Tecan Group公司GENios酶标仪。
美国Sigma-Aldrich公司α-葡萄糖苷酶 (产自酵母Saccharomyces cerevisiae);百灵威科技公司对硝苯基-α-d-吡喃葡萄糖苷 (p-NPG) 和阿卡波糖;广州市俱辉化工公司食品级乙醇 (提取用);天津富宇精细化工公司分析纯甲醇、三氯甲烷、正丁醇、二甲亚砜 (DMSO);上海安谱公司色谱纯甲醇;广州化学试剂厂磷酸二氢钠、磷酸氢二钠、碳酸钠。
1.3 提取和分离火绒草粉末7270 g,先用60 L和50 L 95%乙醇浸泡2次,每次2 d,再用50 L 75%乙醇浸泡2 d,合并滤液,减压浓缩,得乙醇提取物1414.5 g。提取物用3 L水溶解,加入等体积三氯甲烷萃取3次,减压浓缩,得三氯甲烷萃取物155.87 g;水液用等体积正丁醇萃取4次,减压浓缩,得正丁醇萃取物198.68 g。正丁醇萃取物经硅胶柱色谱分离,三氯甲烷-甲醇[95:5~60:40, V/V, 下同]洗脱,收集流份, 薄层色谱检查,合并为12个组分 (F1~F12)。F5经中压液相色谱分离,甲醇-水 (1:9~10:0) 洗脱,收集流份,薄层色谱检查,合并为12个亚组分 (F5-1~F5-12)。F5-2经凝胶柱色谱分离,甲醇洗脱,得化合物8 (30 mg)。F5-6经高效液相色谱制备,以甲醇-水 (33:67) 为流动相,流速6 mL min-1,得化合物7 (保留时间tR94 min, 7 mg)。F6经中压液相色谱分离,甲醇-水 (1:9~10:0) 洗脱,收集流份,薄层色谱检查,合并为13个亚组分 (F6-1~F6-13)。F6-5经高效液相色谱制备,以甲醇-水 (29:71) 为流动相,流速6 mL min-1,得化合物1 (tR80 min, 74 mg)。F6-6经高效液相色谱制备,以甲醇-水 (30:70) 为流动相,流速6 mL min-1,得化合物6 (tR 123 min, 4 mg)。F7经中压液相色谱分离,甲醇-水 (1:9~7:3) 洗脱,收集流份,薄层色谱检查,合并为15个亚组分 (F7-1~F7-15)。F7-4经高效液相色谱制备, 以甲醇-水 (34:66) 为流动相,流速6 mL min-1,得化合物5 (tR 63 min, 15 mg)。F7-8经高效液相色谱制备,以甲醇-水 (40:60) 为流动相,流速6 mL min-1,得化合物4 (tR 50 min, 5.5 mg)。F9经中压液相色谱分离,甲醇-水 (1:9~10:0) 洗脱,收集流份,薄层色谱检查,合并为12个亚组分 (F9-1~F9-12)。F9-6经高效液相色谱制备,以甲醇-水 (32:68) 为流动相,流速为6 mL min-1,得化合物2 (tR 83 min, 16 mg) 和化合物3 (tR 90 min, 6 mg)。
1.4 α-葡萄糖苷酶抑制活性测定按Yang等[6]的方法进行。用DMSO将化合物倍比稀释成10、5、2.5、1.25、0.625、0.3125 mmol L-1溶液;用超纯水将磷酸二氢钠和磷酸氢二钠配置成67 mmol L-1缓冲液 (PBS, pH 6.8);用PBS配置0.5 U mL-1 α-葡萄糖苷酶溶液、5 mmol L-1 p-NPG溶液、0.2 mol L-1碳酸钠溶液。在96孔板中设置样品组 (8 μL样品液、112 μL PBS、20 μL酶液)、样品空白组 (8 μL样品液、132 μL PBS)、阴性组 (8 μL DMSO、112 μL PBS、20 μL酶液) 和阴性空白组 (8 μL DMSO、132 μL PBS),每个浓度设3个重复。加样完毕,摇匀,37℃保温15 min,每孔加入20 μL p-NPG溶液,摇匀,37℃保温15 min, 加入80 μL Na2CO3溶液终止反应,在405 nm波长测定各孔的吸光值 (OD)。参与酶反应的样品终浓度分别为500、250、125、62.5、31.25、15.625 μmol L-1,阳性对照阿卡波糖的终浓度比样品高一倍。
抑制率=[1-(OD样品-OD样品空白)/(OD阴性对照-OD阴性空白)]×100%
数据以平均值±标准差 (SD) 表示,用SPSS 19.0统计分析软件计算最大半数抑制浓度 (IC50)。
2 结果和分析 2.1 结构鉴定化合物1 白色粉末;ESI-MS m/z: 545.5 [M + Na]+、557.4 [M + Cl]-,结合13C NMR谱 (CD3OD, 125 MHz) 中的26个碳信号 (表 1) 判定其分子量为522,分子式为C26H34O11。在1H NMR谱 (CD3OD, 500 MHz) 中有3个ABX耦合芳香氢信号δ 7.03 (1H, d, J=2.0 Hz, H-2)、7.14 (1H, d, J=8.4 Hz, H-5)、6.93 (1H, dd, J=8.4, 2.0 Hz, H-6) 和2个宽单峰芳香氢信号δ 6.73、6.72 (各1H, H-2′, 6′),结合碳谱中δ 150.9至111.2范围的12个芳香碳信号,确定有2个苯环的存在;由氢信号δ 4.89 (1H, d, J=7.2 Hz, H-1′′) 和碳信号δ 102.8、78.2、77.8、74.9、71.3、62.5判断有1个β-葡萄糖基的存在;单峰氢信号δ 3.86、3.83 (各3H) 和碳信号δ 56.7、56.7表明有2个甲氧基 (OCH3) 的存在;在剩余的6个碳中,δ 88.4、65.1、62.2为与氧相连的碳,其他3个为非连氧烷基碳, 与这些碳相连的氢为δ 5.55 (1H, d, J=5.9 Hz, H-7)、3.47 (1H, m, H-8)、3.84 (1H, m, H-9)、3.75 (1H, dd, J=11.0, 7.5 Hz, H-9)、2.62 (2H, dd, J=8.6, 6.8 Hz, H2-7′)、1.81 (2H, m, H2-8′)、3.57 (2H, t, J=6.5 Hz, H2-9′);由耦合常数JH-7, H-8=5.9 Hz确定H-7和H-8为反式 (trans) 构型[7]。以上数据与文献[7]报道的一致,故鉴定为二氢去氢二松柏醇4-O-β-d-葡萄糖苷 (图 1)。
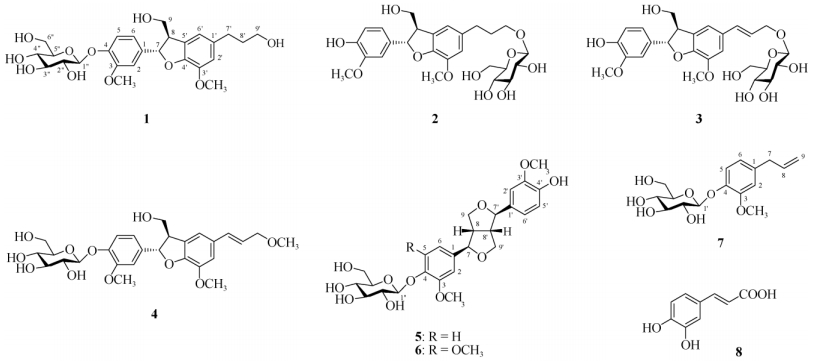
|
图 1 化合物1~8的化学结构 Fig. 1 Chemical structures of compounds 1-8 |
化合物2 白色粉末;ESI-MS m/z: 545.3 [M + Na]+、521.3 [M-H]-,分子量522,分子式C26H34O11;1H NMR (CD3OD, 500 MHz): δ 6.95 (1H, d, J=2.0 Hz, H-2), 6.76 (1H, d, J=8.2 Hz, H-5), 6.83 (1H, dd, J=8.2, 2.0 Hz, H-6), 5.49 (1H, d, J=6.2 Hz, H-7), 3.46 (1H, m, H-8), 3.84 (1H, m, H-9), 3.76 (1H, dd, J=11.0, 7.2 Hz, H-9), 6.76 (2H, br s, H-2′, 6′), 2.67 (2H, t, J=7.6 Hz, H2-7′), 1.91 (2H, m, H2-8′), 3.55 (2H, dt, J=9.7, 6.6 Hz, H2-9′), 3.85 (3H, s, OCH3), 3.81 (3H, s, OCH3), 4.26 (1H, d, J=7.8 Hz, H-1′′); 13C NMR (CD3OD, 125 MHz) 见表 1。以上数据与文献[8]报道一致,故鉴定为二氢去氢二松柏醇9′-O-β-d-葡萄糖苷。
| 表 1 化合物1~6的核磁共振碳谱数据 (CD3OD) Table 1 13C NMR data of compounds 1-6 in CD3OD |
化合物3 白色粉末;ESI-MS m/z: 543.2 [M + Na]+、555.6 [M + Cl]-,分子量520,分子式C26H32O11; 1H NMR (CD3OD, 500 MHz): δ 7.03 (1H, d, J=2.0 Hz, H-2), 7.15 (1H, d, J=8.5 Hz, H-5), 6.93 (1H, dd, J=8.5, 2.0 Hz, H-6), 5.59 (1H, d, J=5.9 Hz, H-7), 3.47 (1H, m, H-8), 3.84 (1H, m, H-9), 3.78 (1H, dd, J=11.1, 7.2 Hz, H-9), 6.97, 6.96 (各1H, br s, H-2′, 6′), 6.57 (1H, dt, J=15.9, 1.4 Hz, H-7′), 6.17 (1H, dt, J=15.8, 6.3 Hz, H-8′), 4.06 (2H, dd, J=6.3, 1.4 Hz, H2-9′), 3.89 (3H, s, OCH3), 3.83 (3H, s, OCH3), 3.36 (3H, s, OCH3), 4.89 (1H, d, J=7.3 Hz, H-1′′); 13C NMR (CD3OD, 125 MHz) 见表 1。以上数据与文献[9]报道一致,故鉴定为去氢二松柏醇9′-O-β-d-葡萄糖苷。
化合物4 白色粉末;ESI-MS m/z: 557.4 [M + Na]+、533.3 [M-H]-,分子量534,分子式C27H34O11; 1H NMR (CD3OD, 500 MHz): δ 7.03 (1H, d, J=2.0 Hz, H-2), 7.15 (1H, d, J=8.5 Hz, H-5), 6.93 (1H, dd, J=8.5, 2.0 Hz, H-6), 5.59 (1H, d, J=5.9 Hz, H-7), 3.47 (1H, m, H-8), 3.84 (1H, m, H-9), 3.78 (1H, dd, J=11.1, 7.2 Hz, H-9), 6.97, 6.96 (各1H, br s, H-2′, 6′), 6.57 (1H, dt, J=15.9, 1.4 Hz, H-7′), 6.17 (1H, dt, J=15.8, 6.3 Hz, H-8′), 4.06 (2H, dd, J=6.3, 1.4 Hz, H2-9′), 3.89 (3H, s, OCH3), 3.83 (3H, s, OCH3), 3.36 (3H, s, OCH3), 4.89 (1H, d, J=7.3 Hz, H-1′′); 13C NMR (CD3OD, 125 MHz) 见表 1。以上数据与文献[10]报道一致,故鉴定为去氢二松柏醇9′-甲醚-4-O-β-d-葡萄糖苷。
化合物5 白色粉末;[α]D20-37.0 (c 0.50, MeOH);ESI-MS m/z: 543.2 [M + Na]+、519.7 [M-H]-,分子量520,分子式C26H32O11;1H NMR (CD3OD, 500 MHz): δ 7.02 (1H, d, J=2.0 Hz, H-2), 7.14 (1H, d, J=8.4 Hz, H-5), 6.91 (1H, dd, J=8.4, 2.0 Hz, H-6), 4.70 (1H, d, J=4.3 Hz, H-7), 3.12 (2H, m, H-8, 8′), 4.23 (2H, m, H-9, 9′), 6.94 (1H, d, J=1.9 Hz, H-2′), 6.77 (1H, d, J=8.1 Hz, H-5′), 6.80 (1H, dd, J=8.1, 1.9 Hz, H-6′), 4.75 (1H, d, J=3.5 Hz, H-7′), 3.86 (3H, s, OCH3), 3.85 (6H, s, OCH3×2), 4.89 (1H, d, J=7.2 Hz, H-1′′); 13C NMR (CD3OD, 125 MHz) 见表 1。由耦合常数JH-7, H-8=4.3 Hz和JH-7′, H-8′=3.5 Hz确定H-7与H-8、H-7′与H-8′处于反式 (trans) 构型。以上数据与文献[11]报道一致,故鉴定为 (-)-松脂醇4-O-β-d-葡萄糖苷。
化合物6 白色粉末;[α]D20-19.6 (c 0.26, MeOH);ESI-MS m/z: 573.3 [M + Na]+、549.5 [M-H]-,分子量550,分子式C27H34O12;1H NMR (CD3OD, 500 MHz): δ 6.72 (2H, br s, H-2, H-6), 4.71 (1H, d, J=4.3 Hz, H-7), 3.14 (2H, m, H-8, 8′), 4.27 (2H, m, H-9, 9′), 6.95 (1H, d, J=1.9 Hz, H-2′), 6.77 (1H, d, J=8.1 Hz, H-5′), 6.81 (1H, dd, J=8.1, 1.9 Hz, H-6′), 4.77 (1H, d, J=4.1, H-7′), 3.86 (9H, s, OCH3× 3), 3.77 (1H, dd, J=12.0, 2.5 Hz, H-6′′), 3.66 (1H, dd, J=12.0, 5.1 Hz, H-6′′); 13C NMR (CD3OD, 125 MHz) 见表 1。以上数据与文献[12]报道基本一致,但比旋光值相反[11-12],故鉴定为 (-)-杜仲树脂酚4-O-β-d-葡萄糖苷。
化合物7 白色粉末;ESI-MS m/z: 349.1 [M + Na]+、325.3 [M-H]-,分子量326,分子式C16H22O7; 1H NMR (CD3OD, 500 MHz): δ 6.83 (1H, d, J=2.0 Hz, H-2), 7.09 (1H, d, J=8.2 Hz, H-5), 6.72 (1H, dd, J=8.2, 2.0 Hz, H-6), 3.33 (2H, d, J=6.7 Hz, H2-7), 5.95 (1H, ddt, J=16.8, 10.1, 6.7 Hz, H-8), 5.06 (1H, dd, J=16.8, 1.8 Hz, H-9), 5.03 (1H, dd, J=10.1, 1.8 Hz, H-9), 4.85 (1H, d, J=7.3 Hz, H-1′), 3.87 (1H, dd, J=11.9, 1.7 Hz, H-6′), 3.69 (1H, dd, J=11.9, 4.8 Hz, H-6′), 3.84 (3H, s, OCH3); 13C NMR (CD3OD, 125 MHz): δ 136.4 (C-1), 114.1 (C-2), 150.8 (C-3), 146.3 (C-4), 118.3 (C-5), 122.1 (C-6), 40.8 (C-7), 139.0 (C-8), 115.8 (C-9), 103.1 (C-1′), 56.7 (OCH3), 74.9 (C-2′), 78.2 (C-3′), 71.3 (C-4′), 77.8 (C-5′), 62.5 (C-6′)。由核奥弗豪塞尔效应谱 (NOESY) 中甲氧基与H-2间存在相关峰确认甲氧基连接在C-3位。以上数据与文献[13]报道一致,故鉴定为枸橼苦素C。
化合物8 白色粉末;ESI-MS m/z: 181.1 [M + H]+、179.2 [M-H]-,分子量180,分子式C9H8O4;1H NMR (CD3OD, 500 MHz): δ 7.03 (1H, d, J=2.1 Hz, H-2), 6.78 (1H, d, J=8.2 Hz, H-5), 6.93 (1H, dd, J=8.2, 2.1 Hz, H-6), 7.53 (1H, d, J=15.9 Hz, H-7), 6.22 (1H, d, J=15.9 Hz, H-8); 13C NMR (CD3OD, 125 MHz): δ 127.8 (C-1), 116.5 (C-2), 146.8 (C-3), 149.4 (C-4), 115.7 (C-5), 115.1 (C-6), 146.9 (C-7), 122.8 (C-8), 171.2 (C-9)。以上数据与文献[14]报道一致,故鉴定为咖啡酸。
2.2 α-葡萄糖苷酶抑制活性500 μmol L-1的化合物1~8对α-葡萄糖苷酶的抑制率分别为 (32.6±2.6)%、(35.4±0.9)%、(22.2±0.6)%、(29.3±1.5)%、(20.5±1.5)%、(36.2±1.9)%、(22.8±1.6)%和 (11.5±1.6)%,均低于50%,阳性对照阿卡波糖的IC50值为 (626.3±25.8) μmol L-1。
3 讨论已从火绒草中分离鉴定的木脂素类化合物有二氢去氢二松柏醇4-O-β-d-葡萄糖苷[15]、松柏苷[15]、3, 5′-dimethoxy-4′, 7-epoxy-8, 3′-neolignane-5, 9, 9′-triol[3]、everiastoside L[15];简单苯丙素类化合物有咖啡酸[16]、咖啡酸乙酯[16]、桂皮酸[2]、对羟基桂皮酸[16]、阿魏酸[16]、3, 4-二咖啡酰奎宁酸[17]、3, 5-二咖啡酰奎宁酸[17]和5-hydroxyobliquin[4]。我们又分离鉴定了4个苯骈呋喃类木脂素:二氢去氢二松柏醇4-O-β-d-葡萄糖苷 (1)、二氢去氢二松柏醇9′-O-β-d-葡萄糖苷 (2)、去氢二松柏醇9′-O-β-d-葡萄糖苷 (3)、去氢二松柏醇9′-甲醚-4-O-β-d-葡萄糖苷 (4);2个双四氢呋喃类木脂素:(-)-松脂醇4-O-β-d-葡萄糖苷 (5) 和 (-)-杜仲树脂酚4-O-β-d-葡萄糖苷 (6);2个简单苯丙素类:枸橼苦素C (7) 和咖啡酸 (8)。其中化合物2~7为首次从该植物中报道。
在前期动物试验中,火绒草乙醇提取物具有显著的降血糖活性[5]。α-葡萄糖苷酶可从非还原末端水解低聚糖和多聚糖的α-1, 4-葡萄糖苷键,也能作用于淀粉的α-1, 6-葡萄糖苷键,产生α-d-葡萄糖,α-葡萄糖苷酶抑制剂可控制餐后血糖的升高。因此, α-葡萄糖苷酶是筛选降血糖活性物质的一个常用指标[18]。遗憾的是,上述8个木脂素类化合物在500 μmol L-1浓度下对α-葡萄糖苷酶的抑制率均低于50%。
为了解这些化合物的降血糖活性,通过Sci-Finder Scholar检索了一些文献。用50 μg mL-1的化合物1、2、7和8处理C2C12骨骼肌细胞24 h,化合物1和2对2-去氧-d-葡萄糖的吸收量为对照 (用100 nmol L-1胰岛素处理) 的64.2%和77.7% (P < 0.001),表现出显著的降血糖活性;化合物8比对照略低,活性不明显;化合物7则为对照的138.3% (P < 0.001),显示出升血糖活性[19]。化合物7对α-葡萄糖苷酶和α-淀粉酶无抑制活性[20],但给易卒中自发性低血压大鼠 (Stroke-prone spontaneously hypotensive rats) 静脉注射1 mg (100 g)-1体重,半小时后鼠尾血压下降了20 mm汞柱[21]。化合物8对α-葡萄糖苷酶无活性 (IC50=957 μg mL-1, 即5.317 μmol L-1)[22],但对麦芽糖酶和果糖酶的IC50值分别为34.7和87.5 μmol L-1[23]。给小鼠腹腔注射3.0 mg kg-1体重的化合物8,半小时后小鼠血液中的葡萄糖含量下降近20%[24]。简言之,化合物1、2和8具有明确的降血糖活性,但作用机制不是通过抑制α-葡萄糖苷酶。其它化合物的降血糖活性有待进一步研究。
| [1] | CHEN Y S, BAYER R J. Leontopodium R. Brown ex Cassini [M]//Flora of China, Vol. 20-21. Beijing: Science Press & St. Louis: Missouri Botanical Garden Press, 2011: 778-788. |
| [2] |
NAREN G W, WU X J. Resaerch progress of a Mongolian folk medicine Chagan-Arong (Leontopodium leontopodioides)[J].
J Med Pharm Chin Minor, 2014, 20(10): 53-56. 娜仁高娃, 吴香杰. 蒙药材查干-阿荣 (火绒草) 的研究进展[J]. 中国民族医药杂志, 2014, 20(10): 53-56. DOI:10.3969/j.issn.1006-6810.2014.10.033 |
| [3] | LI X, LUO J G, WANG X B, et al. Phenolics from Leontopodium leontopodioides inhibiting nitric oxide production[J]. Fitoterapia, 2012, 83(5): 883-887. DOI:10.1016/j.fitote.2012.03.020 |
| [4] | DOBNER M J, ELLMERER E P, SCHWAIGER S, et al. New lignan, benzofuran, and sesquiterpene derivatives from the roots of Leonto-podium alpinum and L. leontopodioides[J]. Helv Chim Acta, 2003, 86(3): 733-738. DOI:10.1002/hlca.200390072 |
| [5] |
YANG J B, YUAN Z Y, GOU P. Screening of effective hypoglycemic constituents of Leontopodium leontopodioides[J].
Chin J Exp Trad Med Formul, 2015, 21(18): 104-106. 杨金部, 袁祯燕, 苟萍. 火绒草降糖有效成分的筛选[J]. 中国实验方剂学杂志, 2015, 21(18): 104-106. DOI:10.13422/j.cnki.syfjx.2015180104 |
| [6] | YANG D, XIE H H, JIANG Y M, et al. Phenolics from strawberry cv. Falandi and their antioxidant and α-glucopsidase inhibitory activities[J]. Food Chem, 2016, 194: 857-863. DOI:10.1016/j.foodchem.2015.08.091 |
| [7] | MATSUDA N, SATO H, YAOITA Y, et al. Isolation and absolute structures of the neolignan glycosides with the enantiometric aglycones from the leaves of Viburnum awabuki K.Koch[J]. Chem Pharm Bull, 1996, 44(5): 1122-1123. DOI:10.1248/cpb.44.1122 |
| [8] | TAKEDA Y, MIMA C, MASUDA T, et al. Glochidioboside, a glucoside of (7S, 8R)-dihydrodehydrodiconiferyl alcohol from leaves of Glochidion obovatum[J]. Phytochemistry, 1998, 49(7): 2137-2139. DOI:10.1016/S0031-9422(98)00362-8 |
| [9] | JIANG Z H, TANAKA T, SAKAMOTO M, et al. Studies on a medicinal parasitic plant: Lignans from the stems of Cynomorium songaricum[J]. Chem Pharm Bull, 2001, 49(8): 1036-1038. DOI:10.1248/cpb.49.1036 |
| [10] | IIZUKA M, WARASHINA T, NORO T. Bufadienolides and a new lignan from the bulbs of Urginea maritima[J]. Chem Pharm Bull, 2001, 49(3): 282-286. DOI:10.1248/cpb.49.282 |
| [11] | CASABUONO A C, POMILLO A B. Lignans and a stilbene from Festuca argentina[J]. Phytochemistry, 1994, 35(2): 479-483. DOI:10.1016/S0031-9422(00)94786-1 |
| [12] |
NAN Z D, ZHAO M B, JIANG Y, et al. Lignans from stems of Cistanche deserticola cultured in Tarim desert[J].
China J Chin Mat Med, 2015, 40(3): 463-468. 南泽东, 赵明波, 姜勇, 等. 塔中栽培荒漠肉苁蓉中的木脂素类成分[J]. 中国中药杂志, 2015, 40(3): 463-468. DOI:10.4268/cjcmm20150318 |
| [13] |
LIU L L, LI X X, CHEN Y, et al. Study on phenolic acids from Flos sophorae[J].
J Tianjin Univ Trad Chin Med, 2014, 33(1): 39-41. 刘丽丽, 李晓霞, 陈玥, 等. 槐米中酚酸类化学成分的研究[J]. 天津中医药大学学报, 2014, 33(1): 39-41. DOI:10.11656/j.issn.1673-9043.2014.01.13 |
| [14] | SONG C Z, WANG Y H, HUA Y, et al. Chemical constituents of Clematis montana[J]. Chin J Nat Med, 2008, 6(2): 116-119. DOI:10.3724/SP.J.1009.2008.00116 |
| [15] |
CHEN Q, WANG T, WU C H, et al. Isolation and identification of constituents from whole plant of Leontopodium leontopodioides (Willd.) Beauv. (Ⅲ)[J].
J Shenyang Pharm Univ, 2013, 30(3): 171-177. 陈秋, 王涛, 吴春华, 等. 火绒草化学成分的分离与鉴定 (Ⅲ)[J]. 沈阳药科大学学报, 2013, 30(3): 171-177. |
| [16] |
CAO Y, WANG L, CHEN Y Z, et al. Isolation and identification of phenols constituents from whole plant of Leontopodium leonto-podioides[J].
J Shenyang Pharm Univ, 2012, 29(8): 606-608, 639. 曹跃, 王丽, 陈昱竹, 等. 火绒草中酚类成分的分离与鉴定[J]. 沈阳药科大学学报, 2012, 29(8): 606-608, 639. |
| [17] |
JIN L Q, WANG E, WANG H, et al. Chemical constituents in the aerial parts of Leontopodium leontopodioides from Xinjiang[J].
Pharm Clin Res, 2011, 19(3): 241-243. 靳丽卿, 王恩, 汪豪, 等. 新疆产火绒草地上部分的化学成分[J]. 药学与临床研究, 2011, 19(3): 241-243. DOI:10.13664/j.cnki.pcr.2011.03.010 |
| [18] |
FAN L, WANG Y L, TANG L. Review on screening methods for alpha-glucosidase inhibitors from natural resources[J].
Nat Prod Res Dev, 2016, 28(2): 313-321. 范莉, 王业玲, 唐丽. 天然来源α-葡萄糖苷酶抑制剂筛选方法的研究进展[J]. 天然产物研究与开发, 2016, 28(2): 313-321. DOI:10.16333/j.1001-6880.2016.2.026 |
| [19] | HUANG H C, CHAO C L, LIAW C C, et al. Hypoglycemic constituents isolated from Trapa natans L. pericarps[J]. J Agric Food Chem, 2016, 64(19): 3794-3803. DOI:10.1021/acs.jafc.6b01208 |
| [20] | SALTOS M B V, PUENTE B F N, FARAONE I, et al. Inhibitors of α-amylase and α-glucosidase from Andromachia igniaria Humb. & Bonpl.[J]. Phytochem Lett, 2015, 14: 45-50. DOI:10.1016/j.phytol.2015.08.018 |
| [21] | MATSUBARA Y, YUSA T, SAWABE A, et al. Structure and physio-logical activity of phenyl propanoid glycosides in lemon (Citrus limon Burm. f.) peel[J]. Agri Biol Chem, 1991, 55(3): 647-650. DOI:10.1080/00021369.1991.10870631 |
| [22] | MA Y Y, ZHAO D G, ZHOU A Y, et al. α-Glucosidase inhibition and antihyperglycemic activity of phenolics from the flowers of Edge-worthia gardneri[J]. J Agric Food Chem, 2015, 63(37): 8162-8169. DOI:10.1021/acs.jafc.5b03081 |
| [23] | RATTANANGKOOL E, KITTIKHUNNATHAM P, DAMSUD T, et al. Quercitylcinnamates, a new series of antidiabetic bioconjugates possessing α-glucosidase inhibition and antioxidant[J]. Eurp J Med Chem, 2013, 66: 296-304. DOI:10.1016/j.ejmech.2013.05.047 |
| [24] | de SOUZA G F P, NOVAES L F T, AVILA C M, et al. (-)-Tarcho-nanthuslactone exerts a blood glucose-increasing effect in experimental type 2 diabetes mellitus[J]. Molecules, 2015, 20(3): 5038-5049. DOI:10.3390/molecules20035038 |
 2017, Vol. 25
2017, Vol. 25


