2. 水中典型污染物控制与水质保障北京市重点实验室, 北京 100044
2. Beijing Key Laboratory of Aqueous Typical Pollutants Control and Water Quality Safeguard, Beijing 100044, China
近年来转基因毛状根组织在植物修复技术中的应用研究受到广泛关注, 毛状根组织被越来越多地应用于重金属和有机污染物的植物修复技术研究中, 已成为一种便捷的实验室研究工具。目前愈伤组织、细胞悬液、芽、毛状根等离体培养组织都已成功地应用于植物修复重金属和有机污染物研究中[1], 相对而言, 毛状根在植物修复研究方面具有更大的优势, 首先, 植物直接接触污染物的器官一般都是根系, 而毛状根具有正常根的所有形态和生理体征, 能够作为根系的模式体系开展植物根系对有毒物质的解毒机制和代谢途径研究; 同时毛状根具有稳定的遗传性状和表型特征, 能够提供稳定的可重复的研究系统; 其次, 毛状根是植物被发根农杆菌侵染后形成的转基因产物, 可以作为重金属超富集植物的转基因研究载体; 进一步可以通过农杆菌Ri质粒的直接转化引入植物相关重要金属离子转运蛋白或富集因子的基因, 对植物和重金属超富集植物进行改造, 提高植物的修复潜能, 重建和筛选优良的转基因植株[2]。目前已从裂叶沙参 (Adenophora lobophylla)、天蓝遏蓝菜 (Thlaspi caeru-lescens)、印度芥菜 (Brassica juncea) 等重金属超富集植物中诱导出毛状根, 并开展了相关重金属和有机污染物修复机制的研究[3]。
东南景天 (Sedum alfredii) 为景天科 (Crassulaceae) 景天属多年生草本植物, 是近年来在中国浙江衢州、湖南郴州古老铅锌矿区发现的一种锌、镉、铅超富集植物, 对土壤中过量的锌、镉、铅具有强忍耐能力。与超富集植物天蓝遏蓝菜、印度芥菜、龙葵 (Solanum nigrum)、宝山堇菜 (Viola baoshanensis)、商陆 (Phytolacca acinosa)、红菾菜 (Beta vulgaris var. cicla)、圆锥南芥 (Arabis paniculata) 等比较, 东南景天具有地上部分能积累较多镉的特性, 能有效减轻土壤中的重金属污染[4-5]。目前已有研究者对东南景天富集镉的动力学过程和特点、根系对镉的响应等进行了研究, 结果表明东南景天修复效率较大, 特别适合修复低中度镉污染土壤[6-10]。熊愈辉等[6]采用营养液培养法,在500 μmol L-1的Cd水平下, 东南景天叶中镉含量可达峰值5677 mg kg-1, 茎中可达峰值5274 mg kg-1。并且东南景天适应性强, 耐瘠薄、干旱及强光等恶劣生境, 是开展植物修复与生态绿化的优良品种, 具有良好的应用潜力。但目前重金属超富集植物要真正大规模应用于实际的污染土壤修复, 还需要进一步提高其对重金属的特异性吸收和富集的能力, 而构建转基因毛状根体系可为实现重金属超富集植物的真正应用提供优良的实验室研究平台。
能否成功诱导出毛状根取决于植物本身的特性、农杆菌种类和诱导技术, 本研究对东南景天毛状根诱导技术中的时间因素进行了研究, 建立了东南景天毛状根培养体系, 为今后利用东南景天毛状根进行植物富集重金属的代谢机制等研究奠定了基础。
1 材料和方法 1.1 无菌外植体的制备东南景天 (Sedum alfredii) 购自新丝绿花卉公司, 采自东北辽宁, 为富集重金属型。挑选幼嫩的叶片, 用无菌水清洗3次, 用75%酒精消毒60 s, 无菌水清洗3次; 然后用0.1% NaClO浸泡5 min, 无菌水冲洗3次, 用无菌滤纸将叶片表面的水分吸干, 在无菌条件下将东南景天无菌苗的幼嫩叶片剪成0.5 cm×0.5 cm大小, 接种于MS固体培养基 (不添加任何激素), 25℃黑暗预培养2 d, 作为遗传转化用的外植体。
1.2 发根农杆菌的活化发根农杆菌 (Agrobacterium rhizogenes) A4是致根能力强的农杆碱型菌株, 菌株具有卡那霉素抗性。在无菌条件下, 用接种针挑取保存的A4菌液, 在YEB固体平板上划线, 28℃黑暗培养, 直到长出单菌落。挑取1个单菌落接种于50 mL附加有50 mg L-1卡那霉素的液体YEB培养基中, 28℃、180 r min-1下培养24 h复苏, 测定菌悬液OD值, OD值为1.0左右时取l mL菌液加入50 mL YEB液体培养基中进行第二次活化, 28℃、180 r min-1下暗培养12 h, 再次测定活化菌液OD值, OD值达到0.6~0.8时即为对数生长期, 此时菌液可作侵染用。
1.3 发根农杆菌介导的遗传转化在超净工作台上, 将预培养后的无菌外植体转至已灭菌的锥形瓶中, 再将活化的侵染菌液倒入锥形瓶中, 侵染10 min后取出外植体, 无菌水清洗2遍, 用无菌滤纸吸干表面菌液, 接种到原MS固体平板培养基上, 25℃黑暗共培养2 d。转化后的外植体转接到含有500 mg L-1头孢噻肟钠的MS固体平板培养基上, 于25℃黑暗培养, 多次继代直至完全除菌后再去掉抗生素继续培养, 约1~2周可长出毛状根。30 d后统计诱导出的毛状根数, 并计算平均诱导率:诱导率=(长出毛状根的外植体数/接种外植体的总数)×100%。
设置预培养时间、侵染时间、共培养时间对毛状根诱导的影响试验。预培养时间分别为0、24、48、72、96 h; 侵染时间分别为0、4、6、8、10、12 min; 共培养时间分别为24、48、72、96 h。每个试验取20个侵染的外植体统计诱导率, 每个试验均重复3次。对照均为未受农杆菌侵染的外植体, 其他培养条件一致。
1.4 毛状根的PCR检测获得的毛状根是否为发根农杆菌诱导还需要进行鉴定, 通过检验发根农杆菌Ri质粒中与形态发生相关的基因片段, 是转化的可靠分子证据[11], 毛状根的分子鉴定方法包括PCR、Southern Blot等。本试验采用PCR检测发根农杆菌Ri质粒中能够整合进入植物基因组中的rolB片段 (540 bp) 来鉴定。取5.0 g东南景天毛状根, 采用CTAB法提取基因组DNA并纯化。按照Furner等[12]的方法设计并合成PCR引物。正向引物为frolB: 5′-TACTGCAGCAG-GCTTCATGAC-3′, 反向引物为rrolB: 5′-GCTTTC-CCGACCAGAGACTG-3′。PCR扩增程序为: 94℃变性3 min; 然后94℃变性1 min, 53.5℃退火1 min, 共35个循环; 72℃延伸1 min。扩增产物采用0.8%琼脂糖凝胶电泳和Gel Red染色进行分析。
1.5 数据统计分析使用Excel对数据进行处理和方差分析, 采用Duncan多重比较进行差异显著性分析。
2 结果和分析 2.1 毛状根的诱导和鉴定用培养5 h的农杆菌A4菌液侵染叶片外植体培养1个月, 获得东南景天毛状根 (图 1: A)。东南景天叶片外植体明显发黄并出现褐色斑点, 从切口长出的线状组织便是毛状根, 呈白色线状, 侧根多且短, 根的分支多, 无向地性, 呈绒毛样, 能够在无激素培养基上旺盛生长, 这些特点符合毛状根生长的特性。未经农杆菌A4菌液侵染的叶片外植体培养1个月后, 只有1块外植体长出1条长约1 cm左右的根 (箭头), 且没有分支, 没有侧根 (图 1: B), 不是毛状根。
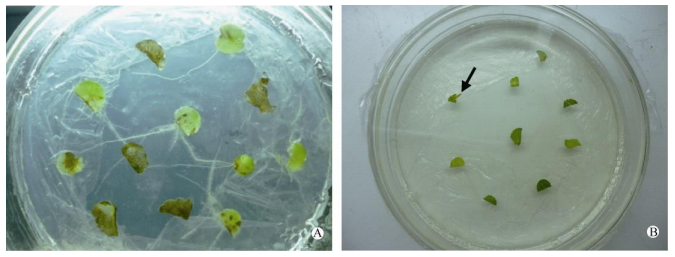
|
图 1 东南景天毛状根的诱导。A:农杆菌A4诱导的毛状根; B:对照。 Fig. 1 Induction of hairy roots of Sedum alfredii. A: Hairy roots inducted by Agrobacterium rhizogenes A4; B: Control. |
从图 2可见, PCR引物能从3株东南景天毛状根中扩增到期望的540 bp的特异性rolB基因片段, 该片段与野生型发根农杆菌A4的Ri质粒中的特异性片段大小相同, 而对照外植体未扩增出此片段。这表明诱导的东南景天毛状根是转基因产物。

|
图 2 东南景天毛状根rolB基因的PCR扩增。M: DL 2000; 1: A4的Ri质粒; 2:对照; 3~5:毛状根。 Fig. 2 PCR amplification of rolB gene from Sedum alfredii hairy roots. M: DL 2000; 1: Ri plasmid of A4; 2: Control; 3-5: Hairy root. |
预培养时间 叶片外植体在侵染前需要进行一定时间的预培养, 以使叶片适应新的培养环境。结果表明, 未经过预培养的叶片受农杆菌A4侵染后迅速死亡, 而经过一定时间预培养后能诱导出毛状根, 预培养48 h后毛状根的诱导率达80%, 预培养24 h和72 h的分别为45%和60%, 而预培养96 h的仅为10%, 说明48 h是最佳的预培养时间 (表 1)。
| 表 1 预培养时间对东南景天毛状根诱导率的影响 Table 1 Effect of pre-culture time on induction rate of hairy roots of Sedum alfredii |
侵染时间 适宜的侵染时间有助于农杆菌对植物细胞的附着和转化, 侵染时间太短, 农杆菌来不及侵入细胞内部; 侵染时间太长, 农杆菌易对细胞造成伤害, 导致外植体的存活率下降。从表 2可见, 农杆菌A4对东南景天叶片外植体的侵染时间不宜过长, 侵染6 min毛状根的诱导率达到最高 (85%)。随着侵染时间的延长毛状根的诱导率逐渐下降, 侵染12 min时毛状根的诱导率仅10%。
| 表 2 侵染时间对东南景天毛状根诱导率的影响 Table 2 Effect of infection time on induction rate of hairy roots of Sedum alfredii |
共培养时间 由表 3可见, 侵染后的东南景天叶片外植体经过不同时间的共培养后, 诱导率明显不同。共培养48 h东南景天毛状根的诱导率可达到85%, 共培养超过72 h的诱导率明显降低。因此48 h是最适宜的共培养时间。
| 表 3 共培养时间对东南景天毛状根诱导率的影响 Table 3 Effect of co-culture time on induction rate of hairy roots of Sedum alfredii |
关于重金属超富集植物东南景天毛状根的遗传转化目前还未见相关报道。本研究利用发根农杆菌A4转化东南景天叶片外植体, 获得了激素自主、快速生长、多分支、多根毛的毛状根株系, 并经PCR鉴定为转基因株系。
对影响毛状根诱导率的重要时间因素进行分析。结果表明, 东南景天诱导毛状根的适宜预培养时间为48 h、侵染时间为6 min、共培养时间为48 h。有关影响植物毛状根诱导的时间因素的研究已有不少报道, 张悦等[13]的研究表明, 48~72 h是黄秋葵 (Abelmoschus esculentu) 毛状根诱导的最佳预培养时间, 以48 h的诱导率最高。本研究中预培养时间对东南景天毛状根诱导的影响与黄秋葵基本一致, 表明这两种植物外植体适应后续侵染环境的时间要求相似。农杆菌侵染植物外植体的时间十分关键, 侵染时间过短或过长都会对毛状根诱导产生显著的影响。刘静轶等[11]的研究表明, 农杆菌ATCC15834侵染油菜 (Brassica campestris) 4 h的毛状根诱导率最高 (28.9%); 杨世海等报道农杆菌A4侵染紫锥菊 (Echinacean purpurea) 外植体12 min的毛状根诱导率较高 (55.5%)[14]。农杆菌A4对东南景天外植体侵染6 min的毛状根诱导率较高 (85%), 比油菜和紫锥菊的侵染时间更短且诱导率更高, 这可能是农杆菌菌种不同和不同植物对农杆菌侵染敏感性不同造成的[15], 也表明东南景天对农杆菌A4的侵染敏感性较高。侵染后农杆菌和外植体的共培养时间也是影响毛状根诱导率的重要因素, 一般不应短于16 h; 但也不应过长, 否则会造成农杆菌过度生长[16]。杨世海等[14]报道共培养2 d紫锥菊毛状根的诱导率较高 (50%)。本研究中农杆菌和外植体的共培养时间以48 h较适宜, 超过48 h毛状根的诱导率明显下降, 这与杨世海等的结果一致。
重金属超富集植物毛状根体系已经在植物修复研究中显示出很好的应用潜力。Nedelkoska等[17]的研究结果表明, 吸附在天蓝遏蓝菜毛状根中的Cd含量大于其他非重金属超富集植物; 同时对毛状根细胞壁的研究揭示了天蓝遏蓝菜和烟草 (Nicotiana tabacum) 毛状根在富集Cd过程中的代谢途径不同。因此, 东南景天毛状根体系的成功建立可为实验室开展重金属修复机制研究提供简便的实验体系, 并且为进一步开展重金属超富集植物东南景天的转基因改造奠定理论基础。
| [1] | Doran P M. Application of plant tissue cultures in phytoremediation research: Incentives and limitations[J]. Biotechn Bioeng, 2009, 103(1): 60-76. DOI:10.1002/bit.22280 |
| [2] | van AKEN B. Transgenic plants for phytoremediation: Helping nature to clean up environmental pollution[J]. Trends Biotechn, 2008, 26(5): 225-227. DOI:10.1016/j.tibtech.2008.02.001 |
| [3] | AGOSTINI E, TALANO M A, GONZÁLEZ P S, et al. Application of hairy roots for phytoremediation: What makes them an interesting tool for this purpose?[J]. Appl Microbiol Biotechn, 2013, 97(3): 1017-1030. DOI:10.1007/s00253-012-4658-z |
| [4] | YANG X E, LONG X X, NI W Z, et al. Sedum alfredii H.: A new Zn hyperaccumulating plant first found in China[J]. Chin Sci Bull, 2002, 47(19): 1634-1637. DOI:10.1007/BF03184113 |
| [5] | YANG X E, LONG X X, YE H B, et al. Cadmium tolerance and hyperaccumulation in a new Zn-hyperaccumulating plant species (Sedum alfredii Hance)[J]. Plant Soil, 2004, 259(1/2): 181-189. DOI:10.1023/B:PLSO.0000020956.24027.f2 |
| [6] |
XIONG Y H, YANG X E, YE Z Q, et al. Comparing the characteristics of growth response and accumulation of cadmium and lead by Sedum alfredii Hance[J].
J NW Sci-Techn Univ Agri For (Nat Sci), 2004, 32(6): 101-106. 熊愈辉, 杨肖娥, 叶正钱, 等. 东南景天对镉、铅的生长反应与积累特性比较[J]. 西北农林科技大学学报 (自然科学版), 2004, 32(6): 101-106. DOI:10.3321/j.issn:1671-9387.2004.06.023 |
| [7] |
LI T Q, YANG X E, LONG X X. Zinc Phytoextraction ability from polluted soil of hyperaccumulating ecotype of Sedum alfredii Hance[J].
J Soil Water Conserv, 2004, 18(6): 79-83. 李廷强, 杨肖娥, 龙新宪. 东南景天提取污染土壤中锌的潜力研究[J]. 水土保持学报, 2004, 18(6): 79-83. DOI:10.3321/j.issn:1009-2242.2004.06.019 |
| [8] |
LI J G, JIN L S, CHEN Y Q, et al. Effects of nitrogen fertilizer on the root morphology and cadmium accumulation in low cadmium treatment Sedum alfredii Hance[J].
Chin Agri Sci Bull, 2007, 23(3): 260-265. 李继光, 金兰淑, 陈禹桥, 等. 氮对低镉处理下东南景天根系形态及镉积累的影响[J]. 中国农学通报, 2007, 23(3): 260-265. DOI:10.3969/j.issn.1000-6850.2007.03.057 |
| [9] |
ZHANG Y Y, DOU C Y, YAO F, et al. Nitrogen application to enhance zinc and cadmium uptake by the hyperaccumulator Sedum alfredii[J].
J Zhejiang For Coll, 2010, 27(6): 831-838. 张圆圆, 窦春英, 姚芳, 等. 氮素营养对重金属超积累植物东南景天吸收积累锌和镉的影响[J]. 浙江林学院学报, 2010, 27(6): 831-838. DOI:10.3969/j.issn.2095-0756.2010.06.005 |
| [10] | JIN X F, YANG X E, ISLAM E, et al. Effects of cadmium on ultra-structure and antioxidative defense system in hyperaccumulator and non-hyperaccumulator ecotypes of Sedum alfredii Hance[J]. J Hazard Mat, 2008, 156(1/2/3): 387-397. DOI:10.1016/j.jhazmat.2007.12.064 |
| [11] |
LIU J Y. Research on Agrobacterium rhizogenes-mediated IRT1 gene transformation in Cd hyperaccumulator Brassica campestris L. [D]. Beijing: Beijing Jiaotong University, 2014: 1-35.
刘静轶. 发根农杆菌介导IRT1基因转化镉超富集植物油菜的研究[D]. 北京: 北京交通大学, 2014: 1-35. |
| [12] | FURNER I J, HUFFMAN G A, AMASINO R M, et al. An Agrobac-terium transformation in the evolution of the genus Nicotiana[J]. Nature, 1986, 319(6052): 422-427. DOI:10.1038/319422a0 |
| [13] |
ZHANG Y, YANG S H. Induction and in vitro culture of Abelmoschus esculentus hairy roots[J].
Lishizhen Med Mat Med Res, 2011, 22(12): 2991-2994. 张悦, 杨世海. 黄秋葵毛状根的诱导及培养[J]. 时珍国医国药, 2011, 22(12): 2991-2994. DOI:10.3969/j.issn.1008-0805.2011.12.074 |
| [14] |
YANG S H, BI X X, YANG H J. Induction of Echinacean purpurea hairy roots and in vitro culture[J].
Chin Pharm J, 2011, 46(20): 1557-1562. 杨世海, 毕晓秀, 杨慧洁. 紫锥菊毛状根诱导及离体培养[J]. 中国药学杂志, 2011, 46(20): 1557-1562. |
| [15] |
ZHAO P, WANG K, ZHANG W, et al. Review and inspiration of plant proteins involved in the transformation processing of T-DNA initiated by Agrobacterium[J].
Sci Agri Sin, 2014, 47(13): 2504-2518. 赵佩, 王轲, 张伟, 等. 参与农杆菌侵染及T-DNA转运过程植物蛋白的研究进展和思考[J]. 中国农业科学, 2014, 47(13): 2504-2518. DOI:10.3864/j.issn.0578-1752.2014.13.003 |
| [16] |
XU K J, SHI L L, LIU S D, et al. Wheat seed germination and seedling physio-biochemical characteristics with co-cultivation conditions during Agrobacterium tumefaciens soaking[J].
Acta Bot Boreali-Occid Sin, 2011, 31(4): 697-706. 徐开杰, 史丽丽, 刘曙东, 等. 农杆菌共培养条件对小麦种子萌发和幼苗生理生化特性的影响[J]. 西北植物学报, 2011, 31(4): 697-706. |
| [17] | NEDELKOSKA T V, DORAN P M. Hyperaccumulation of cadmium by hairy roots of Thlaspi caerulescens[J]. Biotechn Bioeng, 2000, 67(5): 607-615. DOI:10.1002/(SICI)1097-0290(20000305)67:5<607::AID-BIT11>3.0.CO;2-3 |
 2017, Vol. 25
2017, Vol. 25


