芦笋 (Asparagus officinalis L.) 又名石刁柏, 为百合科 (Liliaceae) 天门冬属宿根草本植物。芦笋嫩茎质细肉嫩, 含有多种氨基酸和微量元素, 营养成分高于一般蔬菜, 有预防和治疗癌症、结石、心脏病、肾炎、高血压、膀胱炎等的药用价值。因而芦笋享有“蔬菜之王”的美誉, 属世界十大名菜之一[1]。
我国芦笋产业自20世纪90年代以来获得迅猛发展, 2008年全国种植面积就已达1.0×105 hm2, 产业规模位列世界第一, 目前产值已超过100亿元[2-3]。芦笋为典型的雌雄异株植物, 雄性植株因不结实而具有较高的产量, 一般比雌株产量高出25%左右[4]。生产上采用选择育种、杂交育种、全雄育种、多倍体育种和航天诱变育种等多种育种方法培育全雄株种子[5]。近年来, 我国科学家打破了国外品种一枝独秀的局面, 选育出一批优良的芦笋品种, 主要包括普通杂交F1代种、全雄F1代种和高抗病F1代种等[3, 6-7]。作物杂交亲本间遗传距离是进行亲本组配的重要依据之一。进行杂交育种时, 在一定的范围内, 育种亲本间的遗传差异愈大, 后代中分离出的变异类型愈多, 选出理想类型的机会愈大。芦笋雌雄异株, 育种所需雌性亲本可由田间筛选优良雌性单株扩繁, 而雄性亲本需经过人工培育。笔者利用芦笋花药培养技术、游离小孢子培养技术和染色体人工加倍技术等, 建立起芦笋单倍体、超雄株和四倍体等雄性无性系, 并通过田间种植观测, 已筛选出一批易试管繁殖、定植成活率高且能正常开花的雄性亲本[8-10]。为了能更好地进行杂交亲本组配, 需对这些芦笋育种亲本间的遗传距离进行分析。
目前, 利用RAPD (Random amplified polymer-phic DNA) 和ISSR (Inter simple sequence repeats) 等分子标记技术对不同品种芦笋种质资源的遗传多样性进行了分析[11-15], 但不同育种亲本个体间的亲缘关系分析未见报道。ISSR标记是采用17~22 bp的重复锚定引物扩增重复序列之间的片段, 具有无需知道任何靶标序列的微卫星背景信息、遗传多态性高、稳定高效、检测快速等特点[16], 已成功应用于芹菜 (Apium graveolens)[17]、野牡丹属 (Melastoma) 植物[18]和野生铁皮石斛 (Dendrobium officinale)[19]等的种质资源遗传多样性研究和亲缘关系分析。本研究利用ISSR分子标记技术, 对9份芦笋雌性亲本和10份雄性亲本的遗传多样性和亲缘关系进行分析, 以期探索不同育种亲本间的遗传距离, 为后续进行杂交育种的亲本组配提供科学参考。
1 材料和方法 1.1 材料试验所用芦笋 (Asparagus officinalis L.) 育种亲本材料共19份, 9份为雌性亲本, 10份为雄性亲本 (表 1)。其中雌性亲本为种子苗田间自然优株筛选而来, 均为二倍体植株。雄性亲本则是通过人工诱导培育而来, 其中纯合二倍体即超雄株由花药培养的单倍体经染色体加倍而来, 四倍体由田间自然二倍体雄株经染色体加倍而来。从田间分别采集19份种质材料的新鲜拟叶, 放入冰盒中带回实验室, 于-80℃冰箱内保存备用。
| 表 1 供试的19份芦笋种质 Table 1 19 germplasms of Asparagus officinalis tested |
所用ISSR引物由上海生工生物工程股份有限公司合成。dNTPs、DNA marker和Ex Taq DNA聚合酶等试剂购自大连宝生物 (TaKaRa) 工程有限公司。试剂CTAB、EDTA购自上海生工生物工程股份有限公司。
1.3 基因组DNA的提取和检测芦笋总DNA提取采用改良CTAB小量法[20-21]进行。取0.2 g芦笋拟叶于液氮中研磨成粉末, 转置于2 mL离心管中; 加入900 μL 65℃预热的2× CTAB提取液 (100 mmol L-1 Tris-HCl pH 8.0, 1.4 mmol L-1 NaCl, 20 mmol L-1 EDTA, 2% CTAB)、3% β-巯基乙醇和100 μL无水乙醇快速振荡混匀; 于65℃水浴中温育60 min后, 13000×g下离心5 min; 吸取900 μL上清液于新的2 mL离心管中, 加入等体积900 μL的苯酚:氯仿:异戊醇 (25:24:1), 振荡数次, 13000×g下常温离心10 min; 取上清液750 μL, 转入新的1.5 mL离心管中, 加入等体积的氯仿:异戊醇 (24:1), 振荡数次, 13000×g下离心10 min; 最后, 吸取上清液550 μL, 加入1/10体积预冷的3 mol L-1 NaAc (pH 5.2) 和等体积异丙醇, 于-20℃放置30 min, 离心后获得的沉淀经75%乙醇洗涤2次, 无水乙醇洗涤1次, 干燥后加入100 μL灭菌水; -20℃保存备用。
芦笋总DNA采用1.2%的琼脂糖凝胶电泳检测完整性, 并用Quawell UV-Vis spectrophotometer Q5000 (Quawell Technology, San Jose, CA, USA) 测定其浓度。
1.4 PCR反应体系及程序PCR反应体系优化 为了确定合适的模板浓度, 将DNA样品分别稀释到3 ng、8 ng、10 ng、18 ng、20 ng和40 ng, 建立25 μL基本反应体系, 包含2.5 μL 10×Ex Taq Buffer, 2.0 μL的2.5 mmol L-1 dNTPs, 1.0 μL的引物 (10 μmol L-1), 0.125 μL的Ex Taq DNA聚合酶 (5 U μL-1) 以及1.0 μL的DNA模板, 最后用无菌水定容至25 μL。
引物筛选及退火温度优化 以编号4的芦笋阿波罗 (‘Apollo’) 二倍体雌性植株为样本, 对100条随机ISSR引物进行初步筛选, 根据引物合成单上的Tm值加减3℃~5℃的方法, 分别设置46.2℃、48.6℃、50.7℃、52.6℃、54.0℃和56.2℃共6个梯度, 采用上述的反应体系进行PCR扩增, 以条带清晰且多态性好为原则, 筛选最佳的退火温度。
1.5 ISSR-PCR扩增和数据处理筛选出的18条引物 (表 2) 分别对19份芦笋样品进行PCR扩增后采用2.0%的琼脂糖凝胶电泳检测, 使用凝胶成像系统拍照记录结果。根据扩增谱带照片, 将清晰、可重复且长度在200~2000 bp的进行记录, 对同一引物的扩增条带, 迁移率相同的条带计1个位点, 扩增阳性 (有条带) 记为“1”, 扩增阴性 (无条带) 记为“0”, 所得数据输入Excel表格, 建成原始表征01数据矩阵。利用NTSYS 2.1软件中Similarity程序的Qualitative data计算SM相似系数, 然后用Clustering程序中的SHAN进行UPGMA聚类分析, 绘制聚类图。在SM相似系数的基础上, 应用Ordination程序中的Eigen进行二元主成分分析, 获得19份种质的PCA图。此外, 采用POPGENE 1.32进行芦笋群体遗传分析, 19份样本作为1个群体分别计算其位点的平均观测等位基因数 (Na)、每个位点的平均有效等位基因数 (Ne)、Nei’s基因多样性指数 (He) 以及Shannon’s信息指数 (Ⅰ)。
| 表 2 筛选的18条ISSR引物序列 Table 2 Sequences of 18 ISSR primers screened |
提取的芦笋总DNA条带整齐, 无弥散状, OD260/OD280在1.8~2.0之间, 说明DNA完整性和纯度较好。经电泳检测, 芦笋ISSR-PCR反应体系的最佳模板量为40 ng, 引物的最佳退火温度为50.7℃。采用该反应体系和程序进行PCR扩增, 从100条ISSR引物中初步筛选出24条多态性较好的引物 (图 1)。根据条带清晰可见的原则, 最终选择18条引物对19份芦笋样品进行ISSR-PCR扩增, 引物名称分别为807, 808, 811, 822, 825, 826, 835, 836, 840, 841, 842, 844, 855, 856, 861, 864, 868和873。
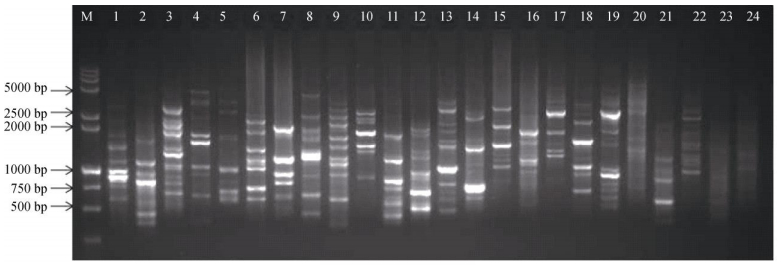
|
图 1 ‘阿波罗’芦笋 (No. 4) 的ISSR引物筛选。M: 15000+2000bp Marker; 1~24分别为引物807、808、811、822、824、825、826、835、836、840、841、842、844、855、856、861、864、868、873、878、880、881、884和886。 Fig. 1 Screening of primers used in 'Apollo' (No. 4). M: 15000+2000 bp Marker; 1-24 are primers of 807, 808, 811, 822, 824, 825, 826, 835, 836, 840, 841, 842, 844, 855, 856, 861, 864, 868, 873, 878, 880, 881, 884 and 886, respectively. |
用筛选出的18条引物对19份芦笋样品的DNA多态性进行检测, 共扩增出187条带, 其中多态性条带176条, 多态性条带百分率为94.1% (表 3), 表明19个芦笋育种亲本间具有丰富的遗传多样性。扩增位点多且多态性最好的引物有811、844和861, 位点数均为13, 多态性最差的是引物868, 多态性百分率仅为66.7%。芦笋样品经引物811均能扩增出不同条带, 其中1号和19号样品的扩增条带较弱,多态性最差, 而8号、12号和13号样品扩增的条带清晰可见, 多态性较好。引物868对19份芦笋种质扩增结果表明, 各样品扩增的条带具有较好的多态性 (图 2)。不同引物的扩增产物差异可能是由引物与模板结合的效率和退火温度不同所引起。
| 表 3 ISSR-PCR引物及扩增结果 Table 3 PCR amplification results by primers |
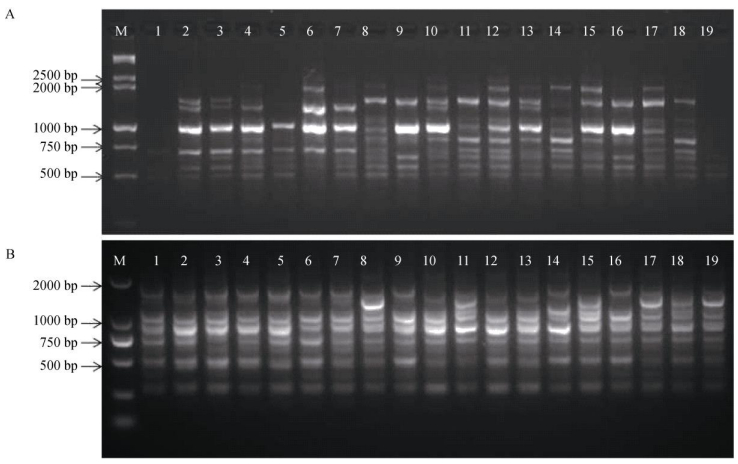
|
图 2 引物811 (A) 和868 (B) 对芦笋的ISSR扩增图谱。A: M: 15000+2000 bp Marker; B: M: 2000 bp Marker; 1~19见表 1。 Fig. 2 Amplification of Asparagus by primers 811 (A) and 868 (B). A: M: 15000+2000 bp Marker; B: M: 2000 bp Marker; 1-19 see Table 1. |
POPGENE 1.32群体遗传分析的结果表明, 187个位点的平均观测等位基因数 (Na) 为1.9465±0.2256, 平均有效等位基因数 (Ne) 为1.6679±0.3215, Nei’s基因多样性 (He) 为0.3719±0.1514, Shannon’s信息指数 (Ⅰ) 为0.5417±0.1972。利用NTSYS 2.1软件中Similarity程序的Qualitative data计算SM相似系数, 样品间的相似系数为0.56~0.80, 平均相似系数为0.68, 用Clustering程序中的SHAN进行UPGMA聚类分析 (图 3)。结果表明, 在相似系数为0.62处, 可将芦笋样品分为三大类群。第Ⅰ类群只有2号单独处在一个分支, 2号为美国品种‘绿龙’(‘Green Dragon’), 表明该品种与荷兰品种和其他美国品种都存在较大的遗传距离, 其生育指数 (茎粗、株高和茎数的乘积) 较高。第Ⅱ类群包括6号、8号、10号、18号和19号等5个样品, 除6号为美国品种‘格兰德’(‘Grande’) 外, 其余均为荷兰品种‘金林’ (‘Gijnlim’) 人工培育的雄株, 其中, 18号和19号样品的同源性最近, 相似系数为0.80, 二者均为荷兰品种‘金林’的田间优良单株经过染色体加倍筛选出来的四倍体雄株。此类群材料的生育指数均高于第Ⅲ类群, 但与‘绿龙’品种相比, 差异均不明显。第Ⅲ类群又可划分为a和b两个亚组。a亚组包含1号、3号、4号、12号、14号和15号等6个样品, 除12号为荷兰品种‘金林’人工培育的纯合二倍体外, 其余均为各品种田间筛选的优良雌性单株; b亚组包含5号、7号、9号、11号、13号、16号和17号共7个样品, 其中5号样品为美国品种‘阿波罗’田间筛选优良雌株, 7号样品为美国品种‘格兰德’田间筛选优良雌株, 其余均有荷兰品种‘金林’人工培育的雄株。

|
图 3 基于ISSR分子标记的19份芦笋样品UPGMA聚类图 Fig. 3 UPGMA tree of 19 asparagus samples based on ISSR markers |
应用NTSYS2.1软件对ISSR数据进行主成分分析, 从图 4可以看出, 2号样品单独处于一支 (Ⅰ类群); 6号、8号、18号和19号较密集地聚集在一起, 与图 3的Ⅰ类和Ⅱ类基本一致。图 4中的Ⅲ类群包含了图 3的Ⅲ类b亚组和部分a亚组, 以及10号样品 (图 3中属于Ⅱ类群)。此外, 图 4中的1号和3号在不同方向上与其他类群相差较远, 独立归为Ⅳ类群, 这是与图 3不同之处。
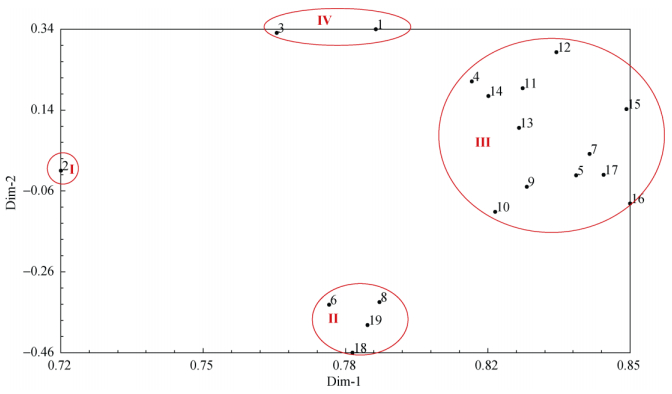
|
图 4 19份芦笋样品的主坐标散点图 Fig. 4 Principal coordinate scatter analysis of 19 asparagus samples |
图 3和图 4比较可知, 对19份芦笋种质的系统聚类与主成分分析结果既有相同也存在差异, 说明只有将聚类分析和主坐标不同方向不同维度的分析相结合, 才能更准确地分析芦笋各种质间的亲缘关系。
3 讨论本研究采用ISSR方法对19份芦笋育种亲本进行遗传多样性分析, 构建了UPGMA聚类图, 揭示了不同品种、同一品种田间自然个体以及同一品种倍性育种后代个体间的亲缘关系。李霞等[11]利用RAPD技术、代真真等[14]和齐惠仙等[15]利用ISSR技术分析了不同地理来源的芦笋品种, 认为品种的地理来源同聚类结果有一定的关系, 来源于同一地方的品种相似系数较高。本研究结果表明, 除美国芦笋品种‘绿龙’单独聚类为一个大类外, 来源于美国的其他品种与荷兰芦笋品种‘金林’亲缘关系较近, 这与前人的研究结果相符。芦笋品种‘绿龙’是由美国培育的杂交种, 嫩茎肥大、顶端鳞片包裹紧密、散头率较低, 适应性好, 抗性强, 不易染病, 对根腐病、茎枯病有较高耐病性, 是近年来推广的一种产量高、质量好的优良品种。本研究结果表明‘绿龙’与其他品种的亲缘关系较远, 而且其生育指数较高。嫩茎产量是评价芦笋品种质量的重要指标, 提高嫩茎产量是芦笋育种的重要目标。生产实践上一般用生育指数 (茎粗、株高和茎数三者的乘积) 来估计嫩茎产量, 生育指数高则嫩茎产量高, 反之就低。因此, ‘绿龙’可以作为一个较有应用潜力的杂交亲本。
本研究结果还表明, 同一品种中也存在遗传距离较远的个体。如6号和7号材料都是美国品种‘格兰德’的雌株, 但分别属于不同的大类; 而第Ⅲ类群的4号和5号材料均为‘阿波罗’品种雌株, 也分属于同一大类的不同亚组中。这种同一品种不同个体间表现出远近不同的遗传距离的现象, 可能跟芦笋雌雄异株, 属于异花授粉植物, 进化程度较高有关。这种田间自然存在的遗传差异, 为芦笋杂交育种的亲本筛选提供了一种途径。同时, 来源于荷兰的‘金林’品种经倍性育种培育出的个体分散于不同的大类中, 表现出丰富的遗传多样性, 而且这些试验材料的生育指数也表现出第Ⅱ类群 (8号、10号、18号和19号) 高于第Ⅲ类群 (9号、11号、12号、13号、16号和17号) 的特点。这种遗传多样性的出现, 可能与芦笋染色体在加倍时使用了化学诱变剂对DNA碱基的改变有关[11]。本研究从侧面证明了芦笋倍性育种有可能创造出新的更为丰富的育种亲本。此外, 12号、14号和15号样品均为荷兰的‘金林’品种, 其中12号为雄株, 其他为雌株, 图 3的聚类图可以看出12号和15号样品具有较近的亲缘关系, 均归为Ⅲ类群的a亚组, 这与图 4中三者均聚集到Ⅲ类群的结果基本一致。
本研究清晰地揭示了芦笋9份雌性育种亲本和10份雄性亲本间的亲缘关系及种内的遗传多样性, 为进一步进行亲本杂交组配提供理论依据和技术参考。
| [1] |
PU K Q, LIU J B, MA D H.
New Cultivation Technique of Asparagus[M]. Nanjing: Jiangsu Science and Technique Press, 2003: 1-101.
卜克强, 刘敬斌, 马德华. 芦笋栽培新技术[M]. 南京: 江苏科学技术出版社, 2003: 1-101. |
| [2] |
LUO Y, YU Y F, ZHOU K H. Analysis of bottleneck in development of Chinese Asparagus industry[J].
Acta Agri Jiangxi, 2012, 24(1): 187-190. 罗莹, 余艳锋, 周开洪. 中国芦笋产业发展瓶颈分析[J]. 江西农业学报, 2012, 24(1): 187-190. DOI:10.3969/j.issn.1001-8581.2012.01.054 |
| [3] |
CHEN G Y. Development status and trends of Chinese Asparagus industry[J].
World Agri, 2013(10): 181-186. 陈光宇. 中国芦笋产业发展现状与趋势[J]. 世界农业, 2013(10): 181-186. DOI:10.3969/j.issn.1002-4433.2013.10.050 |
| [4] |
YANG H F, CHEN Z T, XUE P, et al. All male Asparagus 'X0812'[J].
Vegetables, 2012(3): 27-28. 杨海峰, 陈振泰, 薛萍, 等. 全雄X0812芦笋[J]. 蔬菜, 2012(3): 27-28. DOI:10.3969/j.issn.1001-8336.2012.03.015 |
| [5] |
ZHANG T X, LIN Z K, CAI K X, et al. Research progress in Asparagus breeding in China[J].
Acta Agri Jiangxi, 2011, 23(4): 57-59. 张天翔, 林宗铿, 蔡坤秀, 等. 我国芦笋育种研究进展[J]. 江西农业学报, 2011, 23(4): 57-59. DOI:10.3969/j.issn.1001-8581.2011.04.018 |
| [6] |
YIN J Y, YE J S, ZHAO W X, et al. Breeding of new variety all male Asparagus 'Jing Green Lu 4'[J].
Vegetables, 2012(2): 25-26. 尹俊玉, 叶劲松, 赵卫星, 等. 京绿芦4号全雄芦笋新品种选育[J]. 蔬菜, 2012(2): 25-26. DOI:10.3969/j.issn.1001-8336.2012.02.014 |
| [7] |
ZHANG L B, WANG Z H, XU H L. A new salt-tolerant Asparagus F1 hybrid 'Yansun No. 1'[J].
China Veget, 2005(7): 33-35. 张立宾, 王智华, 徐化凌. 耐盐芦笋新品种盐笋1号的选育[J]. 中国蔬菜, 2005(7): 33-35. DOI:10.3969/j.issn.1000-6346.2005.07.015 |
| [8] |
LIN Z K, WEN Q F, LIN Y Z. Technology system of culture for Asparagus officiralis L. anther[J].
J Fujian Agri Sci, 2010, 25(2): 212-216. 林宗铿, 温庆放, 林义章. 芦笋高效花药培养技术体系的建立[J]. 福建农业学报, 2010, 25(2): 212-216. DOI:10.3969/j.issn.1008-0384.2010.02.019 |
| [9] |
CAI K X, LIN Z K, ZHANG T X, et al. Priminary report of microspore culture of white asparagus[J].
Fujian Sci Techn Trop Crops, 2011, 36(2): 8-10. 蔡坤秀, 林宗铿, 张天翔, 等. 白芦笋游离小孢子培养初报[J]. 福建热作科技, 2011, 36(2): 8-10. DOI:10.3969/j.issn.1006-2327.2011.02.003 |
| [10] |
ZHANG T X, LIN Z K, CAI K X, et al. Research on the technique of chromosome doubling of haploids of Asparagus officinalis L.[J].
Chin Agri Sci Bull, 2011, 27(13): 212-215. 张天翔, 林宗铿, 蔡坤秀, 等. 芦笋单倍体染色体加倍技术研究[J]. 中国农学通报, 2011, 27(13): 212-215. |
| [11] |
LI X, DIAO J L, LI S H, et al. Genetic diversity of asparagus (Asparagus officinalis L.) based on RAPD[J].
J Plant Genet Res, 2005, 6(3): 310-314. 李霞, 刁家连, 李书华, 等. 芦笋种质资源遗传多样性的RAPD分析[J]. 植物遗传资源学报, 2005, 6(3): 310-314. DOI:10.3969/j.issn.1672-1810.2005.03.014 |
| [12] |
LI K F, HAN T L, DONG G J, et al. Genetic diversity of asparagus (Asparagus officinalis L.) cultivars detected by morphological and molecular markers[J].
J Plant Genet Res, 2006, 7(1): 59-65. 李可峰, 韩太利, 董贵俊, 等. 用形态与分子标记研究石刁柏种质资源遗传多样性[J]. 植物遗传资源学报, 2006, 7(1): 59-65. DOI:10.3969/j.issn.1672-1810.2006.01.012 |
| [13] |
SHENG W T, ZHOU J S, TANG Y P, et al. Optimization of extraction of total DNA and ISSR-PCR system in Asparagus officinalis[J].
Acta Agri Jiangxi, 2010, 22(9): 38-41. 盛文涛, 周劲松, 汤泳萍, 等. 芦笋基因组DNA提取与ISSR反应体系的优化[J]. 江西农业学报, 2010, 22(9): 38-41. DOI:10.3969/j.issn.1001-8581.2010.09.011 |
| [14] |
DAI Z Z, JIANG C J, YANG F, et al. ISSR analysis of 24 Asparagus germplasms[J].
Chin J Trop Agri, 2012, 32(5): 35-40. 代真真, 江程记, 杨峰, 等. 24份芦笋种质的ISSR分析[J]. 热带农业科学, 2012, 32(5): 35-40. DOI:10.3969/j.issn.1009-2196.2012.05.009 |
| [15] |
QI X H, LI G Z, WU D T. Primer screening and genetic diversity analysis of Asparagus by ISSR[J].
J Shanxi Agri Univ (Nat Sci), 2014, 34(3): 249-253. 齐仙惠, 李改珍, 巫东堂. 芦笋ISSR引物筛选及遗传多样性分析[J]. 山西农业大学学报 (自然科学版), 2014, 34(3): 249-253. |
| [16] |
LIU S Q, WU F Z, LIU S W. Inter-simple sequence repeat and its application in horticultural crop research[J].
J NE Agri Univ, 2012, 43(4): 145-150. 刘淑芹, 吴凤芝, 刘守伟. 园艺作物的ISSR分子标记研究及应用[J]. 东北农业大学学报, 2012, 43(4): 145-150. DOI:10.3969/j.issn.1005-9369.2012.04.027 |
| [17] |
WANG W T, GU Y, HAN Q H, et al. ISSR analysis of celery germplasm genetic relationships[J].
China Veget, 2011(8): 22-27. 王武台, 古瑜, 韩启厚, 等. 芹菜种质资源亲缘关系的ISSR分析[J]. 中国蔬菜, 2011(8): 22-27. |
| [18] |
ZHENG T, CHEN Z D, LIN X X, et al. ISSR analysis of Melastoma germplasm in Fujian Province[J].
J Trop Subtrop Bot, 2013, 21(5): 406-413. 郑涛, 陈振东, 林秀香, 等. 福建省野牡丹属种质资源的ISSR分析[J]. 热带亚热带植物学报, 2013, 21(5): 406-413. DOI:10.3969/j.issn.1005-3395.2013.05.003 |
| [19] |
JIANG J L, YE W, LI Y Q, et al. Genetic relationships among wild Dendrobium officinale populations in Taining, Fujian by ISSR[J].
J Trop Subtrop Bot, 2016, 24(3): 259-266. 江金兰, 叶炜, 李永清, 等. 福建泰宁野生铁皮石斛种群的ISSR亲缘关系分析[J]. 热带亚热带植物学报, 2016, 24(3): 259-266. DOI:10.11926/j.issn.1005-3395.2016.03.003 |
| [20] |
GAO J M, DAI Z Z, JIANG C J, et al. Comparison of DNA extraction methods of Asparagus[J].
J Trop Organ, 2011, 2(2): 153-156. 高建明, 代真真, 江程记, 等. 芦笋DNA提取方法的比较研究[J]. 热带生物学报, 2011, 2(2): 153-156. DOI:10.3969/j.issn.1674-7054.2011.02.013 |
| [21] |
YAO W, GENG G L, YU A L, et al. An improved method for isolation of transgenic sugarcane genomic DNA[J].
J Trop Subtrop Bot, 2004, 12(3): 257-260. 姚伟, 耿广良, 余爱丽, 等. 一种改良的转基因甘蔗基因组DNA提取方法[J]. 热带亚热带植物学报, 2004, 12(3): 257-260. DOI:10.3969/j.issn.1005-3395.2004.03.012 |
 2017, Vol. 25
2017, Vol. 25



