2. 广东省农业科学院果树研究所, 广州 510640;
3. 中国科学院华南植物园, 广州 510650
2. Institute of Fruit Tree Research, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;
3. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China
檀香 (Santalum album L.) 是半寄生植物,必须通过吸器从寄主吸收水分和无机盐供自身生长发育的需要[1-2]。而檀香吸器与寄主生理上的连接主要通过维管组织来完成,所以对檀香吸器功能和发育研究的核心是吸器如何与寄主建立维管组织联系。尽管前人对吸器的发育过程有较为全面的研究[1-4], 但对吸器发育的超微结构变化,依然知之甚少。
Barbe[1-2]对檀香吸器结构进行了解剖研究,但缺少对吸器发育前期的观察。Rao[3]对檀香吸器的发育研究比较全面,檀香成熟吸器的维管组织呈典型倒烧瓶结构 (Inverted flask-shaped)。Tennakoo等[4]认为檀香吸器与寄主是通过接触面上薄壁细胞膜进行营养传递,而非导管与导管直接内腔传递[4]。Zhang等认为檀香吸器通过酶和机械力量侵入寄主植物并建立了寄生-寄主关系[5]。Yang等研究了檀香吸器个体发育中吸器坍塌层 (Collapsed layer) 的起源、发育和功能[6]。Ouyang等经过比较,认为优良寄主能与檀香建立更好的维管组织连接并具有更好的光合作用[7]。
本文拟对檀香吸器发育中维管组织的建立过程进行研究,报道檀香吸器发育维管组织过程的显微结构变化,为檀香半寄生性特性研究提供形态解剖基础。
1 材料和方法 1.1 材料用500 mg L-1 GA3处理檀香 (Santalum album L.) 种子1 d,置于温室内20 cm厚的沙床上进行萌发。1个月后将萌发的小苗移入12 cm×12 cm塑料袋内, 并于袋内扦插檀香苗常用寄主假蒿 (Kuhnia rosmar-nifolia),放于温室内,适时进行施肥和浇水,待檀香苗生长到4片叶子时移出温室,以接受足够光照。当幼苗生长到30 cm (5月龄) 时,从苗的侧根上切取吸器,以未吸附寄主根的吸器为初级和幼嫩时期、吸附寄主根的吸器为产生腺体时期-侵入寄主之后的时期,各时期均取样10个,重复3次。
1.2 方法整体透明法 材料经2.5%戊二醛-2%多聚甲醛 (pH 7.2) 固定24 h,双蒸水洗6次,乙醇梯度脱水 (30%、50%、75%、85%、95%, 各30 min),染色过夜 (50%曙红0.03 mL+5%金橙0.01 mL+95%酒精0.96 mL)。第2天,双蒸水洗6次,乙醇梯度脱水 (30%、50%、75%、85%、95%、100%、100%,各30 min)。经脱水的材料先在纯水杨酸甲酯和100%酒精的等量混合液中过渡3 h,最后在纯水杨酸甲酯中换洗3次,每次1 h以上,最后纯水杨酸甲酯保存过夜。材料封片,Zeiss-LSCM-510 META型激光扫描共聚焦显微镜观察,拍照。
常规石蜡切片法 对于体积较大,需要观察其整体结构的材料,我们采用石蜡切片法。材料经FAA固定24 h以上,复水 (50%乙醇、30%乙醇、蒸馏水2次,各30 min),爱氏苏木精 (2%) 整体染色 (染色时间根据材料定),自来水冲洗蓝化,乙醇逐级脱水 (30%、50%、75%、85%、95%、100%、100%,各30 min),二甲苯透明 (3次,各1 h),融蜡,浸蜡, 包埋,制成蜡块,常规石蜡切片 (512 μm),粘片,融蜡,脱蜡,复水,再经番红 (0.2%)-固绿 (0.2%) 双重染色,乙醇逐级脱水 (30%、50%、75%、85%、95%、100%、100%,各30 min),二甲苯透明 (3次,各1 h),封片。用OLYMPUS-AX-70型显微镜观察及拍照。
半薄切片法 对于一些体积较小,或仅需观察局部位置的材料采用半薄切片法。材料经2.5%戊二醛-2%多聚甲醛 (pH 7.2) 固定24 h,0.1 mol L-1磷酸缓冲液漂洗 (pH 7.2), 漂洗后转入1%锇酸固定液 (pH 7.2) 固定4 h,乙醇梯度脱水 (30%、50%、75%、85%、95%、100%、100%,各30 min),环氧丙烷置换,Epon812环氧树脂渗透并包埋,然后置烤箱烘干,在45℃ (12 h)、60℃ (24~36 h) 烤箱内加温,即可聚合硬化,形成包埋块。LKB-11800切片机切片 (0.5~2 μm),经0.5%甲苯胺蓝染色,OLYMPUS-AX-70型显微镜观察及拍照。
超薄切片法 对于亚细胞的形态结构则采用透射电镜来观察。材料经2.5%戊二醛-2%多聚甲醛 (pH 7.2) 固定24 h,用0.1 mol L-1磷酸缓冲液 (pH 7.2) 漂洗后转入1%锇酸固定液 (pH 7.2) 固定4 h,乙醇梯度脱水 (30%、50%、75%、85%、95%、100%、100%,各30 min),环氧丙烷置换, Epon812环氧树脂渗透并包埋,然后置烤箱烘干, 在45℃ (12 h)、60℃ (2436 h) 烤箱内加温,聚合硬化,形成包埋块。LKB-11800切片机修块定位,Leica UC6超薄切片机切片 (50~70 nm),用醋酸铀-柠檬酸铅双染色,JEOL-EM-1010型透射电镜在100 kV下观察、拍照。
所有图片采用Adobe Photoshop CS5软件处理。
2 结果和分析 2.1 檀香侧根的基本结构和吸器维管组织的发生檀香侧根的基本结构分为表皮、皮层和维管柱 (图 1: A)。表皮由1层薄壁细胞构成,呈坍塌状; 皮层由数层薄壁细胞组成,最内层的薄壁细胞较小, 为内皮层;根的中心是维管柱,由维管组织及周围的1层中柱鞘细胞构成,维管组织由木质部和韧皮部组成。
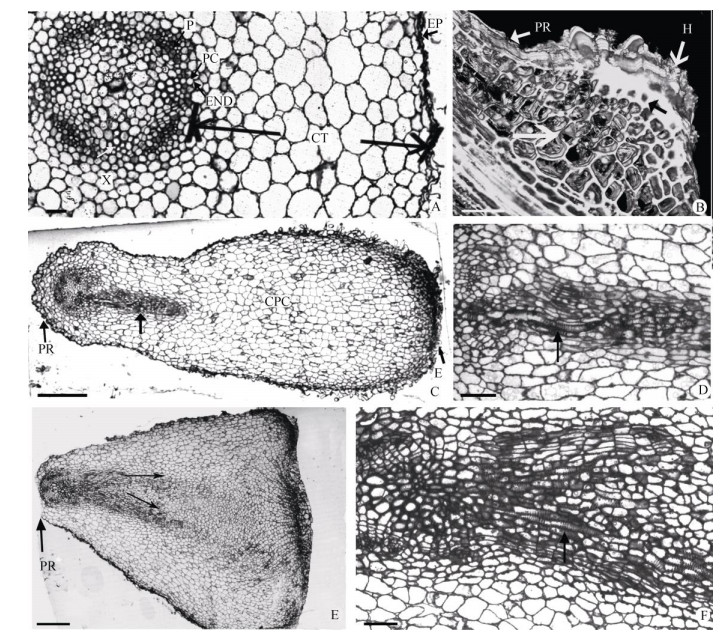
|
图 1 檀香幼嫩吸器的维管组织发生。A:侧根的纵切面结构 (半薄切片),示表皮 (EP)、皮层 (CT)、中柱鞘 (PC)、内皮层 (END)、韧皮部 (P)、木质部 (X); B:细嫩吸器的纵切面 (激光共聚焦扫描),示母体根 (PR) 和吸器 (H),吸器表皮细胞质浓 (黑色箭头),皮层细胞增生 (白色箭头),无维管组织的分化; C:幼嫩吸器即将进行维管组织分化 (箭头),示表皮 (E)、皮层 (CTL) 和中部薄壁组织 (CPC)(半薄切片); D: C图部分放大,示幼嫩吸器基部 (半薄切片); E:维管组织开始分支分化 (箭头)(半薄切片), 示寄主根 (PR); F: E图部分放大,示吸器基部木质部分子 (箭头) (半薄切片)。标尺: A, B, F=0.05 mm; C, E=0.2 mm; D=0.1 mm Fig. 1 Origin of vascular tissue of young haustorium of Santalum album. A: Transverse section (semithin section) of the lateral root, showing epidermis (EP), cortex (CT), endodermis (END), pericyle (PC), phloem (P), and xylem (X); B: Longitudinal section of young haustorium under laser scan confocal microscope, showing parent root (PR) and haustorium (H), dense cytoplasm of epidermal cells (blank arrow), proliferative cortical cells (white arrows), and no vascular tissue differentiation; C: Vascular tissue of young haustoria (semithin section) was about to differentiate (arrow), showing parent root (PR), central parenchyma core (CPC), and endodermis (E); D: Enlargement of figure C, showing vascular tissue began to differentiation (semithin section)(arrow); E: Semithin section, vascular tissue began to branch differentiation (arrows), showing parent root (PR); F: Enlargement of figure E, showing the xylem element (arrow)(semithin section). Bars: A, B, F=0.05 mm; C, E=0.2 mm; D=0.1 mm |
30 cm高的檀香苗侧根上生长了大量的吸器, 檀香吸器发生于细根的侧面。当吸器发生时,檀香侧根会出现明显的突起,分生细胞呈深染色,皮层细胞也出现增生 (图 1: B),无维管组织发生。
幼嫩吸器呈盘状,吸器前端从突起状变成水平状 (图 1: C),此时吸器顶部细胞在光学显微镜下细胞质比较浓,染色较深。吸器主要由表皮、皮层和中部薄壁组织组成。表皮细胞为薄壁细胞,通常呈坍塌、破裂状;皮层细胞数层,比表皮细胞大,也是薄壁细胞。中部薄壁组织也是薄壁细胞,但比皮层细胞小、圆,偶尔有浓密细胞质,具有分生能力。此时吸器基部具有维管组织的分化 (图 1: D)。如果吸器与寄主根相邻,则吸附寄主根,呈向寄主根方向生长的状态。
如盘状的吸器不靠近寄主根会继续生长,体积明显增大,基部的维管组织会由中部向两边分支生长, 形成分支的维管组织,位置仍处于基部 (图 1: E, F)。
2.2 吸器侵入生长和维管组织的发育当盘状的幼嫩吸器靠近寄主根后,吸器会产生明显的向性生长 (朝向寄主根方向),包裹寄主根。在吸器的纵切面、寄主根的横切面上,可观察到吸器中心有明显的内部腺体结构,其中心分生区细胞排列紧密、染色较深,两边是皮层薄壁细胞。维管组织仍位于吸器的基部,无明显的向顶部和寄主生长 (图 2: A)。
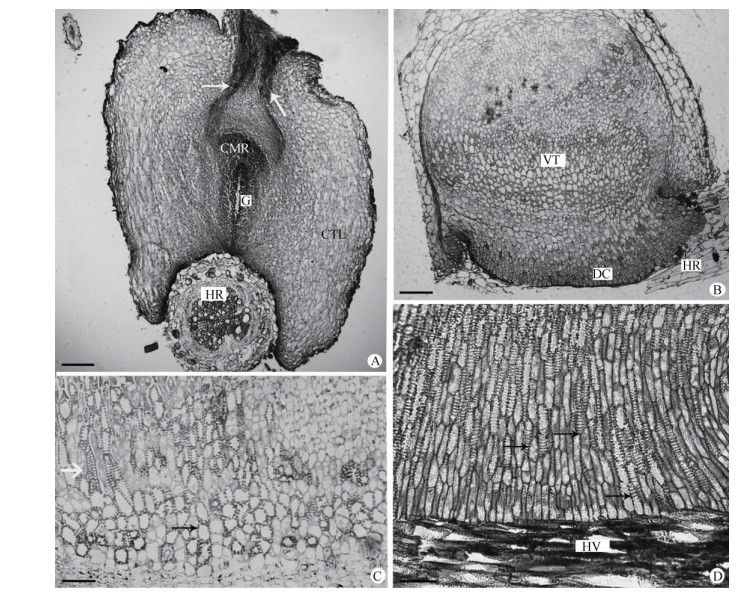
|
图 2 维管组织侵入寄主根。A:吸器与寄主根表皮接触时期 (石蜡切片),示中心分生区 (CMR)、吸器皮层 (CTL)、寄主根 (HR) 和内部腺体结构 (G),吸器的维管组织还处于基部 (白色箭头); B:檀香吸器和寄主根的纵切面 (半薄切片),示维管组织 (VT)、指状细胞 (DC) 和寄主根 (HR); C:半薄切片, 示具梯纹加厚的导管分子 (箭头); D:半薄切片,示吸器与寄主根维管组织 (HV) 连接的管胞 (箭头)。标尺: A=0.2 mm; B, D=0.1 mm; C=0.05 mm Fig. 2 Vascular tissue invade into host root. A: Young haustorium contact host root (paraffin section), showing core meristematic region (CMR), cortical layers (CTL), host root (HR) and inside gland structure (G), and vascular tissue at base of haustorium (white arrows); B: Longitudinal section (semithin section) of host root and haustorium, showing vascular tissue (VT), digitate cells (DC) and host root (HR); C: Semithin section, showing scalariform vessel elements (arrow); D: Semithin section, showing tracheid (arrows) joint vascular tissues of host (HV) and haustorium. Bars: A=0.2 mm; B, D=0.1 mm; C=0.05 mm |
当吸器侵入寄主后,吸器的腺体前端中间开始出现侵入组织,前端由指状细胞构成,直接作用于寄主根的皮层 (图 2: B)。中心分生区细胞保持强烈分生能力,分化出维管组织 (图 2: B, C)。
当吸器接触到寄主根的维管组织,在接触面上分化出维管组织直接与寄主根维管组织相连 (图 2: D), 吸器的维管组织由导管组成,细胞壁具有梯纹加厚。
2.3 成熟吸器的维管组织形态吸器的维管组织连通寄主维管组织后,吸器的侵入组织侵入寄主根皮层形成吸管,吸管中心具有两束维管组织直接连通檀香与寄主根的维管组织, 形成具有吸收功能的吸器 (图 3: A)。吸器的维管组织呈典型倒烧瓶结构,维管束位于中部薄壁组织中心的外围,皮层和坍塌层的内侧。电镜下观察,相邻横向排列的导管分子间具有纹孔对,但无直接的连通,而纵向连接的导管存在穿孔,直接连通。

|
图 3 成熟吸器的结构。A:石蜡切片,示皮层 (CTL)、坍塌层 (CL)、中部薄壁组织中心 (CPC)、倒烧瓶维管组织 (箭头)、寄主根维管组织 (HV)、吸管 (S); B: TEM下的导管分子 (VE) 间的纹孔对 (黑箭头) 和穿孔 (白箭头); C:成熟吸器呈烧瓶结构 (半薄切片),示皮层 (CTL)、坍塌层 (CL)、导管分子 (箭头); D: TEM下的成熟期导管分子 (吸器横切面),示导管分子 (VE)、纹孔对 (白箭头) 及邻近导管分子的分生细胞 (MC)。标尺: A, C=50 μm; B=2 μm; D=5 μm Fig. 3 Structure of mature haustorium of Santalum album. A: Paraffin section, showing cortical layer (CTL), collapsed layer (CL), central parenchymatous core (CPC), host vascular tissue (HV), inverted flask-shaped vascular tissue (arrows) and the sucker (S); B: Pit pair (blank arrow) and perforation (white arrow) between vessel elements (VE) under TEM; C: Inverted flask-shaped haustorium (semithin section), showing cortical layers (CTL), collapsed layers (CL), xylem elements (arrows); D: Mature vessel element (VE) under TEM, showing VE, pit pair (white arrow) and meristematic cell (MC) near vessel element. Bars: A, C=50 μm; B=2 μm; D=5 μm |
在檀香吸器维管组织的生长区域不呈完整圆形,位于中部薄壁组织中心两边,皮层和坍塌层内侧;维管束周围的薄壁分生细胞染色明显加深,维管束由4~8个导管分子组成,无筛管分子 (图 3: B)。电镜下也观察到与导管相邻、即将形成导管的细胞,其细胞壁已明显加厚,内含物正在降解 (图 3: C)。
3 讨论 3.1 吸器维管组织的发育过程尽管前人对檀香成熟吸器结构的研究较为详尽,其维管组织呈烧瓶状,连通檀香根与寄主根[1-3], 却无直接的证据 (图片或数据) 来支持和说明吸器维管组织的发育过程和结构,特别是对维管组织的前期发生缺乏相关的研究。檀香的寄主范围广, 固定寄主便于其吸器早期发育样品的采集和研究[3], 国内檀香幼苗市场主要以假蒿为寄主,近期也常以假蒿为固定寄主进行檀香吸器的研究[5-7], 所以本研究以假蒿为固定寄主进行研究。
檀香吸器维管组织的分化可分为两个时期:入侵前和入侵后。维管组织的发育始于侵入前的盘状吸器时期,起源于吸器基部具有分生能力的细胞, 后分成两束,向两边分化,但侵入之前无向顶的分化。侵入后向寄主方向生长分化,随吸管侵入寄主根与寄主根维管组织连通形成具有传输功能的维管组织。
Heidejorgensen等在直果草属 (Triphysaria) 吸器与寄主的接触面上观察到数个单独存在的导管分子,认为吸器的木质部维管组织的分化开始于接触面,然后向寄主植物方向分化,这种分化方式为向基分化模式 (Basipetal differentiation pattern)[8]。而Weber则认为Pedicularis sylvatica吸器的维管组织分化为自下而上的向顶分化模式 (Acropetal differen-tiation pattern)[9]。我们的研究表明,檀香维管组织的发生和后期发育属于向顶分化模式,这与P. sylvatica的相同。我们赞同Heidejorgensen等的观点[10],认为仅观察到吸器与寄主接触面上有少数不连续的维管束而断定维管组织的分化为向基分化模式是不够全面的。
3.2 吸器维管组织的起源Rao认为幼嫩吸器会出现维管组织分化,但无具体的分化时期和起源细胞[3]。在本研究中,我们观察到檀香吸器的维管组织分化开始于幼嫩盘状吸器时期,来源于吸器基部具有分生能力的细胞。Musselman等认为吸器侵入后才会产生轴向维管 (Axial strands) 的分化[11]。而我们观察到侵入前的吸器在产生内部腺体时期和幼嫩时期都有维管组织轴向的分化,只是这种分化保持在吸器基部。
3.3 吸器维管组织发育的诱导因素我们认为吸器维管组织发育的诱导因素应该有两个方面:侵入前因素和侵入后因素。檀香吸器侵入寄主根之前,吸器未接触寄主根,吸器发生是自我遗传因素控制的。有研究也指出吸器的发生与外界因素无关[3]。本研究结果表明,在幼嫩吸器时期和吸器内部产生腺体时期都发生了维管组织的轴向分化,只是未进一步向顶分化,所以吸器维管组织的诱导和轴向分化是由檀香自身因素控制。
有研究表明根系分泌物启动并参与植物间的相互作用[12],同时寄主根系分泌物对寄生植物吸器发育有一定影响[13]。本研究观察到檀香吸附寄主后产生内部腺体时期不存在维管组织的向顶分化,即向寄主方向分化,只有檀香侵入寄主后才会产生吸器的进一步分化,因此我们认为檀香吸器维管组织的进一步分化依赖于寄主,可能受寄主某种物质或者信号的诱导。这种诱导在腺体时期不存在,推测这种物质或信号与寄主根的根系表皮及其分泌物无关,而应该与寄主根皮层或者是维管束相关。
3.4 成熟吸器倒烧瓶维管组织特征寄生植物与寄主之间木质部导管的连接几乎是所有寄生被子植物吸器的普遍特征[14-17]。然而也有些寄生植物吸器无导管存在,如Striga-Triphysaria在寄生植物-寄主接触面完全无导管分子[11];在Castilleja吸器中似乎也看不到木质部[14];在Pedicularis吸器中偶尔可见孤立的木质部导管分子,但是靠近寄主细胞未见木质部维管束[14],同样的现象也见于Triphysaria吸器中[8]。
有研究指出檀香成熟吸器的维管组织呈倒烧瓶结构[1-3]。本研究结果与其相同,同时我们还观察到成熟吸器维管组织只处于吸器中部薄壁组织区的两边,未完全包裹中部薄壁组织。
檀香吸器的主要功能就是从寄主吸收水分和无机盐[18]。本研究表明在檀香吸器与寄主的接触面上存在两者木质部-木质部的连接,而不存在韧皮部-韧皮部的连接, 这从形态上说明檀香吸器从寄主中吸收的主要是水分和无机盐而非有机物。
| [1] | BARBER C A. Studies in root-parasitism:The haustorium of Santalum album, Ⅰ. Early stages, up to penetration[J]. Mem Dep Agri Ind Bot Ser, 1906, 1: 1-30. |
| [2] | BARBER C A. Studies in root-parasitism:The haustorium of Santalum album, Ⅱ. The structure of the mature haustorium and the interrelations between host and parasite[J]. Mem Dep Agri Ind Bot Ser, 1907, 2: 1-58. |
| [3] | RAO L N. Parasitism in the Santalaceae[J]. Ann Bot, 1942, 6(21): 131-150. |
| [4] | TENNAKOON K U, CAMERON D D. The anatomy of Santalum album (Sandalwood) haustoria[J]. Can J Bot, 2006, 84(10): 1608-1616. DOI:10.1139/b06-118 |
| [5] | ZHANG X H, DA SILVA J A T, DUAN J, et al. Endogenous hormone levels and anatomical characters of haustoria in Santalum album L. seedlings before and after attachment to the host[J]. J Plant Physiol, 2012, 169(9): 859-866. DOI:10.1016/j.jplph.2012.02.010 |
| [6] | YANG X, ZHANG X, DA SILVA J A T, et al. Ontogenesis of the collapsed layer during haustorium development in the root hemi-parasite Santalum album Linn[J]. Plant Biol, 2014, 16(1): 282-290. DOI:10.1111/plb.12026 |
| [7] | OUYANG Y, ZHANG X H, CHEN Y L, et al. Growth, photosynthesis and haustorial development of semiparasitic Santalum album L. penetrating into roots of three hosts:A comparative study[J]. Trees, 2015, 30(1): 317-328. DOI:10.1007/s00468-015-1303-3 |
| [8] | HEIDE-JØRGENSEN H S, KUIJT J. Epidermal derivatives as xylem elements and transfer cells:A study of the host-parasite interface in two species of Triphysaria (Scrophulariaceae)[J]. Protoplasma, 1993, 174(3/4): 173-183. DOI:10.1007/BF01379049 |
| [9] | WEBER H C. Anatomy of haustoria in some central european parasitic Scrophulariaceae[J]. Berichte der Deutschen Botanischen Gesellschaft, 1976, 9(1): 57-84. |
| [10] | HEIDE-JØRGENSEN H S, KUIJT J. The haustorium of the root parasite Triphysaria (Scrophulariaceae), with special reference to xylem bridge ultrastructure[J]. Amer J Bot, 1995, 82(6): 782-797. DOI:10.2307/2445619 |
| [11] | MUSSELMAN L J, DICKISON W C. The structure and development of the haustorium in parasitic Scrophulariaceae[J]. Bot J Linn Soc, 1975, 70(3): 183-212. DOI:10.1111/j.1095-8339.1975.tb01645.x |
| [12] | BAIS H P, WEIR T L, PERRY L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annu Rev Plant Biol, 2006, 57(1): 233-266. DOI:10.1146/annurev.arplant.57.032905.105159 |
| [13] | TOMILOV A A, TOMILOVA N B, ABDALLAH I, et al. Localized hormone fluxes and early haustorium development in the hemiparasitic plant Triphysaria versicolor[J]. Plant Physiol, 2005, 138(3): 1469-1480. DOI:10.1104/pp.104.057836 |
| [14] | DOBBIN D R, KUIJT J. Anatomy and fine structure of the mistletoe haustorium (Phthirusa pyrifolia):Ⅰ. Development of the young haustorium[J]. Amer J Bot, 1974, 61(5): 535-543. DOI:10.2307/2442024 |
| [15] | KUIJT J, TOTH R. Ultrastructure of angiosperm haustoria:A review[J]. Ann Bot, 1976, 40(6): 1121-1130. DOI:10.1093/oxfordjournals.aob.a085232 |
| [16] | TOTH R, KUIJT J. Anatomy and ultrastructure of the young haustorial gland in Comandra (Santalaceae)[J]. Can J Bot, 1976, 54(20): 2315-2327. DOI:10.1139/b76-248 |
| [17] | TOTH R, KUIJT J. Cytochemical localization of acid phosphatase in endophyte cells of the semiparasitic angiosperm Comandra umbellata (Santalaceae)[J]. Can J Bot, 1977, 55(4): 470-475. DOI:10.1139/b77-056 |
| [18] | TENNAKOON K U, PATE J S, STEWART G R. Haustorium-related uptake and metabolism of host xylem solutes by the root hemiparasitic shrub Santalum acuminatum (R. Br.) A. DC. (Santalaceae)[[J]. Ann Bot, 1997, 80(3): 257-264. DOI:10.1006/anbo.1997.0433 |
 2017, Vol. 25
2017, Vol. 25


