2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 10039, China
檀香 (Santalum album L.) 是檀香科 (Santalaceae) 檀香属的一种常绿半寄生小乔木[1],又名白檀,原产于印度尼西亚的帝汶岛 (Timor),后来被引种到印度并得到大面积扩展[2]。它是一种重要的经济树木,主要价值是具有芳香气味的心材和从心材提取的精油[3],可用于雕刻、香料、香水和药品等[4]。但是, 由于病虫害和过度开采,檀香的自然资源遭到了严重的破坏,1998年,檀香被世界自然保护联盟 (IUCN) 列入《世界自然保护联盟受威胁植物红色名录》。檀香形成心材俗称“结香”[5], 挥发油是其主要活性成分,主要为萜烯类化合物[6],如α-檀香醇 (40%~55%)、β-檀香醇 (12%~27%)[7]、α-反式-香柠檬醇、β-顺式-檀香醇等[8],以及 (+)-α-檀香烯、(-)-β-檀香烯、(-)-α-香柠檬烯、(+)-β-檀香烯和β-甜没药烯等倍半萜烯[9]。自然条件下,檀香约在10龄时才开始形成具有芳香气味的心材[10]。研究表明,利用激素如乙烯利、6-苄氨基腺嘌呤等处理未结香幼龄檀香,可显著提高注射部位周围的檀香油含量[11-13]。目前关于激素促进檀香结香即檀香萜类化合物形成的分子机理还不清楚,因此,亟需阐明激素诱导檀香萜类化合物生成的代谢通路,为研究人工促进檀香心材形成的技术或种植方案做准备,最终实现缩短檀香人工林种植周期、提高心材产量和质量的目的, 从而保护檀香资源,满足市场需求。通过提取RNA获取特异表达基因是功能基因组研究的重要方法, 从植物组织中提取纯度高、完整性好的RNA是顺利进行Northern杂交分析,纯化mRNA以用于体外翻译或建立cDNA文库,RT-PCR以及差示分析等分子生物学研究的关键所在[14]。目前提取RNA的方法很多种,但不同植物或同种植物不同组织所含的成分,如多糖、多酚等有很大差异,其RNA提取方法必须通过实验才能确定,目前还未见关于檀香心材总RNA提取方法的报道, 因此,我们通过比较Trizol法[15]、改良CTAB法[16]、SDS酸酚法[17]、异硫氰酸胍-CTAB法[18]和异硫氰酸胍-SDS法[19], 以筛选并确定檀香心材总RNA提取的最佳方法, 为檀香油合成酶基因的表达、调控及其相关的分子生物学研究提供技术手段。
1 材料和方法 1.1 材料檀香心材于2015年12月取自广东东莞金娃蛙檀香种植基地,选取6-BA处理1年的6龄檀香树,用内径为5.15 mm的生长锥从距离地面30 cm处钻取心材 (图 1),心材为浅黄色至深黄色,边材为白色,边材与心材可以直接用肉眼进行区分,用已灭菌的手术刀直接切取浅黄色至深黄色部分用锡箔纸包裹后立即放入干冰速冻,带回实验室保存于-70℃冰箱备用。

|
图 1 生长锥钻取的檀香茎干 Fig. 1 Stem of sandalwood drilled by increment borer |
Trizol购自Invitrogen公司;Dnase I、Rnase抑制剂、RT-PCR试剂盒、Taq DNA聚合酶 (5 U μL-1)、Mg2+ (25 mmol L-1)、dNTPs (2.5 mmol L-1)、DL2000 Marker等购自TaKaRa公司;Actin引物由华大基因合成;其它化学试剂为分析纯产品,购自广州化学试剂公司。
试验所用手术刀、研钵、药匙、镊子、试剂瓶等器材均在180℃下烘4 h以上,所有试剂及一次性塑料耗材均经过0.1% (W/V) DEPC (焦碳酸二乙酯) 水处理,121℃高压灭菌30 min后备用。
1.3 檀香心材总RNA的提取Trizol试剂法 参照TRIzol试剂盒说明书进行提取。
改良CTAB法 参照Chang[16]等的方法并适当修改。取檀香心材0.5 g,液氮中研磨成粉末后转入无RNase离心管中,迅速加入1 mL 65℃预热的CTAB提取缓冲液[2% CTAB (W/V), 2% PVPP (W/V), 2 mol L-1 NaCl, 0.1 mol L-1 Tris-HCl (pH=8.0), 0.025 mol L-1 EDTA (pH=8.0)]和25 μL β-巯基乙醇,剧烈振荡混匀后65℃水浴60 min,期间上下颠倒混匀几次,于4℃下13680×g离心10 min;取上清,加入等体积水饱和酚/氯仿/异戊醇 (25:24:1) 振荡混匀,于4℃下13680×g离心10 min; 取上清,加入等体积氯仿/异戊醇 (24:1),振荡混匀,于4℃下13680×g离心10 min;取上清,加入0.9体积预冷的异丙醇和0.1体积的3 mol L-1的醋酸钠 (pH=5.2),-20℃沉淀2 h;于4℃下13680×g离心15 min;弃上清,沉淀用500 μL SDS缓冲液Ⅰ[0.5% SDS, 1 mol L-1 NaCl, 0.01 mol L-1 Tris-HCl (pH=8.0), 0.001 mol L-1 EDTA (pH=8.0)]溶解后加入等体积氯仿,振荡混匀并在4℃下13680×g离心10 min; 取上清,加入2倍体积无水乙醇,-20℃沉淀1 h, 在4℃下13680×g离心15 min;弃上清, 沉淀用1 mL 70%酒精漂洗2次,于4℃下13680×g离心5 min; 尽量去除酒精,风干后,RNA用适量DEPC水溶解 (30μL),-70℃贮存备用。
SDS酸酚法 参照Duan[17]等的方法并适当修改。取檀香心材0.1 g,液氮中研磨成粉末后转入无RNase离心管中,迅速加入600 μL SDS酸酚提取缓冲液[0.1 mol L-1 Tris-HCl (pH=8.0),0.4 mol L-1 NaCl,0.2% SDS,2% β-巯基乙醇 (V/V)],涡旋震荡混匀后再加入200 μL水饱和酚和200 μL氯仿, 震荡至彻底混匀,冰上平放静置15 min;于4℃下13680×g离心10 min,取上清,加入等体积的氯仿,震荡混匀,于4℃下13680×g离心10 min,取上清,加入等体积的异丙醇,温和混匀后,-20℃放置1 h,于4℃下13680×g离心10 min;小心倒掉上清,沉淀漂洗方法同改良CTAB法。
异硫氰酸胍-CTAB法 参照吴宏清等[18]的方法并适当修改。取檀香心材0.1 g,液氮中研磨成粉末后迅速转入含有600 μL异硫氰酸胍-CTAB提取液[38%水饱和酚,1 mol L-1异硫氰酸胍,2% CTAB (W/V),2% PVPP (W/V),2 mol L-1 NaCl, 0.l mol L-1 NaAc-Hac (pH=5.2),1% β-巯基乙醇 (V/V)]的离心管中,剧烈震荡,室温静置15 min; 加入等体积的水饱和酚/氯仿/异戊醇 (25:24:1),震荡混匀,于4℃下13680×g离心10 min;取上清, 加入等体积的水饱和酚/氯仿/异戊醇 (25:24:1), 震荡混匀,于4℃下13680×g离心10 min;取上清,加入等体积的氯仿/异戊醇 (24:1),于4℃下13680×g离心10 min;取上清,加入0.5倍体积无水乙醇和等体积4 mol L-1 LiCl,颠倒混匀,-20 ℃静置4 h或过夜,于4℃下13680×g离心10 min; 弃上清,沉淀沉淀漂洗方法同改良CTAB法。
异硫氰酸胍-SDS法 参照高志晖等[19]等的方法并适当修改。取0.5 g样品放入液氮预冷的研钵中液氮研磨,迅速分装到含有1 mL异硫氰酸胍-SDS提取缓冲液[4 mol L-1异硫氰酸胍,0.002 mol L-1 Tris-HCl (pH=8.0),1% β-巯基乙醇 (V/V)]的离心管中,颠倒混匀,冰上放置15 min,于4℃下13680×g离心20 min;取上清,加入0.03倍体积的3 mol L-1的醋酸钠 (pH=5.2) 和2.5倍体积的无水乙醇,颠倒混匀,-20℃沉淀至少2 h;于4℃下13680×g离心20 min,弃上清,加入10 mL SDS缓冲液Ⅱ[0.2% SDS,0.1 mol L-1 NaCl,0.05 mol L-1 Tris-HCl (pH=8.0),0.01 mol L-1 EDTA (pH=8.0)],振荡混匀,加入等体积的水饱和酚/氯仿/异戊醇 (25:24:1),充分混匀,于4℃下13680×g离心15 min;将水相转入新离心管中,加入等体积氯仿,振荡数秒混匀, 于4℃下13680×g离心10 min;将水相转入新离心管,加入等体积的异丙醇和0.5体积的5 mol L-1的NaCl, -20℃放置2 h;于4℃下13680×g离心20 min,弃上清,沉淀漂洗方法同改良CTAB法。
1.4 RNA浓度与质量的检测5种方法提取的RNA分别取1 μL用灭菌的DEPC水稀释10倍后,用Nano Drop 2000/2000C核酸蛋白检测仪检测RNA浓度与纯度,记录A260 nm/A280 nm、A260 nm/A230 nm以及浓度,并计算产率。RNA产率 (μg g-1)=RNA浓度 (μg μL-1)×稀释倍数×原液体积 (μL)/样品质量 (g)。每种方法提取的RNA样品重复检测3次,取平均值。试验数据用SPSS 20.0分析软件进行分析。
取5 μL RNA,与上样缓冲液混合后上样于1%琼脂糖凝胶中,用120 V电压电泳15 min,用凝胶成像系统观察电泳条带并拍照。
1.5 RT-PCR检测以改良CTAB法、异硫氰酸胍-SDS法提取的总RNA,参照TaKaRa公司M-MLV反转录说明书进行反转录合成cDNA,以合成cDNA为模板,根据檀香Actin基因 (GI: 156972025) 设计引物进行扩增。正向引物:5′-GGATTCTGGAGATGGTGTTAG-T-3′;反向引物:5′-CGGTGATTTCCTTGCTCATT-C-3′。20 μL扩增体系为:ddH2O 12.8 μL,10×PCR buffer 2 μL,2.5 mmol L-1 dNTP 2 μL,10 μmol L-1正向引物1 μL,10 μmol L-1反向引物1 μL,5 U μL-1 TaqDNA聚合酶0.2 μL,cDNA 1 μL。扩增程序为94℃预变性3 min;然后94℃变性30 s,55℃复性30 s,72℃延伸1 min,共30次循环;72℃延伸10 min。反应完成后,取9 μL反应产物,与上样缓冲液混合后上样于1%琼脂糖凝胶,用140 V电压电泳20 min, 用凝胶成像系统观察电泳条带并拍照。
2 结果和分析 2.1 RNA完整性检测凝胶电泳分析是检验RNA质量的一种重要手段,从凝胶图像上可以判断所得的RNA的完整性和降解程度。由图 2可以看出,Trizol法、异硫氰酸胍-CTAB法提取的RNA无28S rRNA、18S rRNA条带,说明这两种方法不能提取出檀香心材RNA; SDS酸酚法提取的RNA,有3条5S rRNA、18S rRNA、28S rRNA带,但荧光亮度相近且较弱,存在拖尾现象,表明RNA浓度低且严重降解;改良CTAB法和异硫氰酸胍-SDS法提取的RNA能看见清晰的3条带,28S rRNA和18S rRNA的荧光亮度接近2:1,5S rRNA条带相对较弱,条带清晰无弥散现象,说明RNA的完整性较好,未发生降解, 改良CTAB法提取的RNA条带荧光亮度弱于异硫氰酸胍-SDS法的。

|
图 2 5种方法提取檀香心材RNA的电泳图。1, 2: Trizol法; 3, 4: SDS酸酚法; 5, 6:改良CTAB法; 7, 8:异硫氰酸胍-CTAB法; 9, 10:异硫氰酸胍-SDS法。 Fig. 2 Electrophoresis diagram of total RNA extract from heartwood of Santalum albumby five methods. 1, 2: Trizol method; 3, 4: SDS-phenol method; 5, 6: Improved CTAB method; 7, 8: Guanidine isothiocyanate-CTAB method; 9, 10: Guanidine isothiocyanate-SDS method. |
高纯度的RNA的A260 nm/A280 nm应介于1.8~2.0之间,A260 nm/A230 nm应大于2.0。从表 1可以看出, 改良CTAB法、异硫氰酸胍-SDS法提取的RNA, 其A260 nm/A280 nm介于1.8~2.0之间,A260 nm/A230 nm大于2.0,产率分别为 (79.06±4.22) μg g-1和 (107.00±1.36) μg g-1,说明改良CTAB法和异硫氰酸胍-SDS法提取的RNA样品中没有蛋白质、酚酚类物质和糖类、盐离子以及有机溶剂等其他杂质残余,且产量足够应用于后续研究;SDS酸酚法提取的RNA,其A260nm/A280 nm介于1.8~2.0之间,但是A260nm/A230 nm小于2.0,且产率低,仅为 (27.94±1.06) μg g-1,表明RNA样品中有抽提试剂, 如异硫氰酸胍、β-巯基乙醇等, 以及糖类和盐离子等的残留。而Trizol法、异硫氰酸胍-CTAB法提取的RNA, A260nm/A280 nm、A260 nm/A230 nm均小于1.8和2.0,产率低,说明受到蛋白质、酚类、异硫氰酸胍和β-巯基乙醇等杂质污染严重。
| 表 1 不同方法提取檀香心材总RNA的结果比较 Table 1 Comparison of total RNA from heartwood of Santalum albumby different methods |
用改良CTAB法、异硫氰酸胍-SDS法提取的檀香心材总RNA经反转录后,用PCR扩增Actin基因片段,以进一步检测所提取的RNA是否可以用于后续研究。从图 3可见,两种方法均可扩增出约495 bp大小的单一产物,带型清晰,说明改良CTAB法与异硫氰酸胍-SDS法提取的RNA均能用于RT-PCR反应等以RNA为基础的研究分析。
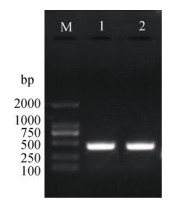
|
图 3 檀香心材总RNA的RT-PCR结果。M: DL2000 Marker; 1:改良CTAB法; 2:异硫氰酸胍-SDS法。 Fig. 3 RT-PCR for total RNA extraction from heartwood of Santalum album. M: DL2000 Marker; 1: Improved CTAB method; 2: Guanidine isothio-cyanate-SDS method. |
檀香心材细胞同其它木本植物细胞一样,具有坚硬的细胞壁,破碎困难,富含单宁、萜类、酚类等多种次生代谢物质以及蛋白质和多糖等有机大分子[20],其RNA的提取变得十分困难。抑制RNA酶活性、尽可能去除DNA、蛋白质和次生代谢物质等是提取完整性好、浓度高RNA的关键所在。异硫氰酸胍是一种强RNA酶抑制剂[21],能裂解细胞并释放核酸,CTAB是一种阳离子去污剂,较高浓度的CTAB不仅可以裂解植物细胞,而且还能有效分离核蛋白与核酸,同时与β-巯基乙醇共同作用抑制RNase活性,而SDS是一种阴离子去污剂,可以解离核蛋白与核酸,同时抑制RNA酶和DNA酶活性。许多植物组织用一种裂解剂即可成功提取高质量的RNA,如葡萄 (Vitis vinifera) 成熟叶片[22]等。由于檀香心材含有大量的次生代谢物质,用单一的裂解液、一次沉淀的方法, 如Trizol法、异硫氰酸胍-CTAB法和SDS酸酚法, 不能提取出完整性好、纯度和浓度高的RNA。而异硫氰酸胍与SDS或CTAB相结合,沉淀两次,可以大大提高RNA的纯度及浓度。此外,沉淀用1 mL 70%乙醇洗两次, 可以降低盐类物质及缓冲液的残留。
综上所述,改良CTAB法、异硫氰酸胍-SDS法能有效从檀香心材中提取纯度较高、完整性较好的RNA。经紫外光谱分析A260 nm/A280 nm为2.0左右,A260 nm/A230 nm大于2.0,电泳28S、18S条带清晰。该法可以有效去除蛋白质、多糖和其它次生代谢物质等杂质,RT-PCR结果表明,改良CTAB法、异硫氰酸胍-SDS法提取的总RNA纯化后可用于檀香基因克隆等后续的分子生物学实验。
| [1] |
Delectis Flora Reipublicae Popularis Sinicae Agendae Academiae Sinicae Edita.
Flora Reipublicae Popularis Sinicae, Tomus 24[M]. Beijing: Science Press, 1988: 57.
中国科学院中国植物志编辑委员会. 中国植物志, 第24卷[M]. 北京: 科学出版社, 1988: 57. |
| [2] |
State Administration of Traditional Chinese Medicine.
Chinese Material Medica, Vol. 1[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1996: 1-318.
国家中医药管理局. 中华本草 (上册)[M]. 上海: 上海科学技术出版社, 1996: 1-318. |
| [3] | BARRETT D R, FOX J E D. Early growth of Santalum album in relation to shade[J]. Aust J Bot, 1994, 42(1): 83-93. DOI:10.1071/BT9940083 |
| [4] | YANG X Y, ZHANG X H, da SILVA J A T, et al. Ontogenesis of the collapsed layer during haustorium development in the root hemi-parasite Santalum album Linn[J]. Plant Biol, 2014, 16(1): 282-290. DOI:10.1111/plb.12026 |
| [5] |
LI Y L.
Research on Introduction of Sandalwood[M]. Beijing: Science Press, 2003: 1-154.
李应兰. 檀香引种研究[M]. 北京: 科学出版社, 2003: 1-154. |
| [6] | RANI A, RAVIKUMAR P, REDDY M D, et al. Molecular regulation of santalol biosynthesis in Santalum album L[J]. Gene, 2013, 527(2): 642-648. DOI:10.1016/j.gene.2013.06.080 |
| [7] | VERGHESE J, SUNNY T P, BALAKRISHNAN K V. (+)-α-Santalol and (-)-β-santalol (Z) concentration, a new quality determinant of east Indian sandalwood oil[J]. Flavour Frag J, 1990, 5(4): 223-226. DOI:10.1002/ffj.2730050407 |
| [8] | HOWES M J R, SIMMONDS M S J, KITE G C. Evaluation of the quality of sandalwood essential oils by gas chromatography-mass spectrometry[J]. J Chromatogr A, 2004, 1028(2): 307-312. DOI:10.1016/j.chroma.2003.11.093 |
| [9] | JONES C G, GHISALBERTI E L, PLUMMER J A, et al. Quantitative co-occurrence of sesquiterpenes; a tool for elucidating their biosynthesis in Indian sandalwood, Santalum album[J]. Phytochemistry, 2006, 67(22): 2463-2468. DOI:10.1016/j.phytochem.2006.09.013 |
| [10] | JONES C G, PLUMMER J A, BARBOUR E L. Non-destructive sampling of Indian sandalwood (Santalum album L.) for oil content and composition[J]. J Essent Oil Res, 2007, 19(2): 157-164. DOI:10.1080/10412905.2007.9699250 |
| [11] |
LIU X J, XU D P, YANG Z J, et al. Effects of plant growth regulators on growth, heartwood formation and oil composition of young Santalum album[J].
Sci Silv Sin, 2013, 49(7): 143-149. 刘小金, 徐大平, 杨曾奖, 等. 几种生长调节剂对幼龄檀香生长、心材形成和精油成分的影响[J]. 林业科学, 2013, 49(7): 143-149. DOI:10.11707/j.1001-7488.20130721 |
| [12] |
LI Y L, CHEN F L. Studies on forcing heartwood formation in Santalum album[J].
J Trop Subtrop Bot, 1994, 2(3): 39-45. 李应兰, 陈福莲. 人工促成檀香结香的研究[J]. 热带亚热带植物学报, 1994, 2(3): 39-45. |
| [13] |
LIN L, WEI M, XIAO S E, et al. The influence of external stimulation on content and quality of volatile oil in Lignun Santali Albi[J].
J Chin Med Mat, 2000, 23(3): 152-154. 林励, 魏敏, 肖省娥, 等. 外界刺激对檀香挥发油含量及质量的影响[J]. 中药材, 2000, 23(3): 152-154. DOI:10.3321/j.issn:1001-4454.2000.03.013 |
| [14] |
LI H, WANG X L. The difficulties in the isolation of RNA from plant tissues and their resolving strategies[J].
Biotechn Inform, 1999(1): 36-39. 李宏, 王新力. 植物组织RNA提取的难点及对策[J]. 生物技术通报, 1999(1): 36-39. DOI:10.3969/j.issn.1002-5464.1999.01.008 |
| [15] | SIMMS D, CIZDZIEL P E, CHOMCZYNSKI P. TRIZOLTM:A new reagent for optimal single-step isolation of RNA[J]. Focus, 1993, 15(4): 99-102. |
| [16] | CHANG S, PURYEAR J, CAIRNEY J. A simple and efficient method for isolating RNA from pine trees[J]. Plant Mol Biol Rep, 1993, 11(2): 113-116. DOI:10.1007/BF02670468 |
| [17] | DUAN J B, CAI X, ZHOU L M, et al. Single-step method of total RNA isolation by sodium dodecyl sulfate/phenol extraction from cultured cells[J]. Anal Biochem, 1997, 251(2): 291-292. DOI:10.1006/abio.1997.2275 |
| [18] |
WU H Q, WANG L, TAO M H, et al. Transcriptome library construction and sequencing from chemically induced Aquilaria sinensis[J].
Biotechn Bull, 2013(8): 63-67. 吴宏清, 王磊, 陶美华, 等. 化学诱导后白木香转录组文库的构建与测序[J]. 生物技术通报, 2013(8): 63-67. |
| [19] |
GAO Z H, WEI J H, XIONG H Y, et al. Comparison of several methods for RNA extraction from stems of Aquilaria sinensis[J].
Lett Biotechn, 2012, 23(5): 718-721. 高志晖, 魏建和, 熊换英, 等. 几种提取白木香茎干总RNA方法的比较[J]. 生物技术通讯, 2012, 23(5): 718-721. DOI:10.3969/j.issn.1009-0002.2012.05.023 |
| [20] | WILKINS T A, SMART L B. Isolation of RNA from plant tissue[M]//KRIEG P A. A Laboratory Guide to RNA:Isolation, Analysis, and Synthesis. New York:Wiley-Liss, 1996:21-42. |
| [21] | CHOMCZYNSKI P, SACCHI N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction[J]. Anal Biochem, 1987, 162(1): 156-159. DOI:10.1016/0003-2697(87)90021-2 |
| [22] |
ZHANG J J, WANG Y J, WANG X P, et al. An improved method for rapidly extracting total RNA from Vitis[J].
J Fruit Sci, 2003, 20(3): 178-181. 张今今, 王跃进, 王西平, 等. 葡萄总RNA提取方法的研究[J]. 果树学报, 2003, 20(3): 178-181. DOI:10.3969/j.issn.1009-9980.2003.03.006 |
 2017, Vol. 25
2017, Vol. 25


