消落带 (Hydro-fluctuation belt) 又称消落区 (Water level fluctuation zone),是河流、湖泊、水库特有的一个地带,因季节性水位涨落或周期性蓄水而出现的反复淹没和裸露的带状性区域,由陆地和水域两种环境构成的特殊季节性湿地生态区[1]。冷水河自然保护区从长征电站大坝沿河及支流而上,河谷两岸水平距离1.5 km,推进20 km,总面积28.3 km2,河流河床深陷,底部宽20~50 m,上部宽300~500 m。河谷面积17 hm2。每年4-5月进入涨水期,降水量和降水强度都明显增强,水位可上涨达10 m以上。而7-8月进入枯水期,水位下降显著,水位可下降达50 cm以下[2]。由于消落带季节性的水位变化, 该区植物的生长频繁受到水淹的干扰,导致大部分植物因不适应而逐渐消亡,从而引起该区消落带的生物多样性减少,水土流失,生态系统更为脆弱等问题出现[3]。冷水河自然保护区消落带植被的生态保护将为提高消落带生物多样性,减少水土流失等具有重要作用。为此,开展物种的适应机理研究具有重要的意义[4]。
根据实地考察消落带区有大量水生苔藓植物生长,在各种水域或沼泽中,水生苔藓植物有的漂浮水面、有的固着于水底或岸边石上或泥土上,起着保持水土、提高生物多样性和美化景观的重要作用[5-6]。目前对苔藓植物及其耐受性的研究较多[7-12],而针对消落带植物水淹耐受机理的研究主要集中在乔木和草本上[13],然而有关消落带水生苔藓植物对水淹适应机理和耐水淹能力的研究尚未见报道。为此,我们于2015年8月3-12日对贵州省金沙县冷水河自然保护区消落带进行为期10 d的深入考察,筛选出了5种优势种 (平均优势度≥0.02)。通过模拟水淹试验,研究了5种水生苔藓植物对水淹的适应能力及其机理,同时对5种水生苔藓植物耐水淹能力进行综合评价,以期为冷水河消落带植被恢复和重建提供科学依据。
1 研究地点和方法 1.1 研究地点冷水河自然保护区位于金沙县西北部,地理坐标为105°57′31"~106°04′16" E,27°34′43"~27°26′ 22" N,以喀斯特地貌为主,海拔700~1700 m,河谷两岸地形陡峻,峡谷深陷。河谷内气候温暖潮湿,冬季无冻雨,1月平均气温3.6℃~6℃,7月平均气温24.3℃~27℃,年平均降水量1136 mm[2]。天然的沟谷环境及水位季节性的涨落,形成明显的消落带,为研究消落带地区的苔藓植物及季节性水淹对苔藓植物的生长的影响提供了良好的基础。根据冷水河自然保护区的河流概况,选取6个地区 (深沟下段、长征水库段、冷水河下段、田沟段、冷水河中段和深沟上段) 消落带作为研究地,
1.2 取样和数据收集方法及5种水生苔藓植物水淹处理采用样方法[14]调查河流消落带水生苔藓植物, 即每个地区设置2个大样方 (10 m×10 m),大样方内每隔3 m做1个50 cm×50 cm小样方,共9个, 调查样方内苔藓植物的种群结构,记录海拔,基质和地点,并估计小样方内苔藓植物的盖度。筛选出水生长喙藓 (Rhynchostegium riparioides)、深绿褶叶藓 (Palamocladium euchloron)、卷叶湿地藓 (Hyophila involute)、仰叶藓 (Reimersia inconspicua) 和大叶凤尾藓 (Fissidens grandifrons) 共5种水生苔藓植物 (平均优势度≥0.02)。5种苔藓植物材料连同基质一并采集,带回实验室进行水淹试验,设置5个水淹处理:0、5、10、15、20 d,置于铺有双层湿润滤纸的培养皿中于室外培养 (保持水淹没植物),以非水淹为对照 (0 d),每个培养皿放置4丛苔藓植物 (10株以上),每个处理设3个重复。水淹处理每天换水,对照每天浇水,每个处理随机选取6株进行测定。
1.3 指标测定材料用蒸馏水清洗干净,用吸水纸吸干表面水分,然后称取所需重量。采用95%酒精提取法测量叶绿素含量;硫代巴比妥酸法测定丙二醛含量;蒽酮法测定可溶糖含量;紫外吸收法测定过氧化氢酶 (CAT) 活性;氮蓝四唑光还原法测定超氧化物歧化酶 (SOD) 活性;愈创木酚法测定过氧化物酶 (POD) 活性[15-17]。
1.4 数据处理优势种的确定由优势度 (Y) 决定,Y=(ni/N)×fi, 式中,ni为第i种的覆盖度,N为总覆盖度,fi为第i(i=0, 1, 2…) 种在各个站点出现的频率。为将优势种数目控制在一定范围内,规定当Y>0.02时,该种为优势种[18]。苔藓植物重要值=(相对盖度+相对频度)/2[19]。
采用隶属函数法结合主成分分析法进行耐水淹综合评价,参照许桂芳等[20]的方法,计算各指标的耐水淹系数和每种植物综合指标的隶属函数值和各指标的权重,采用加权单因子法将各指标叠加,获得水生苔藓植物的综合评价值D。统计分析采用Microsoft Excel 2013和IBM SPSS 20.0软件进行单因素方差分析 (One-Way ANOVA),用LSD法进行数据显著性多重比较。
2 结果和分析 2.1 优势种的优势度和生态重要值根据调查样方中苔藓植物的盖度和频度,共鉴定出优势种11种,隶属于7科11属 (表 1),优势种的优势度和重要值在不同地区不同,以冷水河下段的水生苔藓植物优势种最多,达10种。水生长喙藓、深绿褶叶藓、卷叶湿地藓、仰叶藓和大叶凤尾藓为最优势种,平均优势度≥0.02。而双齿异萼苔 (Heteroscyphus coalitus) 在4个消落带为优势种;卵叶青藓 (Brachythecium rutabulum) 在3个消落带为优势种;黄边孔雀藓 (Hypopterygium flavolimbatum)、比拉真藓 (Bryum billarderi)、带叶苔 (Pallavicinia lyellii) 和疏网美喙藓 (Eurhynchium laxirete) 在2个消落带为优势种,优势度都 < 0.02, 重要值 < 0.271。
| 表 1 消落带水生苔藓植物优势种的优势度 (Y) 和生态重要值 (IV) Table 1 Dominance (Y) and importance value (IV) of dominant aquatic bryophytes in hydro-fluctuation belt |
水淹前10 d,仰叶藓、深绿褶叶藓、水生长喙藓和卷叶湿地藓的可溶性糖含量随水淹时间的延长呈增加趋势 (图 1),此后呈递减趋势;而大叶凤尾藓在水淹前15 d的可溶糖含量增加,此后减少,但可溶性糖含量总体比对照组高。与对照相比,水生长喙藓和卷叶湿地藓的可溶性糖含量增长显著 (P < 0.05),深绿褶叶藓和大叶凤尾藓在水淹10 d的可溶性糖含量增长极显著 (P < 0.01),仰叶藓的可溶性糖含量增长不显著。
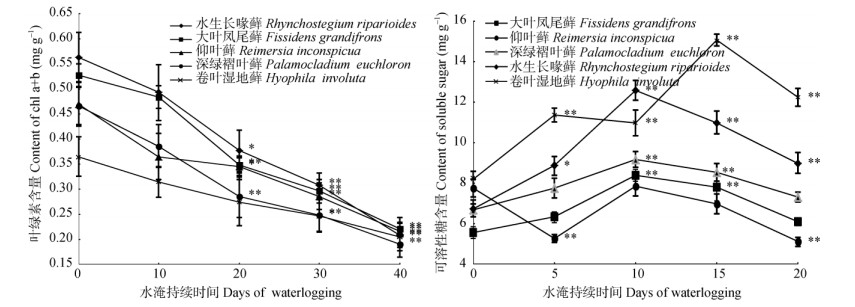
|
图 1 水淹对5种苔藓植物的叶绿素和可溶性糖含量的影响。*: P < 0.05; **: P < 0.01。 Fig. 1 Effect of waterlogging on contents of Chl a+b and soluble sugar in five bryophytes. *: P < 0.05;**: P < 0.01. |
与对照相比,随着水淹时间的延长,5种水生苔藓植物的叶绿素含量不断降低,叶片变黄,但变化较平缓。水淹10 d时,大叶凤尾藓和深绿褶叶藓的叶绿素含量极显著降低 (P < 0.01),分别比对照 (0.527和0.467 mg g-1) 降低了46.9%和39%,水生长喙藓和仰叶藓的叶绿素含量显著降低 (P < 0.05),而卷叶湿地藓的叶绿素含量在水淹15 d时显著降低 (P < 0.05),比对照 (0.365 mg g-1) 下降47.8% (图 1)。
2.3 水淹对水生苔藓植物抗氧化系统的影响水淹时5种水生苔藓植物的MDA含量、POD、SOD和CAT活性均高于对照,且大部分达显著差异;同时随水淹时间延长其变化趋势基本一致 (图 2)。
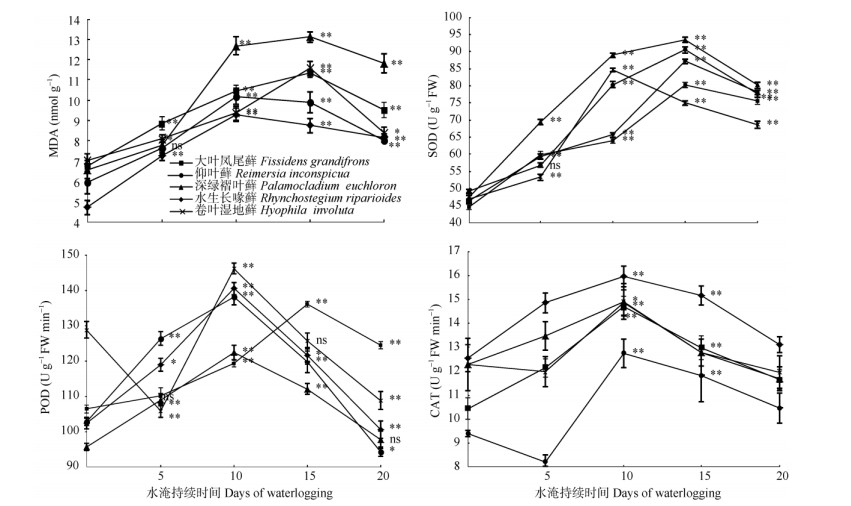
|
图 2 水淹对5种苔藓植物的MDA含量、POD、SOD和CAT活性的影响。*: P < 0.05;**: P < 0.01。 Fig. 2 Effect of waterlogging on activities of POD, SOD, CAT and MDA content in five bryophytes. *: P < 0.05;**: P < 0.01. |
与对照相比,水淹使5种水生苔藓植物的MDA含量总体上呈增加趋势,但不同苔藓植物MDA含量变化幅度不同。深绿褶叶藓、大叶凤尾藓和卷叶湿地藓的MDA含量在水淹第15天时达最高,分别比对照增加99.7%、67.7%和64.4%,达极显著差异 (P <0.01);此后,MDA含量总体呈下降趋势。而仰叶藓和水生长喙藓的MDA含量呈缓慢增加,水淹10 d达最高,此后略有下降,但均高于对照。
随水淹时间的延长,5种苔藓植物的POD活性呈先上升后下降的变化趋势。仰叶藓、深绿褶叶藓、水生长喙藓和卷叶湿地藓的POD活性最高出现在水淹第10天,达极显著差异 (P < 0.01);而大叶凤尾藓POD活性最高为水淹第15天。此后,植株的POD活性逐渐降低。
随水淹时间的延长,5种水生苔藓植物的SOD活性极显著升高 (P < 0.01),卷叶湿地藓和其他4种苔藓分别在水淹第10和15天达最高,之后下降。
5种水生苔藓植物的CAT活性变化较平缓,均在水淹第10天达最高,与对照相比增长显著 (P < 0.05),此后均降低。大叶凤尾藓、深绿褶叶藓和卷叶湿地藓的CAT活性变化趋势相似,水淹第10天比对照显著增加,而水淹20 d的与对照无显著差异。
方差分析表明,水生苔藓植物的叶绿素、可溶性糖、MDA含量、POD、SOD和CAT活性均受水淹时间、物种及二者的交互作用的影响显著 (P < 0.05)(表 2),叶绿素、可溶性糖、MDA含量和CAT活性受苔藓植物种类的影响极显著 (P < 0.01)(表 2)。
| 表 2 5种水生苔藓植物生化特征的方差分析 Table 2 Variation on physiological characteristics of five bryophytes |
对5种水生苔藓植物6个生理指标的耐水淹系数进行主成分分析,提取前3个指标 (表 3),其贡献率分别为52.2%、24.5%和17.2%,累积贡献率达93.9%。第一主成分主要包括叶绿素、可溶性糖含量和SOD活性,直接反映了水生苔藓植物的生长状况;第二主成分主要包括叶绿素、可溶性糖含量、SOD、POD和CAT活性,主要影响水生苔藓植物的酶活性;第三主成分主要包括叶绿素、MDA含量、SOD和CAT活性,主要影响水生苔藓植物的膜脂过氧化活性。这样把原来的6个单项指标转换为3个新的相互独立的综合指标,代表了6个单项指标93.9%的信息,他们的权重分别为:P1=0.556,P2=0.261,P3=0.183。
| 表 3 水淹下5种水生苔藓植物生理指标的主成分分析 Table 3 Principal component analysis of physiological indexes of five bryophytes under waterlogging |
综合评价值D反映了水生苔藓植物综合耐水淹能力的大小,D值越大则耐水淹性越强。由表 4可知,水生长喙藓、大叶凤尾藓、深绿褶叶藓、仰叶藓和卷叶湿地藓的D值分别为0.953、0.601、0.484、0.374和0.131。可见,5种植物对水淹的耐性由强到弱依次为:水生长喙藓、大叶凤尾藓、深绿褶叶藓、仰叶藓和卷叶湿地藓。
| 表 4 水淹下5种水生苔藓植物的公因子得分值C (x)、隶属函数U (x) 和综合评价值 (D) Table 4 Common factor score value C (x), subordination function U (x) and comprehensive evaluation value (D) of five bryophytes under waterlogging |
对6个消落带的水生苔藓植物进行调查,在冷水河下段的水生苔藓植物优势度最高,推测主要是由于冷水河下段沟谷比其他地区更深更宽,且沟谷中大块岩石的数量众多,在一定程度上减缓了水流,也为水生苔藓植物的附着生长提供了条件。根据优势度和生态重要值统计,青藓科的水生长喙藓和深绿褶叶藓具有较高的优势度,推测主要与其以匍匐枝进行生长,附着力较强有关,而丛集生长的仰叶藓、大叶凤尾藓和卷叶湿地藓,有一定抗流水冲击能力,这些苔藓植物反而在陆生及树生环境下相对较少见。
3.2 水淹对水生苔藓植物生理特征的影响水淹会使植物叶片变黄,还使植物生长和各项生理指标发生应激性反应,因此,可通过测定有效的生长和生理指标来探究植物的耐水淹能力[21]。5种水生苔藓植物的叶绿素含量均低于正常生长的苔藓植物含量[22],可能是由于水淹导致植株叶组织无法进行光合作用而使植株的整体光合受到影响, 植株未被水淹的叶组织的光合可能会增强[23]。随着水淹时间的延长,5种水生苔藓植物的叶绿素含量降低,可能是水淹胁迫使苔藓植物的光合产物运输受阻,光合产物积累在叶片中,对光合速率形成了反馈抑制[24],从而影响了苔藓植物叶绿素的合成和光合作用。
水淹胁迫下,5种水生苔藓植物的可溶性糖含量随水淹时间的延长总体上呈先增加后降低的趋势,但变化的速率和幅度不同,说明不同水生苔藓植物受水淹胁迫的伤害程度不同。随着水淹时间的延长,植物的可溶性糖消耗加剧,导致植物可溶性糖含量降低,主要是由于可溶性糖是植物维持旺盛代谢所必须的,在水淹导致厌氧或缺氧条件下,耐淹基因型能够保持植株足够的可溶性糖的供应,大量研究报道了可溶性糖在许多植物耐淹能力中的作用[25]。
5种苔藓植物的MDA含量随着水淹时间的延长呈先增加后下降的趋势。水淹开始时,MDA含量增加,可帮助植物抵挡体内过氧化物产生的潜在伤害,确保植株在厌氧条件下膜脂的稳定性,减轻组织受到过氧化伤害。随着水淹时间的延长,植物对不良环境的抵抗能力下降,保护酶的活性降低[26]。这与杨武等[27]的研究结果相似。
厌氧环境下,细胞内形成高还原势,细胞内的NAD (P) H/NAD (P)+循环受阻、线粒体电子传递链饱和,电子在传递过程中泄漏还原氧分子,植物细胞会受到损失,此时植物体内的酶系统活性增强,提高细胞的稳定性[28]。本研究中,5种苔藓植物的MDA含量、POD、SOD和CAT活性随着水淹时间的延长呈先增加后下降的趋势,SOD分布于所有细胞器内,能够催化细胞器中超氧阴离子自由基发生歧化反应,产生H2O2及O2, 而POD和CAT则进一步清除H2O2[29],这些酶活性的增加减轻了被淹植株体内活性氧分子的毒害作用。这与谭淑端等[24]报道双穗雀稗 (Paspalum distichum) 的MDA含量、POD、SOD和CAT活性随水淹时间的延长而增加,且均高于对照的结果相似。
3.3 水生苔藓植物对水淹耐受性的综合评价采用主成分分析和隶属函数法相结合,对多个指标进行综合评价成为可能,将其应用于耐水淹植物的筛选更有科学性和可靠性。利用隶属函数值加权平均法得到抗水淹性度量值 (D),D值越大耐水淹性越强,因而根据D值的大小得出5种水生苔藓对水淹耐受性由强到弱依次为:水生长喙藓、大叶凤尾藓、深绿褶叶藓、仰叶藓和卷叶湿地藓,这基本与优势种的排列顺序一致,从而在一定程度上说明苔藓植物形态适应性和生理适应性相一致。这也进一步说明这5种水生苔藓植物,特别是水生长喙藓,可作为消落带植被恢复与重建的重要物种。
| [1] |
ZHANG Y X. The ecological restoration and reconstruction of the fluctuating belt of reservoir[D]. Nanning:Guangxi University, 2007:1-102.
张永祥. 水库消落带生态修复与重建[D]. 南宁: 广西大学, 2007: 1-102. |
| [2] |
WANG Y B. Survey of amphibians in Lengshuihe nature reserve in Guizhou[J].
Guizhou Agri Sci, 2010, 38(11): 191-193. 王延斌. 贵州金沙冷水河自然保护区两栖动物调查[J]. 贵州农业科学, 2010, 38(11): 191-193. DOI:10.3969/j.issn.1001-3601.2010.11.060 |
| [3] |
WANG X R, CHENG R M, XIAO W F, et al. Relationship between standing vegetation and soil seed bank in water-level-fluctuating zone of Three Gorges Reservoir at the beginning after charging water[J].
Acta Ecol Sin, 2010, 30(21): 5821-5831. 王晓荣, 程瑞梅, 肖文发, 等. 三峡库区消落带水淹初期地上植被与土壤种子库的关系[J]. 生态学报, 2010, 30(21): 5821-5831. |
| [4] |
YI Y H, FAN D Y, XIE Z Q, et al. Effects of waterlogging on the gas exchange, chlorophyll fluorescence and water potential of Quercus variabilis and Pterocarya stenoptera[J].
J Plant Ecol, 2006, 30(6): 960-968. 衣英华, 樊大勇, 谢宗强, 等. 模拟淹水对枫杨和栓皮栎气体交换、叶绿素荧光和水势的影响[J]. 植物生态学报, 2006, 30(6): 960-968. DOI:10.17521/cjpe.2006.0122 |
| [5] |
HU R L.
The Bryology[M]. Beijing: Higher Education Press, 1987: 1-431.
胡人亮. 苔藓植物学[M]. 北京: 高等教育出版社, 1987: 1-431. |
| [6] | TESSLER M, TRUHN K M, BLISS-MOREAU M, et al. Diversity and distribution of stream bryophytes:Does pH matter?[J]. Freshwater Sci, 2014, 33(3): 778-787. DOI:10.1086/676996 |
| [7] | GECHEVA G, YURUKOVA L, GANEVA A. Assessment of pollution with aquatic bryophytes in Maritsa River (Bulgaria)[J]. Bull Environ Contam Toxicol, 2011, 87(4): 480-485. DOI:10.1007/s00128-011-0377-x |
| [8] | DÍAZ S, VILLARES R, LÓPEZ J, et al. Arsenic and mercury in native aquatic bryophytes:differences among species[J]. Bull Environ Contam Toxicol, 2013, 90(4): 465-470. DOI:10.1007/s00128-012-0950-y |
| [9] |
DENG L X, YANG C H, LI M.
Illustration of Wetland Common Plants in Guizhou[M]. Guiyang: Guizhou Science Press, 2013: 45-66.
邓伦秀, 杨成华, 李茂. 贵州湿地常见植物图谱[M]. 贵阳: 贵州科技出版社, 2013: 45-66. |
| [10] | MARTÍNEZ-ABAIGAR J, NÚÑEZ-OLIVERA E, BEAUCOURT N. Short-term physiological responses of the aquatic liverwort Junger-mannia exsertifolia subsp. cordifolia to KH2PO4 and anoxia[J]. Bryologist, 2002, 105(1): 86-95. DOI:10.1639/0007-2745(2002)105[0086:STPROT]2.0.CO;2 |
| [11] | KATSCHNIG D, BROEKMAN R, ROZEMA J. Salt tolerance in the halophyte Salicornia dolichostachya Moss:Growth, morphology and physiology[J]. Environ Exp Bot, 2013, 92: 32-42. DOI:10.1016/j.envexpbot.2012.04.002 |
| [12] | JÄGERBRAND A K, ALATALO J M, KUDO G. Variation in responses to temperature treatments ex situ of the moss Pleurozium schreberi (Willd. ex Brid.) Mitt. originating from eight altitude sites in Hokkaido, Japan[J]. J Bryol, 2014, 36(3): 209-216. DOI:10.1179/1743282014Y.0000000095 |
| [13] |
WANG H F, ZENG B, LI Y, et al. Effects of long-term submergence on survival and recovery growth of four riparian plant species in Three Gorges Reservoir Region, China[J].
J Plant Ecol, 2008, 32(5): 977-984. 王海锋, 曾波, 李娅, 等. 长期完全水淹对4种三峡库区岸生植物存活及恢复生长的影响[J]. 植物生态学报, 2008, 32(5): 977-984. DOI:10.3773/j.issn.1005-264x.2008.05.001 |
| [14] |
YANG B, XIONG Y X. Study on bryophytes species diversity in Danxia Landform from Fubao District of Sichuan[C]//Plant in the Construction of Ecological Civilization:Present and Future:the 15th Member Representative Meeting of Botanical Society of China and Eightieth Anniversary of the Academic Conference, Venue 1:System and Evolutionary Botany. Beijing:Botanical Society of China, 2013.
杨冰, 熊源新. 四川福宝丹霞地貌地区苔藓植物物种多样性研究[C]//生态文明建设中的植物学: 现在与未来--中国植物学会第十五届会员代表大会暨八十周年学术年会论文集--第1分会场: 系统与进化植物学. 北京: 中国植物学会, 2013. |
| [15] |
LI H S.
Method and Technology of Plant Physiological and Biochemical Experiment[M]. Beijing: Higher Education Press, 2000: 1-289.
李合生. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2000: 1-289. |
| [16] |
ZHANG Z L, QU W J, LI X F.
Experimental Guidance for Plant Physiology[M]. 4th ed. Beijing: Higher Education Press, 2009: 1-298.
张志良, 瞿伟菁, 李小方. 植物生理学实验指导[M]. 第4版. 北京: 高等教育出版, 2009: 1-298. |
| [17] |
LUO X Z, CAI Z H, ZHENG B. Studies on propagation techniques of Patrinia villosa[J].
Hubei Agri Sci, 2014, 53(1): 93-96. 罗先真, 蔡朝晖, 郑斌. 苦菜的繁育技术初探[J]. 湖北农业科学, 2014, 53(1): 93-96. DOI:10.3969/j.issn.0439-8114.2014.01.027 |
| [18] | McNAUGHTON S J. Relationship among functional properties of California grassland[J]. Nature, 1967, 216: 144-168. DOI:10.1038/216168b0 |
| [19] |
ZHOU J C. Research and screen of bryophytes adapted to rocky[D]. Guiyang:Guizhou University, 2009:1-298.
周金川. 适应石漠化生境苔藓植物研究与筛选[D]. 贵阳: 贵州大学, 2009: 1-298. |
| [20] |
XU G F, ZHANG Z Y, XIANG Z X. Comprehensive evaluation of cold resistance on four Lysimachia plants by subordinate function values analysis[J].
J NW For Univ, 2009, 24(3): 24-26. 许桂芳, 张朝阳, 向左湘. 利用隶属函数法对4种珍珠菜属植物的抗寒性综合评价[J]. 西北林学院学报, 2009, 24(3): 24-26. |
| [21] |
CHEN F Q, GUO C Y, WANG C H, et al. Effects of waterlogging on ecophysiological characteristics of Salix variegate seedlings[J].
Chin J Appl Ecol, 2008, 19(6): 1229-1233. 陈芳清, 郭成圆, 王传华, 等. 水淹对秋华柳幼苗生理生态特征的影响[J]. 应用生态学报, 2008, 19(6): 1229-1233. |
| [22] | Marschall M, Proctor M C. Are bryophytes shade plants? Photo-synthetic light responses and proportions of chlorophyll a, chlorophyll b and total carotenoids[J]. Annals of Botany, 2004, 94(4): 593-603. DOI:10.1093/aob/mch178 |
| [23] |
LUO F L, WANG L, ZENG B, et al. Photosynthetic responses of the riparian plant Arundinella anomala Steud. in Three Gorges reservoir region as affected by simulated flooding[J].
Acta Ecol Sin, 2006, 26(11): 3602-3610. 罗芳丽, 王玲, 曾波, 等. 三峡库区岸生植物野古草 (Arundinella anomala Steud.) 光合作用对水淹的响应[J]. 生态学报, 2006, 26(11): 3602-3610. |
| [24] | MIELKE M S, DE ALMEIDA F A A, GOMES F P, et al. Leaf gas exchange, chlorophyll fluorescence and growth responses of Genipa Americana seedlings to soil flooding[J]. Environ Exp Bot, 2003, 50(3): 221-231. DOI:10.1016/S0098-8472(03)00036-4 |
| [25] |
LI Z J, YU J, FAN D Y, et al. Clonal integration enhances the ability to scavenge reactive oxygen species in root of Cynodon dactylon subjected to submergence[J].
Acta Ecol Sin, 2011, 31(17): 4992-4999. 樊大勇, 等. 克隆整合提高淹水胁迫下狗牙根根部的活性氧清除能力[J]. 生态学报, 2011, 31(17): 4992-4999. |
| [26] |
TAN S D, ZHU M Y, ZHANG K R, et al. Effects of submergence on the antioxidative enzymes and carbohydrate contents of Paspalum distichum[J].
Acta Pratac Sin, 2013, 22(1): 217-224. 谭淑端, 朱明勇, 张克荣, 等. 水淹对双穗雀稗抗氧化酶活性及碳水化合物含量的影响[J]. 草业学报, 2013, 22(1): 217-224. |
| [27] |
YANG W. On morphological and physiological adaptions of mosses to environments[D]. Hangzhou:Zhejiang Normal University, 2008:1-113.
杨武. 藓类植物适应环境的形态结构及生理学机制[D]. 杭州: 浙江师范大学, 2008: 1-113. |
| [28] | BLOJKHINA O, VIROLAINEN E, FAGERSTEDT K V. Antioxidants, oxidative damage and oxygen deprivation stress:A review[J]. Ann Bot, 2003, 91(2): 179-194. DOI:10.1093/aob/mcf118 |
| [29] | MONK L S, FAGERSTEDT K V, CRAWFORD R M M. Oxygen toxicity and superoxide dismutase as an antioxidant in physiological stress[J]. Physiol Plant, 1989, 76(3): 456-459. DOI:10.1111/j.1399-3054.1989.tb06219.x |
 2017, Vol. 25
2017, Vol. 25


