2. 亳州职业技术学院药学院, 安徽 亳州 236800;
3. 安徽中医药大学, 安徽 合肥 230031
2. School of Pharmacy, Bozhou Vocational Techical College, Bozhou 236800, Anhui, China;
3. Anhui University of Chinese Medicine, Hefei 230031, China
中药紫菀 (Radix Asteris) 始载于《神农本草经》,历代草本皆有收载,是我国常用中药材, 具有润肺化痰、止咳痰之功效,是常用止咳平喘复方制剂的重要药材之一。2015版《药典》指明中药紫菀为菊科紫菀 (Aster tataricusL. f.) 的干燥根和根茎[1]。有研究表明,紫菀酮为紫菀止咳化痰药效的主要成分, 山柰酚、槲皮素等具有抗氧化、止痛、免疫调节等生物活性功能,在抑止溶血、脂质过氧化物反应和免疫调节方面均有显著作用[2]。
目前关于紫菀的研究多集中在化学成分和药理方面,根的结构变化、主要药用成分积累部位和品质评价等方面的研究尚属空白。此外,市场紫菀药材在加工过程中常将根下部剪掉,这一做法缺乏科学依据。为此,我们采用植物解剖学、组织化学和仪器分析技术相结合的方法,探讨紫菀根的结构与主要药用成分的积累关系,为药材品质和商品规格评价、显微和理化鉴定以及紫菀的深入研究提供理论指导和实验依据。
1 材料和方法 1.1 材料2014年3月在亳州中药材交易市场购买紫菀繁殖材料,经安徽中医药大学方成武教授鉴定为紫菀 (Aster tataricusL. f.),栽培于亳州中医药研究所药用植物园内。试验材料于2014年12月中旬采挖。
1.2 方法石蜡切片法 紫菀根用70%酒精配置的FAA固定液固定,经酒精系列脱水,石蜡包埋,Leica RM2265石蜡切片机切片,厚度8~12 μm,番红-固绿染色,中性树胶封片,Leica-DM2500显微镜观察并照相。表皮、凯氏带和导管等木栓化和木质化部位用荧光显微镜的蓝色激发光源观察并照相。
组织化学法 取紫菀新鲜根进行徒手切片。滴加5%香草醛-冰醋酸和高氯酸混合试剂,对紫菀的三萜皂苷类成分显色;加5% NaOH对黄酮类成分显色。对照材料经FAA固定液 (70%酒精配制) 处理2周后,进行同样的组织化学显色,在Leica-DM2500显微镜下观察并照相。
化学成分分析 采用高效液相色谱法进行。仪器包括高效液相色谱仪Agilent1260,SPD-10Avp检测器,Class-VP工作站。DL-180超声波破碎仪 (浙江海天电子仪器厂),MA200电子天平。试剂有紫菀酮、槲皮素、山萘酚 (购自中国食品药品检定研究院),乙腈 (天津科密欧) 均为色谱纯,水为纯净水。色谱条件:色谱柱ZORBAX SB-C18 (5 μm, 250 mm× 4.6 mm);流速:1.0 mL min-1;紫菀酮的检测波长为200 nm,柱温30℃,进样量20 μL,流动相选择100%乙腈。槲皮素和山萘酚的检测波长为360 nm, 柱温30℃,进样量10 μL,流动相选择乙腈 (A) 和0.1%磷酸水 (B) 梯度洗脱,0~10 min,25%~40% A; 10~15 min,40%~45% A;15~20 min,45%~100% A;20~30 min,100% A。
对照品溶液配制 (1) 紫菀酮:精密称取紫菀酮对照品约10 mg,置10 mL容量瓶中,乙腈定容, 再吸取1mL稀释至浓度为0.1mg mL-1的对照品溶液。(2) 槲皮素与山萘酚:精密称取槲皮素和山萘酚各10 mg,分别用甲醇定容于10 mL量瓶, 各自稀释10倍,再吸取槲皮素1mL,山萘酚1.5 mL,混合定容于50 mL量瓶,配制成槲皮素浓度为0.002 mg mL-1,山萘酚浓度为0.003 mg mL-1的混合对照品溶液。
样品溶液配制 分别将紫菀根上部和下部干燥,粉碎后过3号筛。(1) 紫菀酮样品配制:精密称取干燥后粉末各1g,加氯仿20 mL,称重,温浸1h,超声20 min,冷却,用氯仿补足质量。(2) 槲皮素和山萘酚样品配制:精密称取干燥后粉末各1g,加80% 20 mL,摇匀,称量,超声提取20 min, 取出,放冷,用80%甲醇补足质量,摇匀。即得供试品溶液。
线性关系考察 精确吸取紫菀酮对照溶液1、5、10、15、20、25 μL,进样测定,以进样量为横坐标,峰面积为纵坐标,得回归直线方程为Y=114.72X+3.6977,R=0.9999,表明紫菀酮在0.02~0.5 mg线性关系良好。精确吸取槲皮素和山萘酚混合对照溶液1、2、5、10、15、20 μL,得槲皮素回归直线方程为Y=70.573X-6.1275, R=0.9999,表明0.002~0.040 mg线性关系良好;山萘酚回归直线方程为Y=131.14X-11.107,R=0.9999,表明0.003~0.06 mg线性关系良好。
精密度试验 取紫菀根的样品溶液重复进样5次,每次20 μL,测定峰面积的相对标准偏差分别为紫菀酮RSD=0.17%,槲皮素RSD=0.08%, 山萘酚RSD=0.07%。
重现性试验 取同一紫菀样品5份,按照紫菀酮的方法制成供试溶液,每份进样20 μL,测得峰面积RSD=0.04%,表明重现性良好。
稳定性试验 制备供试品溶液,分别于0、2、4、6、8、10、12、24 h吸取供试品溶液20 μL,进样分析并记录峰面积,紫菀酮、槲皮素和山柰酚的峰面积RSD分别为0.21%、0.12%和0.08%,表明样品溶液在24 h内稳定。
回收率试验 精确称取紫菀根上部的粉末10份各1.0 g,其中5份分别加入1mg mL-1的紫菀酮对照溶液2.5 mL,另外5份加入1mg mL-1的槲皮素对照溶液2 mL和1mg mL-1的山萘酚对照溶液3 mL,计算平均回收率,紫菀酮为101.7%,RSD=0.68%;槲皮素回收率98.10%,RSD=0.44%;山萘酚回收率99.32%,RSD=0.96%。
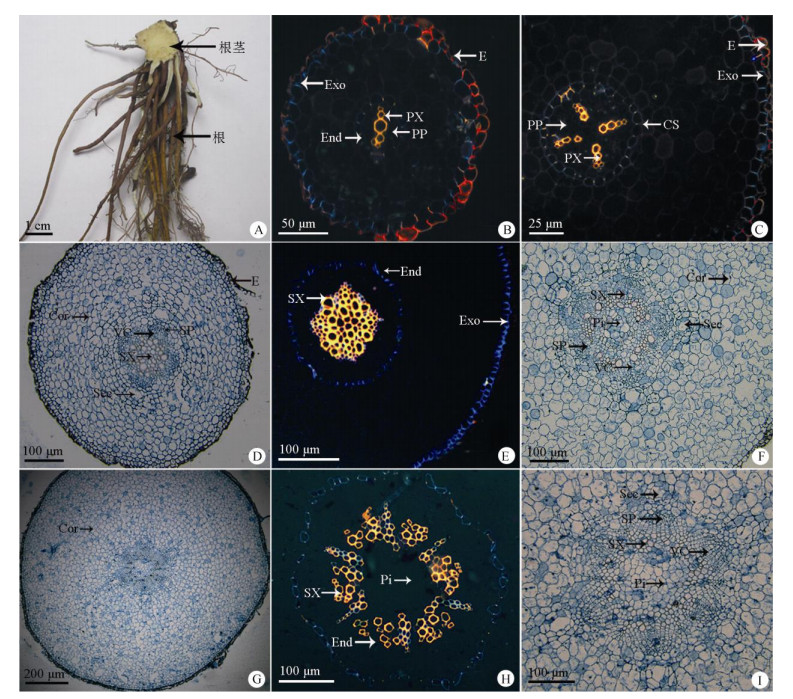
2 结果 2.1 根的结构特征紫菀的根由多条须根组成,须根簇生于植株基部膨大根茎上。根细长,一般不超过15 cm。根上部最粗处直径约0.3 cm,中部约0.15 cm,由上到下逐渐变细,下方有分支的纤维根 (图 1: A)。根表面紫红色,质地较柔韧,断面白色,中央有细小木心。
|
图 1 紫菀根的结构。A:形态; B~C:初生结构, 初生木质部呈二元型和四元型; D~I:次生结构, 示木质部、韧皮部和分泌道的变化及髓的出现. B, C, E, H为荧光拍照。E:表皮; Cor:皮层; Pi:髓; PP:初生韧皮部; PX:初生木质部; Sec:分泌道; Exo:外皮层; End:内皮层; CS:凯氏点; VC:维管形成层; SX:次生木质部; SP:次生韧皮部。 Fig. 1 Structure of Aster tataricus root. A: Shape; B-C: Primary structure, primary xylem had diarch and tetrarch; D-I: Secondary structure, showing the changes of xylem, phloem and secretory channel and appearance of pith; B, C, E and H were photographed by luorescence. E: Epidermis; Cor: Cortex; Pi: Pith; PP: Primary phloem; PX: Primary xylem; Sec: Secretory; Exo: Exodermis; End: Endodermis; CS: Casparian strip; VC: Vascular cambium; SX: Secondary xylem; SP: Secondary phloem. |
紫菀根的初生结构由表皮、皮层、维管柱三部分组成。表皮细胞1层,排列紧密,细胞壁木栓化 (图 1: B)。皮层分为外、中、内三层,外皮层径向壁先木栓化,随后外切向壁也木栓化;中皮层细胞排列疏松,有胞间隙,细胞近圆形,体积较大,液泡化明显;内皮层细胞体积较小,排列紧密,径向壁和横向壁带状木栓化,形成明显的凯氏点 (图 1: B, C)。皮层内侧为维管柱,被1层中柱鞘细胞包围, 由初生木质部和初生韧皮部组成,二者相间排列,初生木质部先期为二原型 (图 1: B),之后呈现四原型 (图 1: C)。
随着根的增粗,表皮被挤毁脱落,由内侧外皮层替代,起保护作用 (图 1: D, E)。皮层细胞层数和各层细胞数明显增加,内侧分化出分泌道,分泌道类圆形或扁圆形,直径30~75 μm,每个分泌道由6~8个上皮细胞围绕细胞间隙构成,直径1mm的根由8~12层薄壁细胞组成,分泌道4个 (图 1: D), 直径2 mm的有14~18层,分泌道5个 (图 1: F), 直径3 mm的有25~30层,分泌道6个 (图 1: G, I)。根直径约1mm时,可见木质部呈菱状位于维管柱中央,韧皮部4束位于菱形边缘外侧,与木质部相间排列,二者之间沿菱形边缘可见维管形成层片段 (图 1: D)。维管形成层片段向内分化产生次生木质部, 向外产生次生韧皮部,使木质部由菱状逐渐变成环状 (图 1: E, H),韧皮部呈束状位于木质部外侧 (图 1: D, F, I)。当韧皮部数量增至5束时,维管柱的中央分化出薄壁细胞,形成髓部 (图 1: F)。紫菀根的韧皮部最多为6束,数量变化与外侧分泌道保持一致。
2.2 根中主要药用成分的组织化学定位利用5%香草醛-冰醋酸和高氯酸混合试剂作为显色剂,参照紫菀根的显微结构,对其中的三萜皂苷类成分进行组织化学定位研究[3]。结果表明,根的韧皮部和皮层内侧 (约占皮层直径一半) 显色较深,髓部和皮层外侧显色较浅 (图 2: A),经FAA固定液处理的对照材料,不产生颜色反应 (图 2: B)。

|
图 2 紫菀根中三萜皂苷和黄酮类成分的分布。A:三萜皂苷显色反应; B:对照; C:黄酮类显色反应; D:对照。 Fig. 2 Distribution of triterpenoid saponins and flavonoids in root of Aster tataricus. A: Colour reaction of triterpenoid saponins; B: Control; C: Colour reaction of flavonoids; D: Control. |
黄酮类化合物经5% NaOH溶液染色呈黄色至橙色[4],组织化学定位研究表明, 皮层、韧皮部和髓部的薄壁细胞均呈现黄色 (图 2: C),而对照的各部位均不显色 (图 2: D)。
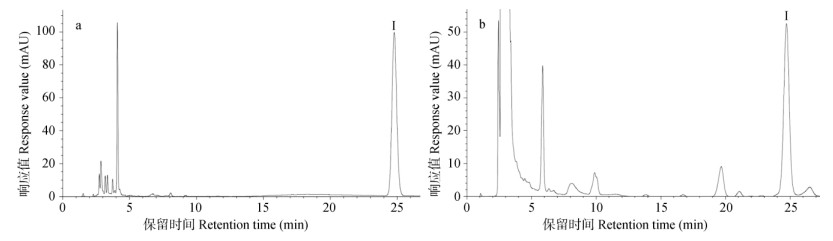
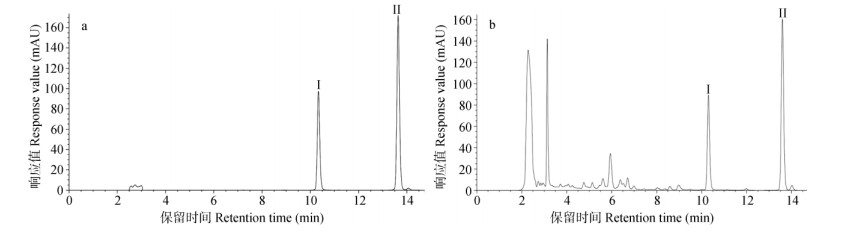
2.3 根中主要药用成分的含量测定经药材市场调查,商品紫菀常把根下部剪掉, 仅保留根上部,约5~6 cm长。因此,我们依据市场规格将紫菀根分为两部分,分别测定了紫菀根上部和根下部的主要药用成分含量,其中三萜皂苷类代表成分为紫菀酮,黄酮类代表成分为槲皮素和山萘酚。从图 3,4和表 1可看出,根下部的紫菀酮含量高于上部,而其黄酮类成分仅为上部的1/3。
|
图 3 紫菀酮 (Ⅰ) 成分的HPLC分析。a:标准品; b:样品。 Fig. 3 HPLC of shionone (Ⅰ). a: Standard sample; b: Sample. |
|
图 4 槲皮素 (Ⅰ) 和山萘酚 (Ⅱ) 成分的HPLC分析。a:标准品; b:样品。 Fig. 4 HPLC of quercetin (Ⅰ) and kaempferol (Ⅱ). a: Standard samples; b: Sample. |
| 表 1 紫菀根中3种化学成分的含量 Table 1 Contents of three chemical constituents in Aster tataricus roots |
紫菀根的初生结构类似于一般双子叶草本植物,但表皮在根增粗过程中被外皮层细胞代替,这一现象常存在于具有须根的双子叶草本植物当中, 如细辛 (Asarum sieboldii)、龙胆 (Gentiana scabra)[5]。紫菀根中存在维管形成层,通过其分裂活动产生了不发达的次生维管组织。分泌道作为分泌组织的一种,常分布于根的次生韧皮部,如北柴胡 (Bupleurum chinense)[3]、漆树 (Toxicodendron vernicifluum)[7]等, 但紫菀根中的分泌道分布于皮层内侧,与韧皮部束相对而生,且数量保持一致,这与蹄叶橐吾 (Ligularia fischeri) 根 (中药山紫菀,亦称硬紫菀) 类似[8-9]。一般双子叶草本植物根中央无髓,但少数例外,根中髓的出现往往是由于初生木质部未分化至中央所致,如乌头 (Aconitum carmichaeli)、龙胆,但紫菀根中髓的出现是由于维管柱中央逐渐分化出薄壁细胞所致,这一现象是否与根茎维管束有关仍有待深入研究。本研究表明,紫菀较细的根中没有髓部,髓一般分布在直径约2 mm以上的根中,因此,“紫菀根中央有髓”的观点是不完全正确的。此外,由于紫菀的根多为简单次生结构,导管木质化程度不高,因而采用荧光拍照可观察初生木质部的导管分布变化。紫菀的外皮层、分泌道以及髓均可作为显微鉴定的重要依据。
3.2 紫菀结构与主要药用成分积累关系植物不同部位以及发育过程中的结构变化与有效成分积累密切相关,远志 (Polygala tenuifolia) 根中的皂苷含量随年限增加而下降[10];芦荟 (Aloe arborescens) 叶中的蒽醌类化合物含量在同一株内随叶龄的增大逐渐降低[11];喜树 (Camptotheca acuminate) 枝叶龄越小,喜树碱含量越高[12]; 龙胆裂分部位的龙胆苦苷含量为未裂分部位的60%[13]。组织化学研究表明,紫菀根的三萜皂苷成分在韧皮部有分布,与牛膝 (Achyranthes bidentata)、北柴胡、甘草 (Glycyrrhiza uralensis) 等常用中药类似[14];同时紫菀根的皮层内侧亦显色较深,与该处存在分泌道有关。已有研究表明,柴胡属 (Bupleurum) 植物根、茎和叶的分泌道中均含有柴胡皂苷[15]。紫菀的黄酮类成分则多积累在皮层和髓部,与黄芩 (Scutellaria baicalensis) 和滇黄芩 (S. amoena)[16]类似,积累部位以薄壁细胞为主。显微结构表明,紫菀根的增粗主要为皮层薄壁细胞的增多,而皮层外侧并非三萜皂苷成分的主要积累部位,所以根的增粗并没有导致三萜皂苷类紫菀酮的含量升高,反而黄酮类槲皮素和山奈酚含量大大增加,这与含量测定结果一致。
3.3 紫菀药材商品规格及品质评价研究报道紫菀化学成分多达几十种[2],其中三萜皂苷和黄酮类是迄今研究较多的两类活性成分, 且目前紫菀药材的质量控制以特征性成分紫菀酮为评价标准[1]。本研究表明,紫菀根下部的紫菀酮含量高于上部,分别为0.31%和0.28%,这与传统观点“根长者为佳”相符合,因此在紫菀药材加工过程中将根下部剪掉极不合理,建议恢复传统辫紫菀的加工方法,即:将紫菀的根辫成辫状,保留下部细根。随着现代中药化学及药理学的发展,基于多成分紫菀药材品质的综合评价模式亟待研究。此外,含量测定过程中,采用不同的色谱条件,是由于紫菀酮的极性和吸收波长与两种黄酮类成分差异很大,两种测定方法均操作简便、快速、准确, 可为紫菀品质评价提供参考。
致谢: 本文受到西北大学生命科学学院魏朔南教授的指导,特此感谢!| [1] |
The State Pharmacopoeia Committee.
Chinese Pharmacopoeia, Part 1[M]. Beijing: Chemical Medical Science Press, 2015: 322.
国家药典委员会. 中华人民共和国药典 (一部)[M]. 北京: 中国医药科技出版社, 2015: 322. |
| [2] |
KORBANJHON, OUYANG Y, NURMAMAT. The advance on the research of chemical constituents and pharmacological actions of Aster L. plants[J].
Chin Wild Plant Resour, 2010, 29(2): 1-4. 库尔班江, 欧阳艳, 努尔买买提. 紫菀属植物化学成分及药理作用研究进展[J]. 中国野生植物资源, 2010, 29(2): 1-4. DOI:10.3969/j.issn.1006-9690.2010.02.001 |
| [3] | TAN L L, CAI X, HU Z H, et al. Localization and dynamic change of saikosaponin in root of Bupleurum chinense[J]. J Integr Plant Biol, 2008, 50(8): 951-957. DOI:10.1111/j.1744-7909.2008.00668.x |
| [4] |
LI N, KANG J F, YUAN Q Q, et al. Morphological structure of vege-tative organs and histochemical localization in Chloranthus multi-stachys Pei[J].
Plant Sci J, 2011, 29(4): 507-511. 李娜, 康杰芳, 袁琴琴, 等. 多穗金粟兰营养器官的形态结构及组织化学研究[J]. 植物科学学报, 2011, 29(4): 507-511. DOI:10.3724/SP.J.1142.2011.40507 |
| [5] |
CAI S Q, LI J.
Species Systematization and Quality Evaluation of Commonly Used Chinese Traditional Drugs (North Series) (5)[M]. Beijing: Peking University Medical Press, 2001: 50-53.
蔡少青, 李军. 常用中药材品种整理和质量研究 (北方编) (5)[M]. 北京: 北京医学大学出版社, 2001: 50-53. |
| [6] |
LOU Z C, QIN B.
Species Systematization and Quality Evaluation of Commonly Used Chinese Traditional Drugs (North Series) (3)[M]. Beijing: Peking University Medical Press, 2003: 470-471.
楼之岑, 秦波. 常用中药材品种整理和质量研究 (北方编) (3)[M]. 北京: 北京医科大学出版社, 2003: 470-471. |
| [7] |
LIU C Q, ZHAO M, WEI S N, et al. Comparative anatomy of secondary phloem and morphology among 4 varieties of Toxicodendron verni-cifluum in Shaanxi[J].
Acta Bot Boreali-Occid Sin, 2010, 30(2): 269-274. 刘彩琴, 赵猛, 魏朔南, 等. 陕西4个漆树品种外部形态及次生韧皮部结构的比较[J]. 西北植物学报, 2010, 30(2): 269-274. |
| [8] |
Nanjing University of Chinese Medicine.
Dictionary of Chinese Medicine, Vol. 1[M]. Shanghai: Shanghai Science and Technology Press, 2006: 870, 3127.
南京中医药大学. 中药大辞典, 上部[M]. 上海: 上海科学技术出版社, 2006: 870, 3127. |
| [9] |
Nanjing University of Chinese Medicine.
Dictionary of Chinese Medicine, Vol. 2[M]. Shanghai: Shanghai Science and Technology Press, 2006: 2275.
南京中医药大学. 中药大辞典, 下部[M]. 上海: 上海科学技术出版社, 2006: 2275. |
| [10] | TENG H M, FANG M F, CAI X, et al. Localization and dynamic change of saponin in vegetative organs of Polygala tenuifolia[J]. J Integr Plant Biol, 2009, 51(6): 529-536. DOI:10.1111/j.1744-7909.2009.00830.x |
| [11] | LIAO H M, SHENG X Y, HU Z H. Ultrastructural studies on the process of aloin production and accumulation in Aloe arborescens (Asphodelaceae) leaves[J]. Bot J Linn Soc, 2006, 150(2): 241-247. DOI:10.1111/j.1095-8339.2006.00452.x |
| [12] | LIU W Z. Secretory structures and their relationship to accumulation of camptothec in Camptotheca acuminate (Nyssaceae)[J]. Acta Bot Sin, 2004, 46(10): 1242-1248. |
| [13] |
GUO W N, WEI S N. Studies on formation of stele division and accumulation of gentiopicroside of Gentiana macrophylla Pall' root[J].
Plant Sci J, 2011, 29(4): 512-518. 郭伟娜, 魏朔南. 秦艽根中柱裂分结构的发生及龙胆苦苷的积累研究[J]. 植物科学学报, 2011, 29(4): 512-518. DOI:10.3724/SP.J.1142.2011.40512 |
| [14] |
HU Z H.
The Relationship between the Structure, Development and Medicinal Components in Medicinal Plants[M]. Shanghai: Shanghai Science and Technology Press, 2014: 图版1, 4.
胡正海. 药用植物的结构、发育与药用成分的关系[M]. 上海: 上海科学技术出版, 2014: 图版1, 4. |
| [15] |
ZHOU Y F. Studies on the comparision of structures and their accumulation of chemical components and the development of secretory canals in six medicinal plants of Bupleurum L.[D]. Xi'an:Northwest University, 2008:1-95. doi:10.7666/d.y1252724.
周亚福. 柴胡属6种药用植物结构与化学成分积累的比较和分泌道形态发生的研究[D]. 西安: 西北大学, 2008: 1-95. doi: 10.7666/d.y1252724. |
| [16] |
KONG X H, WEI S N, LI X. The anatomical structure and histological localizations of effective components in Scutellaria amoena (Lamiaceae)[J].
Plant Divers Resour, 2011, 33(4): 414-422. 孔祥鹤, 魏朔南, 李欣. 滇黄芩的解剖学与组织化学研究及其与黄芩的比较[J]. 植物分类与资源学报, 2011, 33(4): 414-422. DOI:10.3724/SP.J.1143.2011.10204 |
 2017, Vol. 25
2017, Vol. 25


