随着全球变暖和气候异常,果树的生产栽培面临着高温胁迫的严峻挑战,成为影响果树产业发展的重要因素之一。柑橘 (Citrus reticulata) 在受到高温胁迫的情况下光合速率明显降低,叶片光系统活性的光化学效率也明显下降[1]。苹果 (Malus pumila) 果实受到高温胁迫,O2—˙含量增加,其超氧化物歧化酶 (Superoxide dismutase, SOD) 和过氧化物酶 (Peroxidase, POD) 活性下降且丙二醛 (MDA) 含量增加,细胞的膜脂过氧化作用加重[2]。葡萄 (Vitis vinfera) 在正常光照下,40℃高温胁迫导致其叶片的Pn显著下降 (不是气孔因子导致的结果,而是与非气孔因子PSⅡ供体侧和反应中心活性以及激发能分配有关),不过能够较快地恢复[3]。高温胁迫对枣树 (Ziziphus jujuba) 幼苗叶片相对含水量的影响并不明显,但随着高温胁迫的加剧,细胞膜脂过氧化程度和破坏程度增加,同时细胞失水也越来越严重[4]。早期王进等[5]对早熟梨的研究表明,高温胁迫会引起梨叶片的早期脱落,且叶片开始脱落的时间和完全脱落时间随胁迫时间的延长而提前。高温胁迫对梨的生理效应和伤害机理研究报道较少,因此,开展对梨的高温适应性研究十分必要。
高温胁迫过程中,果树会发生氧代谢失调,过氧化氢 (H2O2) 增多,若不及时清除,会引起细胞的破坏。而抗坏血酸过氧化物酶 (Ascorbate peroxidase, APX) 是利用抗坏血酸 (Ascorbic acid, AsA) 为电子供体的H2O2的清除剂[6]。高温胁迫下果树体内各种酶活性下降,生理代谢发生紊乱,内源激素脱落酸 (Abscisic acid, ABA) 能维持SOD和POD的活性, 有效降低膜脂过氧化作用。9-顺环氧类胡萝卜素双加氧酶 (9-cis-Epoxycarotenoid dioxygenase, NCED) 是高等植物ABA生物合成的关键酶之一[7-8]。高温胁迫会导致吲哚乙酸 (Indole-3-acetic acid, IAA) 含量降低,使果树生长速率减慢,从而缓解因水分不足对植株完成正常生理活动造成的压力。而生长素酰胺合成酶 (Gretchen hagen 3, GH3) 是果树IAA生物合成的关键酶之一[9-10]。因此,APX、NCED和GH3基因在缓解果树受高温胁迫伤害起着重要的作用。
‘黄冠’(Pyrus pyrifolia Nakai ‘Cuiguan’) 和‘翠玉’(P. bretschneideri×P. pyrifolia) 梨是我国广为栽培的优良品种,深受广大消费者喜爱。本试验以盆栽梨苗进行高温处理,测定叶片的抗氧化酶活性、抗氧化物质和渗透调节物质含量,采用qRT-PCR方法分析叶片中APX、NCED和GH3基因表达量的变化,以探讨高温胁迫对梨叶片的影响,为梨的抗热性研究奠定理论基础。
1 材料和方法 1.1 材料选取大小、长势基本一致,叶片完全成熟的‘黄冠’(Pyrus pyrifolia Nakai‘Cuiguan’)、‘翠玉’(P. bretschneideri×P. pyrifolia) 品种2年生幼苗各9株, 在高温胁迫前1周左右将幼苗移至人工气候室,3株为1小区,光暗周期12 h/12 h, 日夜温度25℃/ 17℃,光照强度72 μmol m-2s-1,相对湿度为75%。
高温胁迫期间湿度保持在78%,光暗周期12 h/ 12 h。将1 d分为6个时间段 (20:00-24:00、0:00-04:00、04:00-08:00、08:00-12:00、12:00-16:00和16:00-20:00),对应的温度为32℃、36℃、40℃、42℃、38℃和36℃。材料在人工气候室内随机排列,高温胁迫期间每天18:00浇1次水,以保证水分充足,并按照顺序变换位置以保证生长条件一致。梨幼苗高温处理8 d,每2 d取1次叶片,取样时间定为13:00,取样按照上、中、下随机取样,以未处理植株为对照。重复3次。叶片经液氮速冻后保存于-80℃冰箱中。
1.2 方法叶绿素含量、丙二醛 (MDA)、抗坏血酸 (ASA) 含量和脯氨酸 (Pro) 含量参照陈建勋等[11]的方法进行测定。
过氧化物酶 (POD) 和过氧化氢酶 (CAT) 活性参照高俊凤等[12]的方法测定。
采用反相高效液相色谱HPLC技术,参考前人[13-16]的方法测定内源激素含量。
1.3 高温胁迫相关基因的表达分析分别以‘黄冠’和‘翠玉’高温处理0、2、4、6和8 d的叶片总RNA为模板,反转录合成cDNA第一链,根据NCBI已获得的NCED、GH3和APX基因的全长序列,使用Primer premier 5.0设计特异性引物PbNCED-F和PbNCED-R、PbGH3-F和PbGH3-R、PbAPX-F和PbAPX-R (表 1),以梨Actin基因为内参,引物为Actin-F和Actin-R,3次重复。使用STEPONE荧光定量PCR仪进行定量分析,试剂采用TaKaRa公司的SYBR® Premix Ex TaqTM Ⅱ, 操作按照试剂说明书进行,采用2-△△CT公式计算基因相对表达量。
| 表 1 荧光定量PCR扩增所需引物及其序列 Table 1 qRT-PCR amplification required primers and sequences |
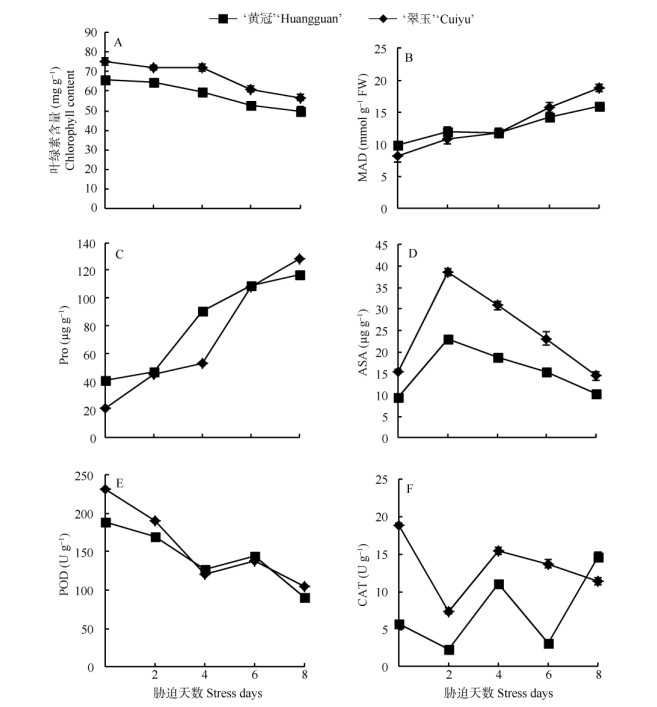
在高温胁迫下, ‘黄冠’和‘翠玉’叶片中的叶绿素含量均随胁迫时间的延长而下降。‘黄冠’叶片中的叶绿素含量在胁迫8 d时与胁迫0 d时相比下降了33.0%,‘翠玉’的下降了31.9%。同时,‘黄冠’叶片中的叶绿素含量在胁迫期间一直比‘翠玉’中的含量高 (图 1: A)。
|
图 1 高温胁迫对梨叶片中叶绿素 (A)、MAD (B)、Pro (C)、ASA (D) 含量、POD (E) 和CAT (F) 活性的影响 Fig. 1 Effects of high temperature stress on contents of chlorophyll (A), MAD (B), Pro (C), ASA (D), activities of POD (E) and CAT (F) in 'Huangguan' and 'Cuiyu' |
在高温胁迫下,‘黄冠’和‘翠玉’叶片中MDA含量均持续增加。胁迫处理2 d的‘黄冠’叶片MDA含量比处理前增加了33.6%,处理4 d后又增加了8.5%,处理6 d又增加了33.2%,处理8 d又增加了19.5%。胁迫2 d的‘翠玉’叶片MDA含量比处理前增加了21.7%;处理4 d比处理前略微下降了0.8%;处理6 d又增加了20.8%;处理8 d比处理前增加了12.3%。说明细胞膜在高温胁迫下受到了一定程度的伤害,而且‘翠玉’受到的影响大于‘黄冠’(图 1: B)。
2.2 高温胁迫对Pro含量的影响在高温胁迫下, ‘黄冠’和‘翠玉’叶片中Pro含量都随胁迫时间的延长而显著增加 (图 1: D)。高温胁迫处理8 d的‘黄冠’叶片Pro含量比处理前增加了117.6%;处理的前2 d增长缓慢,仅增加了17.3%,处理4 d的增长速率加快,增加了102.6%,处理6~8 d缓慢增长了19.4%。‘翠玉’叶片中的Pro含量在处理前期增长缓慢,增幅为14.3%;处理2 d后增长加快,增幅为93.2%;处理4~6 d和6~8 d的增长较慢,分别增加了20.5%和0.7%。可见,‘黄冠’和‘翠玉’都是抗旱性较强的品种,但相比而言, ‘黄冠’的抗旱性要强于‘翠玉’。
2.3 高温胁迫对ASA含量、POD和CAT活性的影响在高温胁迫下,‘黄冠’和‘翠玉’叶片中ASA含量的变化趋势相同,均为先升高后下降 (图 1: C)。在胁迫前2 d ‘黄冠’叶片中的ASA含量增长较快, 与处理前相比增加了149.4%;胁迫处理6 d后,ASA含量持续下降,下降了37.6%。而‘翠玉’叶片中的ASA含量在处理前2 d增加了142.6%,在处理4 d、6 d和8 d分别下降了18.9%、18.2%和33.7%;可以看出‘翠玉’受到高温胁迫的影响比‘黄冠’大。
在高温胁迫下,‘黄冠’和‘翠玉’叶片的POD活性均表现为先下降后上升再下降的趋势 (图 1: E)。‘黄冠’和‘翠玉’叶片POD活性在处理前4 d持续下降,胁迫2 d‘黄冠’和‘翠玉’叶片的POD活性与处理前分别下降17.7%和10.2%,处理4 d又分别下降了36.4%和25.4%,‘黄冠’叶片POD活性下降幅度比‘翠玉’大。处理6 d‘黄冠’和‘翠玉’叶片的POD活性分别比处理前上升了13.4%和13.1%,处理8 d‘黄冠’叶片的POD活性与处理前的下降幅度比‘翠玉’小,‘翠玉’下降了37.1%,而‘黄冠’只下降了23.5%。高温胁迫对‘黄冠’叶片POD活性的影响与‘翠玉’基本相似,均随胁迫时间的延长POD活性下降。
高温胁迫下,‘黄冠’叶片的CAT活性呈先下降后上升再下降的趋势,而‘翠玉’的呈“W”形 (图 1: F)。处理2 d‘黄冠’叶片的CAT活性急剧下降,下降了60.7%,‘翠玉’的下降了59.6%,均降至低谷。处理4 d时‘黄冠’和‘翠玉’叶片的CAT活性比处理前分别上升了107.6%和383.6%。处理6 d时‘黄冠’叶片的CAT活性缓慢下降,降幅为11.2%,同期‘翠玉’下降了72.2%。处理8 d‘黄冠’叶片的CAT活性继续下降,降幅为16.7%,而‘翠玉’急剧上升,增加了375.61%。胁迫初期‘黄冠’叶片CAT活性比‘翠玉’高,随着胁迫时间的延长,‘黄冠’叶片的CAT活性下降,而‘翠玉’上升,后期‘翠玉’高于‘黄冠’,表明‘翠玉’叶片清除活化氧的能力低于‘黄冠’。
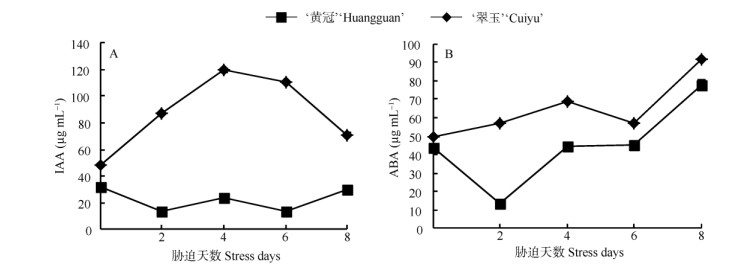
2.4 高温胁迫对叶片内源IAA与ABA的影响‘黄冠’叶片中IAA含量呈先增加后下降趋势, 而‘翠玉’的呈阶梯状起伏 (图 2: A)。‘黄冠’的变化幅度比较大,而‘翠玉’的较小,并且‘黄冠’叶片中IAA含量始终比‘翠玉’高。高温处理的第4天,IAA含量在两种梨叶片中的变化趋势都发生了改变,说明第4天是其生理变化的转折点。
|
图 2 高温处理‘黄冠’和‘翠玉’叶片的IAA (A) 和ABA (B) 含量 Fig. 2 Contents of IAA and ABA in leaves of 'Huangguan' (A) and 'Cuiyu' (B) |
‘黄冠’和‘翠玉’叶片中ABA含量整体呈上升趋势,‘翠玉’的ABA含量均比‘黄冠’低 (图 2: B)。高温胁迫下两种梨叶片中的ABA含量升高,说明ABA能缓解因高温胁迫造成的水分亏缺。
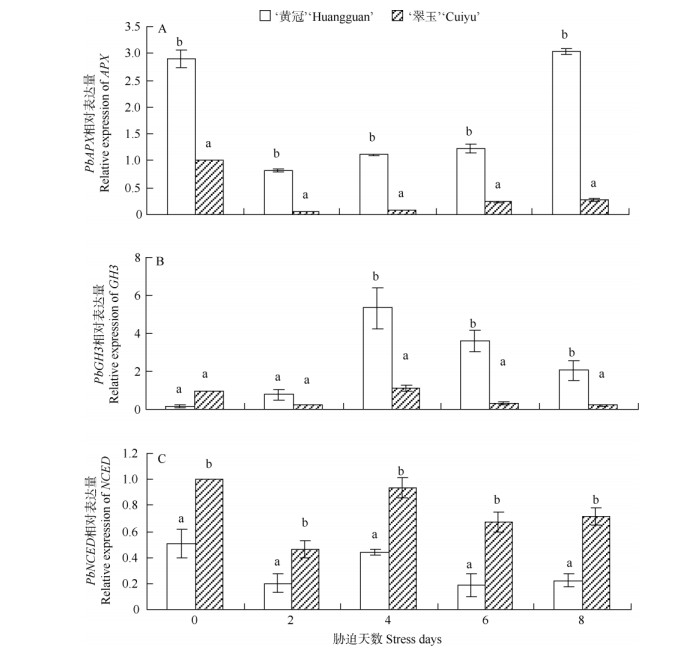
2.5 高温胁迫下PbAPX、PbGH3和PbNCED的表达分析在高温胁迫下,PbAPX基因在‘黄冠’和‘翠玉’叶片中的表达量均先下降再升高,且以处理2 d时最低 (图 3: A)。‘黄冠’叶片中PbAPX基因表达量均高于‘翠玉’, 这与高温胁迫下ASA含量的变化趋势一致,说明‘黄冠’抵御膜脂过氧化的能力强于‘翠玉’。
|
图 3 高温处理‘黄冠’和‘翠玉’叶片中PbAPX(A)、PbGH3(B) 和PbNCED(C) 基因表达 Fig. 3 Relative expression of PbAPX (A), PbGH3 (B) and PbNCED (C) in leaves of 'Huangguan' and 'Cuiyu' |
在高温胁迫下,PbGH3基因在两种梨叶片中以处理4 d时的表达量最大,除对照外,‘黄冠’叶片中PbGH3基因表达量都要高于‘翠玉’(图 3: B)。这与高温胁迫4 d时IAA含量达到最大相吻合。在高温胁迫4 d、6 d和8 d时,PbGH3基因在‘黄冠’和‘翠玉’中的表达量均存在显著差异。
PbNCED基因在‘黄冠’叶片中的表达量呈阶梯状起伏,而‘翠玉’呈先减少后增加趋势,且均以对照的表达量最高 (图 3: C)。这与ABA在高温胁迫下的变化趋势基本吻合。高温胁迫下,PbNCED基因在‘黄冠’和‘翠玉’叶片中的表达量均存在显著性差异。
将本试验中ASA、IAA和ABA含量分别与PbAXP、PbGH3和PbNCED基因表达量进行相关性分析。结果表明,‘黄冠’和‘翠玉’中PbAXP表达量与ASA含量均呈显著负相关,相关系数分别为-0.913和-0.747, 这是由于PbAXP是合成抗坏血酸过氧化物酶的基因,当基因表达下降时,ASA的含量呈上升趋势;‘黄冠’的PbGH3基因表达量与IAA含量呈显著正相关,相关系数为0.884;但‘翠玉’的PbGH3表达量与IAA含量呈正相关,相关系数为0.447。‘黄冠’的PbNCED基因表达量与ABA含量呈负相关,相关系数为-0.308,‘翠玉’中则表现为正相关,相关系数为0.386。
3 讨论植物在受到高温胁迫时,其内部生理生化反应和基因表达都会发生一系列变化,主要表现为光合作用下降, 呼吸作用减弱,细胞膜透性增大,活性氧的含量增加, 启动抗氧化酶和非酶抗氧化物质发生应答性变化[17]。
从生理方面来说,经过高温胁迫后的梨树,叶片中的叶绿素相对含量、净光合速率和PSⅡ的最大光化学效率都有所下降。在本研究中,经过高温处理后,‘黄冠’和‘翠玉’叶片中抗氧化物质、抗氧化酶、渗透性物质含量发生了显著变化。叶绿素含量发生明显的下降,同时MDA含量表现为持续的上升, 这与罗聪等[19]的研究结果一致;保护酶方面,两种梨中的POD和CAT活性总体表现为下降趋势,但‘黄冠’中POD和CAT的含量均高于‘翠玉’这表明‘黄冠’中保护酶的保护能力要强于‘翠玉’。这与刘冬峰等对‘翠冠’和‘圆黄’梨进行短期持续高温胁迫处理和长时间高温胁迫处理的结果一致[18]。
植物体内抗氧化物质含量被认为是植物在逆境胁迫下受伤害的指标[20],本试验中ASA含量在‘黄冠’和‘翠玉’叶片中均为先升高后下降的趋势,这与PbAPX基因的表达量相反,这是由于APX用于清除ASA产生的过氧化氢,当ASA含量下降后植物需要较多的APX清除过氧化氢,这说明高温胁迫后‘黄冠’细胞膜的过氧化程度比‘翠玉’轻、抗逆性更强。
抗氧化酶是植物体内的保护酶,在植物受到胁迫伤害时能清除体内的活性氧和自由基,植物体中的保护酶系统如超氧化物歧化酶、过氧化物酶、过氧化氢酶等可以清除活性氧自由基,防止自由基的毒害,使自由基保持在较低的水平[21]。但随着高温胁迫程度加强,植物自身的抗氧化酶逐渐减少,酶活性下降,导致植物活性氧的积累[21]。ASA是植物在逆境胁迫环境下非常重要的抗氧化物质,是启动氧化还原途径ASA-GSH的重要组分[22]。本研究结果表明,‘黄冠’清除体内活性氧和自由基的能力要比‘翠玉’强,在高温胁迫的第2天ASA-GSH循环开始启动,ASA不断被消耗,从而抵抗外界的胁迫影响。植物体内的内源激素在植物受到逆境条件下会促进气孔关闭,减少水分的散失, 提高植株对水分的调节能力[23-24]。
‘黄冠’的渗透调节物质MDA和PRO含量都高于‘翠玉’,这也解释了‘黄冠’的耐热性要高于‘翠玉’。在内源激素方面,IAA和ABA含量都随着处理时间的延长呈下降趋势,但‘黄冠’叶片中的含量都比‘翠玉’高,IAA和ABA含量的变化趋势与基因PbGH3和PbNCED变化趋势基本吻合。
从基因方面来说,经高温胁迫后PbAPX、PbGH3和PbNCED基因表达量均发生了显著变化,带动植物体内相对应的ASA、IAA和ABA含量变化,从而抵抗高温胁迫。‘黄冠’中的PbGH3表达量在受高温胁迫后的含量显著高于‘翠玉’,且‘黄冠’中的相关基因表达量与相应的物质含量的相关性要高于‘翠玉’,从而说明‘黄冠’针对高温胁迫的反应能力要强于‘翠玉’。
| [1] |
GUO Y P, ZHOU H F, ZENG G H, et al. Effects of high temperature stress on net photosynthetic rate and photosystem Ⅱ activity in Citrus[J].
Chin J Appl Ecol, 2003, 14(6): 867-870. 郭延平, 周慧芬, 曾光辉, 等. 高温胁迫对柑橘光合速率和光系统Ⅱ活性的影响[J]. 应用生态学报, 2003, 14(6): 867-870. |
| [2] |
LI Y L, GUO X M, ZHANG J G, et al. Influences of high temperature stress on antioxidative capacity of apple fruit peel[J].
J Agri Univ Hebei, 2005, 28(1): 18-20. 李英丽, 果秀敏, 张建光, 等. 高温胁迫对苹果果皮组织抗氧化特性的影响[J]. 河北农业大学学报, 2005, 28(1): 18-20. DOI:10.3969/j.issn.1000-1573.2005.01.006 |
| [3] |
LUO H B, MA L, DUAN W, et al. Influence of heat stress on photosynthesis in Vitis vinifera L. cv. Cabernet Sauvignon[J].
Sci Agri Sin, 2010, 43(13): 2744-2750. 罗海波, 马苓, 段伟, 等. 高温胁迫对'赤霞珠'葡萄光合作用的影响[J]. 中国农业科学, 2010, 43(13): 2744-2750. DOI:10.3864/j.issn.0578-1752.2010.13.014 |
| [4] |
TIAN C P, YAO Y T. Effect of heat stress on physiological index of jujube[J].
Tianjin Agri Sci, 2011, 17(3): 15-17. 田彩萍, 姚延梼. 高温胁迫对枣树幼苗生长发育的影响[J]. 天津农业科学, 2011, 17(3): 15-17. DOI:10.3969/j.issn.1006-6500.2011.03.005 |
| [5] |
WANG J, OU Y, WU Z, et al. Effects of high temperature stress on physiological indicators, early defoliation of early-maturing pear[J].
SW China J Agri Sci, 2011, 24(2): 546-551. 王进, 欧毅, 武峥, 等. 高温胁迫对早熟梨生理效应和早期落叶的影响[J]. 西南农业学报, 2011, 24(2): 546-551. DOI:10.3969/j.issn.1001-4829.2011.02.033 |
| [6] |
SUN W H, WANG W Q. Functional mechanism and enzymatic and molecular characteristic of ascorbate peroxidase in plants[J].
Plant Physiol Commun, 2005, 41(2): 143-147. 孙卫红, 王伟青. 植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性[J]. 植物生理学通讯, 2005, 41(2): 143-147. |
| [7] |
REN J, WU J F, LENG P, et al. Cloning and expression analysis of NCED gene from sweet cherry fruit[J].
Acta Hort Sin, 2010, 37(6): 891-898. 任杰, 吴洁芳, 冷平, 等. 甜樱桃果实NCED基因的克隆及其表达[J]. 园艺学报, 2010, 37(6): 891-898. |
| [8] |
GUO X R. Function of ABA to the increasing resistence of Cantharanthus roseus seedlings to high temperature and its proteomic investigation[D]. Harbin:Northeast Forestry University, 2004:1-78.
郭晓瑞. ABA对长春花耐受高温胁迫的作用及其蛋白质组学研究[D]. 哈尔滨: 东北林业大学, 2004: 1-78. |
| [9] |
ZENG W F, PAN L, NIU L, et al. Bioinformatics analysis and expression of the nectarine indole-3-aceticacid-amido synthase (GH3) gene family during fruit development[J].
Acta Hort Sin, 2015, 42(5): 833-842. 曾文芳, 潘磊, 牛良, 等. 桃GH3基因家族的生物信息学分析及其在果实发育中的表达[J]. 园艺学报, 2015, 42(5): 833-842. DOI:10.16420/j.issn.0513-353x.2014-1002 |
| [10] |
LI J, CUI J Z, MI X J. Progress of studies on relationship between auxin and plant response to abiotic stress[J].
Biotechn Bull, 2012(6): 13-17. 李静, 崔继哲, 弭晓菊. 生长素与植物逆境胁迫关系的研究进展[J]. 生物技术通报, 2012(6): 13-17. |
| [11] |
CHEN J X, Wang X F.
Experiment Instruction of Plant Physiology[M]. Guangzhou: South China University of Technology Press, 2002.
陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2002. |
| [12] |
GAO J F.
Experiment Technology of Plant Physiology[M]. Xi'an: World Publishing Corporation, 2000.
高俊凤. 植物生理学实验技术[M]. 西安: 世界图书出版公司, 2000. |
| [13] |
DING J, SHEN Z D, FANG Y X, et al. Extraction and identification of plant endogenous hormone[J].
Plant Physiol Commun, 1979(2): 27-39. 丁静, 沈镇德, 方亦雄, 等. 植物内源激素的提取分离和生物鉴定[J]. 植物生理学通讯, 1979(2): 27-39. |
| [14] |
CHEN K S, XU C J, LI F, et al. An improved HPLC method for analyzing endogenous IAA and ABA in fruit tissues[J].
J Fruit Sci, 2003, 20(1): 4-7. 陈昆松, 徐昌杰, 李方, 等. HPLC法检测果实组织中内源IAA、ABA方法的改进[J]. 果树学报, 2003, 20(1): 4-7. DOI:10.3969/j.issn.1009-9980.2003.01.002 |
| [15] |
CHEN Y P, YANG W Y. Determination of GA3, IAA, ABA and ZT in dormant buds of Allium ovalifolium by HPLC[J].
J Sichuan Agri Univ, 2005, 23(4): 498-500. 陈远平, 杨文钰. 卵叶韭休眠芽中GA3、IAA、ABA和ZT的高效液相色谱法测定[J]. 四川农业大学学报, 2005, 23(4): 498-500. DOI:10.3969/j.issn.1000-2650.2005.04.026 |
| [16] |
ZENG Q Q, CHEN H B, LU C H, et al. An optimized HPLC procedure for analyzing endogenous hormones in different organs of litchi[J].
J Fruit Sci, 2006, 23(1): 145-148. 曾庆钱, 陈厚彬, 鲁才浩, 等. HPLC测定荔枝不同器官中内源激素流程的优化[J]. 果树学报, 2006, 23(1): 145-148. DOI:10.3969/j.issn.1009-9980.2006.01.036 |
| [17] |
YE X Y, MA F W, WANG S C, et al. Physiological effects of kiwifruit lamina under high temperature stress[J].
J NW Sic-Techn Univ Agri For (Nat Sci), 2004, 32(12): 33-37. 耶兴元, 马锋旺, 王顺才, 等. 高温胁迫对猕猴桃幼苗叶片某些生理效应的影响[J]. 西北农林科技大学学报:自然科学版, 2004, 32(12): 33-37. DOI:10.3321/j.issn:1671-9387.2004.12.007 |
| [18] |
LIU D F. Studies on the response of sand pear to high-temperature and heat-tolerance mechanism[D]. Hangzhou:Zhejiang University, 2014:1-131.
刘冬峰. 砂梨对高温胁迫的响应及耐热机理研究[D]. 杭州: 浙江大学, 2014: 1-131. |
| [19] |
TOAN C V, LUO C, HE X H, et al. Effect of high temperature stress on physiology indices of mango seedlings[J].
Chin J Trop Crops, 2016, 37(1): 53-58. 罗聪, 何新华, 等. 高温胁迫对杧果幼苗生理生化指标的影响[J]. 热带作物学报, 2016, 37(1): 53-58. DOI:10.3969/j.issn.1000-2561.2016.01.010 |
| [20] |
YIN X G, LUO Q X, WANG W Q, et al. Studies on methodology for identification of heat tolerance of tomato[J].
SW China J Agri Sci, 2001, 14(2): 62-65. 尹贤贵, 罗庆熙, 王文强, 等. 番茄耐热性鉴定方法研究[J]. 西南农业学报, 2001, 14(2): 62-65. DOI:10.3969/j.issn.1001-4829.2001.02.017 |
| [21] |
WAN Q. Effect of brassinolode on biochemical substances in straw-berry seedlings under high temperature stress[J].
S China Fruits, 2016, 45(3): 117-121. 万群. 芸薹素内酯对高温胁迫下草莓幼苗生化物质的影响[J]. 中国南方果树, 2016, 45(3): 117-121. DOI:10.13938/j.issn.1007-1431.20160024 |
| [22] | SUBBAIAH C C, BUSH D S, SACHS M M. Elevation of cytosolic calcium precedes anoxic gene expression in maize suspension-cultured cells[J]. Plant Cell, 1994, 6(12): 1747-1762. DOI:10.1105/tpc.6.12.1747 |
| [23] | CHEONG J J, YANG D D. Methyl jasmonate as a vital substance in plants[J]. Trends Genet, 2003, 19(7): 409-413. DOI:10.1016/S0168-9525(03)00138-0 |
| [24] |
CHEN P Q, YU S L, ZHAN Y N, et al. Effects of jasmonate acid on thermotolerance of grape seedlings[J].
J Shihezi Univ (Nat Sci), 2006, 24(1): 87-91. 陈培琴, 郁松林, 詹妍妮, 等. 茉莉酸对葡萄幼苗耐热性的影响[J]. 石河子大学学报 (自然科学版), 2006, 24(1): 87-91. DOI:10.3969/j.issn.1007-7383.2006.01.022 |
 2017, Vol. 25
2017, Vol. 25


