2. 德宏州农业技术推广中心, 云南 芒市 678400
2. Extension Center of Agricultural Technology of Dehong State, Mangshi 678400, Yunnan, China
间作是指同一块田地上于同一生长期内,分行或者分带相间种植两种或者两种以上作物的种植模式[1]。这种模式具有悠久的历史,常见大田作物相间种植为主,如玉米 (Zea mays) 间作花生 (Arachis hypogaea)、玉米间作大豆 (Glycine max)。但如今其概念及内容已被广义化,如农林复合系统中人为合理地将农作物、药用作物、经济作物种植于多年生木本植物中也统称为间作[2-3]。该模式通过共生作物时间和空间上的搭配,能够充分利用作物生长季节,提高土地利用率,减少土地资源的浪费,便于用地养地相结合,实现持续增产等[4]。因此,在世界人口急剧增长和耕地面积减少的趋势下,间作越来越受到世界各国农业生产的重视。
合理的间作具有有效利用光、热、肥、水等自然环境资源,减少病虫草害,提高单位耕地面积产量等优点。据报道,玉米与大豆间作的玉米产量比玉米单作的产量明显提高[5],可能是豆科植物与固氮微生物形成根瘤共生体进行固氮作用,能够有效提高系统中的氮供应量,有助于玉米对氮的吸收利用[6];此外,豆类与玉米间作增加害虫天敌,能够减轻花蓟马、黑蚜、白蚁等害虫对豆类和玉米的伤害[7]以及降低白叶枯病和锈病的发生[8],降低杂草的密度[9]。受高位作物玉米的遮荫影响,光照水平分布不同。研究表明低位作物大豆叶片的叶绿素含量、表光量子效率、大豆的气孔导度增大,叶绿素a与叶绿素b的比值 (Chl a/b)、蒸腾速率减小[10]。即间套作通过改变作物的光合生理变化,以提高高位作物利用强光的能力以及低位作物利用弱光的能力[11-12]。目前对间作模式的研究主要关注作物总产量和经济效益[13-14]、作物种间关系和资源捕获能力及利用效率[15-16]、间作对作物病虫害的控制作用[3]等;而间套作条件下矮杆作物的光合作用和光合诱导特征的研究报道则较少。
谢君魔芋 (Amorphophallus xiei) 是新近报道的天南星科 (Araceae) 魔芋属的一新种,主要分布在云南热区的德宏州及中缅边境[17]。谢君魔芋因为产量高、抗病性强,逐渐成了云南省热区主栽魔芋之一。魔芋是一种对光敏感的典型喜阴植物,在生产上常与高秆作物进行间套作种植。玉米是典型的喜光高秆作物,魔芋与玉米搭配间作可以使两种作物充分利用不同层次空间的光源,这种搭配间作是生产上常见的一种栽培模式。然而,受玉米株高和自然界的太阳角度、云量、风速等多因素的影响,魔芋接受到的光照无论在时间上还是空间上都是高度动态变化的。在这种光源环境下,谢君魔芋的光合作用及其光合诱导特征现还不得而知。本试验以间作和净作模式的谢君魔芋为材料,研究其光合作用及其光合诱导特征,以期为喜阴植物谢君魔芋在生产上的合理间套作提供理论依据。
1 材料和方法 1.1 试验地概况试验于2011年4-11月在云南省德宏州农业技术推广中心试验农场 (东经98°34′,北纬24°25′) 进行。该地属于南亚热带季风气候,具有夏长冬短、干湿分明等特点;年均温为19.6℃,年积温7170℃;年均降雨量1700 mm,雨季大致在5-10月,雨季降雨量占全年降水量的89%;年日照2000~2452 h;土壤类型为红壤;无霜期315 d。
1.2 材料和处理谢君魔芋 (Amorphophallus xiei) 主要分布于热带地区,野生种在我国集中分布于云南省德宏州及中缅边境的森林中。供试谢君魔芋由德宏州农业技术推广中心提供,玉米 (Zea mays) 品种为云南省农科院选育的‘云瑞8号’(株高超2.0 m)。选择形状和大小基本一致的谢君魔芋作种芋,在播种前将种芋切成大小均匀的块茎 (约150 g),置于阴处晾干,用农用链霉素以1:10兑水浸种30 min,晒干后待播种。
2011年4月中下旬,对土地进行翻整,间作试验小区长10 m,宽3 m,共设5个小区。相对应地,净作小区同样长10 m,宽3 m。由于试验主要研究谢君魔芋的光合生理生态,因此不对玉米进行单作处理。间作小区种植采用2行玉米+2行魔芋+2行玉米的模式,其中,玉米株距为30 cm,行距为50 cm;魔芋株距为50 cm,行距为60 cm;玉米与魔芋行间距为45 cm。所有试验小区按150 kg N hm-2尿素、120 kg P2O5 hm-2过磷酸钙、100 kg K hm-2氯化钾、20000 kg hm-2腐熟牛粪施肥。除N肥外, 其它肥料作为基肥一次性施用,N肥的30%作为基肥施用,70%作为追肥在播种80 d后施用 (7月中旬)。播种结束后,定期观测田间动态,适时浇水、除草、防治病虫害。于当年8月中旬魔芋球茎膨大期即生长旺盛期进行1周的光合生理生态指标的测定。同时,用Li-1500光学传感器数据采集器 (Li-cor, Lincoln, USA) 测定间作和净作的光照日变化,间作和净作的日总光照辐射比值即为间作的透光率,约为30%。
1.3 光响应曲线的测定2011年8月中旬,选择晴朗的天气,于上午08:00-11:30,从间作、净作小区中随机选择5株健康成熟植株,利用Li-6400XT (Li-cor, Lincoln, USA) 便携式光合仪测定谢君魔芋的光响应曲线。测定时使用开放气路,选用仪器自备的LED光源 (蓝光10%),光合有效辐射 (PAR) 梯度设置为1500、1200、1000、800、600、400、200、150、100、80、60、40、20、0 μmol m-2s-1;叶室温度控制在 (25±1)℃,利用CO2注入系统将参比室CO2浓度控制在400 μmol mol-1。先将叶片在光强1500 μmol m-2s-1下诱导10 min, 然后每个梯度稳定180 s后自动记录的净光合速率 (Pn)。拟合Pn-PAR光响应曲线[18],拟合方程式为: Pn=a-c×e-b×PAR,其中,a、b、c是系数,PAR是光合有效辐射,a为最大净光合速率 (Pmax);暗呼吸速率 (Rd)=a-c;光补偿点 (LCP)=ln (0.1a/c)×(-1/b);光饱和点 (LSP)=ln (a/c)×(-1/b);表观量子产额 (AQY)=b×c×e[b×(-LCP)];水分利用效率 (iWUE)=Pmax/gs[19],gs为仪器自动记录Pmax对应的气孔导度。
1.4 CO2响应曲线的测定测定谢君魔芋的CO2响应曲线时,控制参比室CO2浓度梯度为400、300、200、100、50、400、600、800、1200、1500 μmol mol-1,光照强度为1000 μmol m-2s-1,叶室温度等其他条件与光响应曲线相同,仪器在每个梯度稳定180 s后自动记录净光合速率 (Pn) 和胞间CO2浓度 (Ci),按照许大全[20]的方法,建立Pn-Ci响应曲线,其直线部分的拟合方程为:y=kx+b,其中,k为羧化效率 (CE)。
CO2补偿点 (Г*)=-b/k,最大羧化速率 (Vcmax) 和最大电子传递速率 (Jmax)[21-22]按下式计算:Vcmax=k×[Ci+KC×(1+O/KO)]2/[Г*+KC×(1+O/KO)];Jmax=[4×(Pmax+Rd)×(Ci+2Г*)]/[Ci-Г*], 其中,O为210 mmol mol-1,Ci为胞间CO2浓度,Г*为CO2补偿点,KC为404.9 μmol mol-1,KO为278.4 mmol mol-1。
1.5 模拟光斑诱导曲线的测定本试验设置20~1500 μmol m-2s-1模拟光斑的光诱导。测量前一天将叶片用黑色塑料袋包好,避免自然光照的诱导影响。测量时,除光强外其他设置与光响应曲线相同。仪器先设置光强为20 μmol m-2s-1记录3 min,每30 s记录1次净光合速率 (Pn)、气孔导度 (gs)、胞间CO2浓度 (Ci) 和蒸腾速率 (Tr); 随后瞬时将光合有效辐射提高为1500 μmol m-2s-1,每30 s记录1次Pn、gs、Ci和Tr,连续记录20 min。根据光合诱导曲线计算在光合诱导过程中达到最大光合速率30%、50%和90%所需的时间 (t30%P、t50%P和t90%P),同时计算达到最大气孔导度30%、50%和90%所需的时间 (t30%gs、t50%gs和t90%gs)。根据公式100×Pn/Pmax[23]计算1 min、3 min、6 min的光合诱导状态IS1 min、IS3 min和IS6 min。此外,仪器自动记录初始气孔导度 (gs-initial) 和最大气孔导度 (gs-max)。
模拟光斑诱导的拟合方程[24]为:P (t)=Pshade+ (Pmax-Pshade)(1-e-t/t1), 式中,Pshade为暗适应=(20 μmol m-2s-1) 的光合速率;Pmax为高光诱导 (1500 μmol m-2s-1) 稳定后的最大光合速率;t1为时间常数,t为光合诱导时间。
1.6 叶绿素含量的测定利用SPAD 502 plus叶绿素仪 (日本KONICA MINOLTA公司) 测定叶绿素含量相对值。
1.7 数据处理采用Excel 2003及SPSS 17.0 (SPSS Inc, USA) 软件对数据进行统计分析,采用独立样本t检验进行显著性分析,当P < 0.05表示处理间差异显著; 运用Sigmaplot 10.0软件作图。
2 结果和分析 2.1 种植模式对光合特性的影响在间作和净作模式下,谢君魔芋的光响应曲线的变化趋势相同:先快速升高随后缓慢上升并稳定 (图 1: A)。光照强度为0~200 μmol m-2s-1时,两种种植模式下的净光合速率上升程度相似。然而,当光照强度升高至400 μmol m-2s-1以后,间作模式下,谢君魔芋的Pn高出净作的18.97% (表 1),且LCP、LSP和iWUE也高于净作。间作与净作相比,谢君魔芋的Rd降低50.88%,LSP升高22.38%,LCP降低59.43%,AQY增大26.32%。这表明间作谢君魔芋拥有较高的光合作用能力。
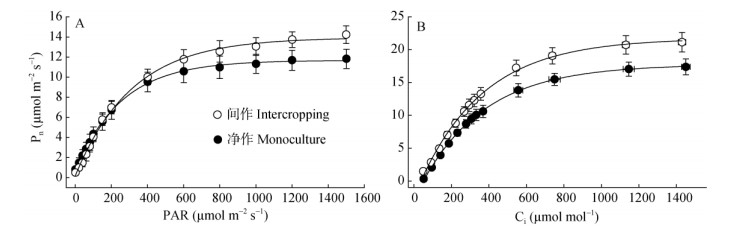
|
图 1 间作、净作模式下谢君魔芋叶片的光响应曲线 (A) 和CO2响应曲线 (B)。n=4或5。 Fig. 1 Light response curve (A) and CO2 response curve (B) of Amorphophallus xieileaves under intercropping and monoculture planting patterns. n=4 or 5. |
| 表 1 间作、净作模式对谢君魔芋光合作用特征的影响 Table 1 Photosynthetic traits ofAmorphophallusxiei under intercropping and monoculture planting patterns |
随着CO2浓度的升高谢君魔芋的Pn升高 (图 1: B),当胞间CO2浓度大于300 μmol mol-1,间作的Pn显著大于净作模式。净作模式下的谢君魔芋的CE、Jmax、Vcmax和Г*分别比间作模式的低13.6%、3.99%、14.7%和36.74% (表 1),且叶绿素SPAD值比间作低6.33%。
2.2 种植模式对光诱导特征的影响从低光照到高光照 (20~1500 μmol m-2s-1), 谢君魔芋的Pn和iWUE诱导曲线呈现S形,且间作模式下谢君魔芋的Pn较高。间作下气孔导度诱导曲线呈S形,而净作下气孔导度随着诱导时间先升后降,其气孔导度变化幅度较间作大。这可能是净作的谢君魔芋受直射光照较强,植物需通过气孔散发热量,减小对叶片的伤害,因而气孔导度大。高光诱导后,间作和净作的蒸腾速率诱导曲线都随着诱导时间的延长呈先上升后下降的趋势。两种模式下谢君魔芋Ci诱导曲线随诱导时间延长均呈下降趋势 (图 2)。从表 2可看出,间作模式下达到30%和50% Pmax和gs-max所需时间较短,而达到90% Pmax和gs-max的时间则长于净作模式。高光照诱导1、3、6 min后,间作模式下的谢君魔芋光合诱导状态大于净作模式,而净作模式下gs-max大于间作模式的80.3%,且gs-initial为间作模式的2倍以上。
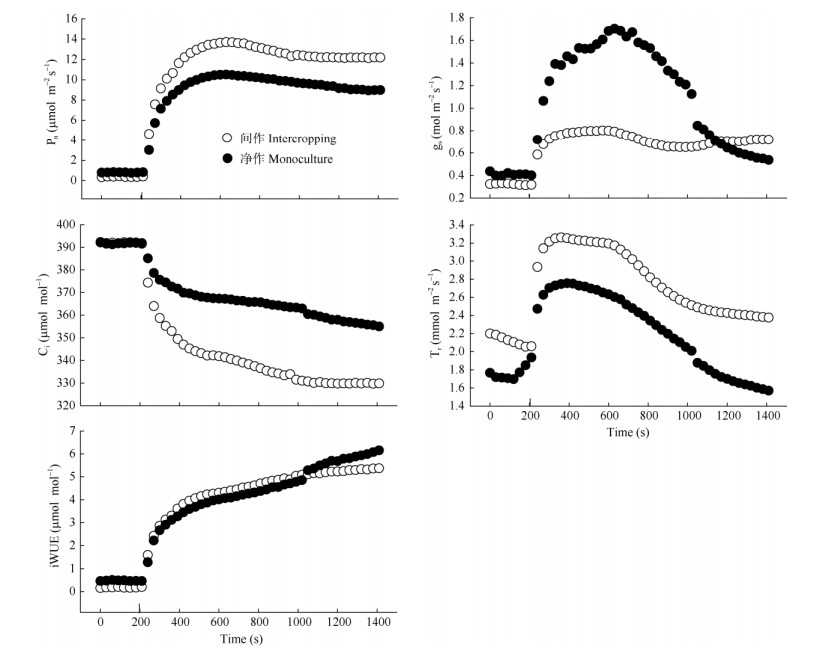
|
图 2 间作、净作模式下谢君魔芋叶片光诱导曲线。n=4 or 5。 Fig. 2 Light induction curves in leaves of Amorphophallusxieiunder intercropping and monoculture planting patterns. n=4 or 5. |
| 表 2 间作、净作模式下谢君魔芋的光合诱导特征 Table 2 Photosynthetic induction traits of Amorphophallusxieiunder intercropping and monoculture planting patterns |
从图 3可以看出,谢君魔芋经低光适应后,初始气孔导度影响光合速率和气孔开放的快慢。谢君魔芋达到Pmax和gs-max的30%、50%和90%的时间 (t30%P、t50%P、t90%P和t30%gs、t50%gs、t90%gs) 与gs-initial成负相关关系,即初始气孔导度越大,到达Pmax和gs-max所需时间越短。CO2进入光合系统与气孔开放程度有关,在20~1500 μmol m-2s-1光合诱导过程中,两种模式下的谢君魔芋光合速率的上升伴随着CO2浓度减小,当CO2浓度降低到一定值后,出现光合速率减小 (图 4)。
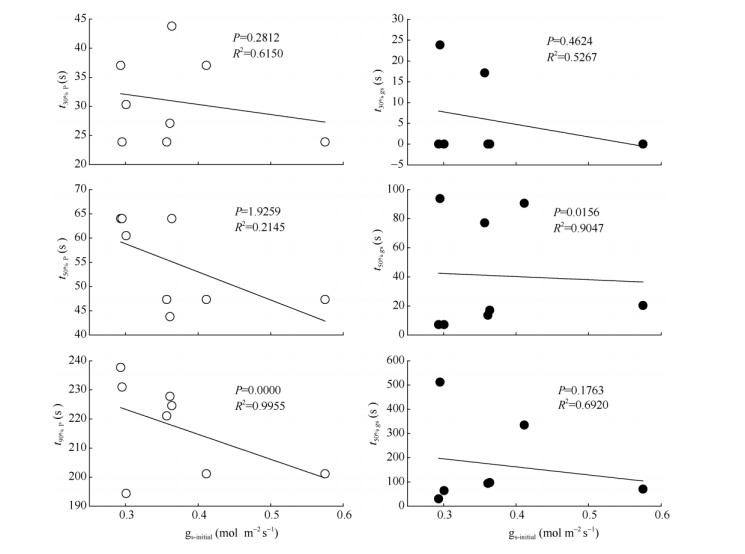
|
图 3 两种模式下谢君魔芋达到30%、50%、90%的Pmax和gs-max所需时间 (t30%P、t50%P、t90%P、t30%gs、t50%gs和t90%gs) 与gs-initial的关系 Fig. 3 Relationships between the time required to reach 30%, 50% and 90% of Pmax and gs-max (t30%P, t50%P, t90%P, t30%gs, t50%gs, t90%gs) with initial stomatal conductance (gs-initial) inAmorphophallusxiei |
|
图 4 光诱导过程中净光合速率 (Pn) 和胞间CO2浓度 (Ci) 的关系 Fig. 4 Relationship between net photosynthetic rate (Pn) and intercellular CO2 concentration (Ci) during light induction |
不同光照环境下的植物具有不同的光适应机制[25-27]。AQY反映植物吸收和转换自然光的能力[28],较低的Rd和LCP以及较高的LSP使植物减少呼吸消耗,将光合作用同化物以最大比例储存于光合组织中[29],叶绿素含量反映了对光的捕获能力和光量子转化潜力[30]。本研究结果表明,在间作模式下, 谢君魔芋具有较大AQY、LSP和较高叶绿素含量 (SPAD值),且Rd、LCP较小,表明间作能增强其对光的利用能力,特别是能增强对弱光的捕获能力, 有利于提高净光合速率和增加碳积累。此外,在间作模式下,CO2补偿点 (Г*) 较小,CE、Vcmax和Jmax较大,Г*表征了羧化反应中Rubisco的活性,CE与叶片中Rubisco的数量和活性正相关[31],暗示着间作种植模式有利于喜阴植物谢君魔芋保持较高Rubisco数量和活性。本研究结果与喜阴植物福建马蓝 (Strobilanthes cusia) 遮阴后的光合特征变化相似[32]。
光斑是间作体系中矮秆作物进行光合作用的主要光能来源。在明暗交替的光照环境下,能引起植物光合速率的快速变化[33]。植物光合诱导的快慢影响其光合速率,而影响光合诱导的主要因素是光合同化酶的活性、光合碳同化中间产物的再生以及叶片气孔开放的快慢[34-35],分别称作生化限制[36]和气孔限制[37]。本研究中,虽然间作与净作的谢君魔芋在t30%P、t50%P、t90%P上没有达到统计意义的显著差异,但间作所需时间较短 (表 2)。与喜阴木本植物[38-39]、蕨类植物[40]、药用植物[41]相比,本研究间作和净作的光合诱导时间较快。Naumberg等[42]认为喜阴植物的t90%P一般为3~37 min,本研究在4 min以内,说明喜阴植物谢君魔芋对高光的诱导响应速度较快,这可能与其生长于阴生的热带雨林下有关。有研究报道在诱导过程中生化限制因素主要发生在光合诱导的初期,气孔限制因素主要发生在后期[43],且gs-initial越大,t90%P越短[39]。本研究结果表明gs-initial越大光合诱导速率越快。气孔导度与gs-initial呈负相关关系 (图 4),与前人的研究结果一致。
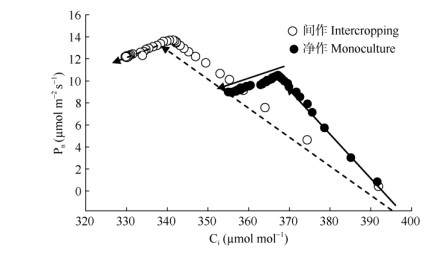
本研究中,谢君魔芋的种植采用人工灌溉,不存在水分胁迫,受光照影响最大。左应梅等[44]的研究表明,木薯 (Manihot esculenta) 的光照强度与气孔导度存在正相关关系。在间作体系中,谢君魔芋受到玉米遮光,其气孔导度相对较小,但蒸腾速率和光合速率较大,可能是适宜的光照有利于活化光合酶活性[45],有利于植物进行光合作用,但具体限制性因素还需进一步研究。本研究结果还表明,净作模式下的谢君魔芋对CO2浓度较敏感,低于366 μmol mol-1时光合速率下降,但间作模式下CO2浓度低于340 μmol mol-1时光合速率才降低 (图 5)。说明间作模式下,谢君魔芋光合作用受生化限制影响相对较小,气孔导度较小仍能维持较高的光合作用速率。
总的来看,间作体系产生的适度遮阴有利于发挥喜阴植物谢君魔芋光合作用的潜力。间作模式下较高的AQY、LSP和较低的Rd和LCP能提高谢君魔芋对光的利用能力和减少能量消耗,促进光合作用的高效进行以增加碳获得。此外,间作模式下谢君魔芋通过快速开放气孔及减小生化限制的影响, 提高光合诱导速率,以维持自身较高的光合诱导状态,提高对光斑的利用能力来增加碳获得。
| [1] |
SU B Y, CHEN S B, LI Y G, et al. Intercropping enhances the farmland ecosystem services[J].
Acta Ecol Sin, 2013, 33(14): 4505-4514. 苏本营, 陈圣宾, 李永庚, 等. 间套作种植提升农田生态系统服务功能[J]. 生态学报, 2013, 33(14): 4505-4514. DOI:10.5846/stxb201204200574 |
| [2] |
PING X Y, WANG T M, LU X S. Review of advances in carbon sequestration potential of agroforestry[J].
Chin J Plant Ecol, 2013, 37(1): 80-92. 平晓燕, 王铁梅, 卢欣石. 农林复合系统固碳潜力研究进展[J]. 植物生态学报, 2013, 37(1): 80-92. DOI:10.3724/SP.J.1258.2013.00009 |
| [3] | JURIK T W, VAN K. Microenvironment of a corn-soybean-oat strip intercrop system[J]. Field Crop Res, 2004, 90(2/3): 335-349. DOI:10.1016/j.fcr.2004.04.002 |
| [4] |
LI C H, WU B Z. Summary of planting patterns on intercropping maize[J].
J Maize Sci, 2005, 13(2): 85-89. 李彩虹, 吴伯志. 玉米不同间作方式对坡耕地水土流失的影响[J]. 玉米科学, 2005, 13(2): 85-89. DOI:10.13597/j.cnki.maize.science.2005.02.027 |
| [5] | WADDINGTON S R, MEKURIA M, SIZIBA S, et al. Long-term yield sustainability and financial returns from grain legume-maize intercrops on a sandy soil in subhumid north central Zimbabwe[J]. Exp Agri, 2007, 43(4): 489-503. DOI:10.1017/S0014479707005303 |
| [6] | SINGHA N B, SINGHA P P, NAIRA K P P. Effect of legume intercropping on enrichment of soil nitrogen, bacterial activity and productivity of associated maize crops[J]. Exp Agri, 1986, 22(4): 339-344. DOI:10.1017/S0014479700014587 |
| [7] | KYAMANYWA S, AMPOFO J K O. Effect of cowpea/maize mixed cropping on the incident light at the cowpea canopy and flower thrips (Thysanoptera:Thripidae) population density[J]. Crop Prot, 1988, 7(3): 186-189. DOI:10.1016/0261-2194(88)90068-3 |
| [8] | FININSA C. Effect of intercropping bean with maize on bean common bacterial blight and rust diseases[J]. Inter J Pest Manage, 1996, 42(1): 51-54. DOI:10.1080/09670879609371969 |
| [9] | ABRAHAM C T, SINGH S P. Weed management in sorghum-legume intercropping systems[J]. J Agri Sci, 1984, 103(1): 103-115. DOI:10.1017/S0021859600043379 |
| [10] |
LI Z, QIN X Y, WANG X G, et al. Effect of intercropping with maize on photosynthesis and chlorophyll fluorescence parameters of soybean[J].
Soybean Sci, 2010, 29(5): 808-811. 李植, 秦向阳, 王晓光, 等. 大豆/玉米间作对大豆叶片光合特性和叶绿素荧光动力学参数的影响[J]. 大豆科学, 2010, 29(5): 808-811. |
| [11] |
SU B Y, SONG Y X, CHEN S B, et al. Photosynthetic responses of soybean (Glycine max) seedlings to shading caused by maize in an intercropping system[J].
Acta Ecol Sin, 2015, 35(10): 3298-3308. 苏本营, 宋艳霞, 陈圣宾, 等. 大豆幼苗对套作玉米遮荫环境的光合生理生态响应[J]. 生态学报, 2015, 35(10): 3298-3308. DOI:10.5846/stxb201307031833 |
| [12] |
WU J, SHI C X, ZU Y Q, et al. Effects of maize and pepper inter-cropping on the photosynthetic characteristics, biomass and yield of maize and pepper[J].
Chin Agri Sci Bull, 2014, 30(30): 117-121. 吴炯, 施翠仙, 祖艳群, 等. 玉米/辣椒间作对玉米和辣椒光合特征、生物量和产量的影响[J]. 中国农学通报, 2014, 30(30): 117-121. |
| [13] | GHOSH P K, MOHANTY M, BANDYOPADHYAY K K, et al. Growth, competition, yields advantage and economics in soybean/pigeonpea intercropping system in semi-arid tropics of India:Ⅱ. Effects of nutrient managemen[J]. Field Crop Res, 2006, 96(1): 90-97. DOI:10.1016/j.fcr.2005.05.010 |
| [14] | GHOSH P K, MOHANTY M, BANDYOPADHYAY K K, et al. Growth, competition, yields advantage and economics in soybean/pigeonpea intercropping system in semi-arid tropics of India:Ⅰ. Effects of subsoiling[J]. Field Crop Res, 2006, 96(1): 80-89. DOI:10.1016/j.fcr.2005.05.009 |
| [15] | GAO Y, DUAN A W, SUN J S, et al. Crop coefficient and water-use efficiency of winter wheat/spring maize strip intercropping[J]. Field Crop Res, 2009, 111(1/2): 65-73. DOI:10.1016/j.fcr.2008.10.007 |
| [16] | ZHANG L, WERF W V D, BASTIAANS L, et al. Light interception and utilization in relay intercrops of wheat and cotton[J]. Field Crop Res, 2008, 107(1): 29-42. DOI:10.1016/j.fcr.2007.12.014 |
| [17] |
XIE S Q, ZHANG Y F, XIE Q H, et al.
In vitro Breeding and Standar-dization Cultivation Techniques of Amorphophallus[M]. Kunming: Yunnan Science and Technology Press, 2010: 57-58.
谢世清, 张云峰, 谢庆华, 等. 魔芋的离体繁育及优化魔芋规范化栽培技术研究[M]. 昆明: 云南科技出版社, 2010: 57-58. |
| [18] | WEBB W L, NEWTON M, STARR D. Carbon dioxide exchange of Alnus rubra:A mathematical model[J]. Oecologia, 1974, 17(4): 281-291. DOI:10.1007/BF00345747 |
| [19] | LIU Y B, ZHANG T G, LI X R, et al. Protective mechanism of desiccation tolerance in Reaumuria soongorica:Leaf abscission and sucrose accumulation in the stem[J]. Sci China Ser C, 2007, 50(1): 15-21. DOI:10.1007/s11427-007-0002-8 |
| [20] |
XU D Q.
Photosynthetic Efficiency[M]. Shanghai: Shanghai Science and Technology Press, 2002: 15-124.
许大全. 光合作用效率[M]. 上海: 上海科学技术出版社, 2002: 15-124. |
| [21] | BEMACCHI C J, SINGSAAS E L, PIMENTEL C, et al. Improved temperature response functions for models of rubisco-limited photo-synthesis[J]. Plant Cell Environ, 2001, 24(2): 253-259. DOI:10.1111/j.1365-3040.2001.00668.x |
| [22] | LOUSTAU D, BEAHIM M B, GAUDILLERE J P, et al. Photo-synthetic responses to phosphorous nutrition in two-year-old maritime pine seedlings[J]. Tree Physiol, 1999, 19(11): 707-715. DOI:10.1093/treephys/19.11.707 |
| [23] | ALLEN M T, PEARCY R W. Stomatal behavior and photosynthetic performance under dynamic light regimes in a seasonally dry tropical rain forest[J]. Oecologia, 2000, 122(4): 470-478. DOI:10.1007/s004420050968 |
| [24] | TAUSZ M, WARREN C R, ADAMS M A. Dynamic light use and protection from excess light in upper canopy and coppice leaves of Nothofagus cunninghamii in an old growth, cool temperature rainforest in Victoria, Australia[J]. New Phytol, 2005, 165(1): 143-156. DOI:10.1111/j.1469-8137.2004.01232.x |
| [25] |
HUANG W D, WU L K, ZHAN J C. Growth and photosynthesis adaptation of dwarf-type Chinese cherry (Prunus pseudocerasus L. cv. Laiyang) leaves to weak light stress[J].
Sci Agri Sin, 2004, 37(12): 1981-1985. 黄卫东, 吴兰坤, 战吉成. 中国矮樱桃叶片生长和光合作用对弱光环境的适应性调节[J]. 中国农业科学, 2004, 37(12): 1981-1985. DOI:10.3321/j.issn:0578-1752.2004.12.033 |
| [26] |
WANG J Y, WANG W Q, LIU Y. Studies on the photosynthesis and physiological adaptability of medicinal plants in tree-medicinal plant intercropping system[J].
For Res, 2003, 16(2): 129-134. 王继永, 王文全, 刘勇. 林药间作系统中药用植物光合生理适应性规律研究[J]. 林业科学研究, 2003, 16(2): 129-134. DOI:10.3321/j.issn:1001-1498.2003.02.002 |
| [27] |
LI C H, ZHAO Y L, YANG G H, et al. Effects of shading on photo-synthetic characteristics of different genotype maize[J].
Chin J Appl Ecol, 2007, 18(6): 1259-1264. 李潮海, 赵亚丽, 杨国航, 等. 遮光对不同基因型玉米光合特性的影响[J]. 应用生态学报, 2007, 18(6): 1259-1264. |
| [28] |
YANG Y, WANG C H, LIU Y H. The effect of low irradiance on growth photosynthetic characteristics and biomass allocation in two deciduous broad-leaved tree seedlings in southeast of Hubei Province[J].
Acta Ecol Sin, 2010, 30(22): 6082-6090. 杨莹, 王传华, 刘艳红. 光照对鄂东南2种落叶阔叶树种幼苗生长、光合特性和生物量分配的影响[J]. 生态学报, 2010, 30(22): 6082-6090. |
| [29] | GYIMAH R, NAKAO T. Early growth and photosynthetic responses to light in seedlings of three tropical species differing in successional strategies[J]. New For, 2007, 33(3): 217-236. DOI:10.1007/s11056-006-9028-1 |
| [30] |
HU Y B, XU N, BAO Z, et al. Response of photosynthetic induction to irradiance transition in mulberry leaf[J].
Chin J Eco-Agri, 2010, 18(4): 799-80. 胡彦波, 许楠, 包卓, 等. 桑树叶片光合诱导对光强转换的响应[J]. 中国生态农业学报, 2010, 18(4): 799-80. DOI:10.3724/SP.J.1011.2010.00799 |
| [31] |
SUN G C, ZHAO P, ZENG X P, et al. Changes of leaf photosynthetic parameters in leaves of Woonyoungia septentrionalis and Tsoongio-dendron lotungensis under different growth-irradiation[J].
Acta Phyto-ecol Sin, 2002, 26(3): 355-362. 孙谷畴, 赵平, 曾小平, 等. 不同光强下焕镛木和观光木的光合参数变化[J]. 植物生态学报, 2002, 26(3): 355-362. |
| [32] |
NING S J, ZHANG Y J, LIN J Y, et al. Effects of different light intensities on Strobilanthes cusia photosynthetic characteristics in Fujian Province[J].
Chin J Eco-Agri, 2012, 20(7): 901-908. 宁书菊, 张英娇, 林建勇, 等. 光照对福建马蓝光合特性的影响[J]. 中国生态农业学报, 2012, 20(7): 901-908. DOI:10.3724/SP.J.1011.2012.00901 |
| [33] |
XU D Q.
Photosynthesis[M]. Beijing: Science Press, 2010: 188-346.
许大全. 光合作用学[M]. 北京: 科学出版社, 2010: 188-346. |
| [34] |
XU D Q. Responses of photosynthesis and related processes to long-term high CO2 concentration[J].
Plant Physiol Commun, 1994, 30(2): 81-87. 许大全. 光合作用及有关过程对长期高CO2浓度的响应[J]. 植物生理学通讯, 1994, 30(2): 81-87. DOI:10.13592/j.cnki.ppj.1994.02.001 |
| [35] | CHEN J W, ZHANG Q, LI X S, et al. Steady and dynamic photo-synthetic responses of seedlings from contrasting successional groups under low-light growth conditions[J]. Physiol Plant, 2011, 141(1): 84-95. DOI:10.1111/j.1399-3054.2010.01414.x |
| [36] | PONS T L, PEARCY R W, SEEMANN J R. Photosynthesis in flashing light in soybean leaves grown in different conditions:Ⅰ. Photosynthetic induction state and regulation of ribulose-1, 5-bisphosphate carboxylase activity[J]. Plant Cell Environ, 1992, 15(5): 569-576. DOI:10.1111/j.1365-3040.1992.tb01490.x |
| [37] | SASSENRATH-COLE G F, PEARCY R W. The role of ribulose-1, 5-bisphosphate regeneration in the induction requirement of photo-synthetic CO2 exchange under transient light conditions[J]. Plant Physiol, 1992, 99(1): 227-234. DOI:10.1104/pp.99.1.227 |
| [38] | ZHANG Q, CHEN Y J, SONG L Y, et al. Utilization of lightflecks by seedlings of five dominant tree species of different subtropical forest successional stages under low-light growth conditions[J]. Tree Physiol, 2012, 32(5): 545-553. DOI:10.1093/treephys/tps043 |
| [39] | BAI K D, LIAO D B, JIANG D B, et al. Photosynthetic induction in leaves of co-occurring Fagus lucida and Castanopsis lamontii saplings grown in contrasting light environments[J]. Trees, 2008, 22(4): 449-462. DOI:10.1007/s00468-007-0205-4 |
| [40] | ZHANG Q, CHEN J W, LI B G, et al. Epiphytes and hemiepiphytes have slower photosynthetic response to lightflecks than terrestrial plants:Evidence from ferns and figs[J]. J Trop Ecol, 2009, 25(5): 465-472. DOI:10.1017/S026646740900618X |
| [41] | CHEN J W, KUANG S B, LONG G Q, et al. Steady-state and dynamic photosynthetic performance and nitrogen partitioning in the shade-demanding plant Panax notoginseng under different levels of growth irradiance[J]. Acta Physiol Plant, 2014, 36(9): 2409-2420. DOI:10.1007/s11738-014-1614-9 |
| [42] | NAUMBURG E, ELLSWORTH D S. Photosynthetic sunfleck utili-zation potential of understory saplings growing under elevated CO2[J]. Oecologia, 2000, 122(2): 163-174. DOI:10.1007/PL00008844 |
| [43] |
XU D Q, XU B J. The role of stomatal limitation in photosynthetic induction of plant leaves[J].
Acta Phytophysiol Sin, 1989, 15(3): 275-280. 许大全, 徐宝基. 气孔限制在植物叶片光合诱导中的作用[J]. 植物生理学报, 1989, 15(3): 275-280. |
| [44] |
ZUO Y M, CHEN Q B, DENG Q Q, et al. Effects of soil moisture, light and air humidity on stomatal conductance of cassava (Manihot esculenta Crantz)[J].
Chin J Ecol, 2011, 30(4): 689-693. 左应梅, 陈秋波, 邓权权, 等. 土壤水分、光照和空气湿度对木薯气孔导度的影响[J]. 生态学杂志, 2011, 30(4): 689-693. |
| [45] |
CAI Z Q, CAO K F, ZHENG L. Photosynthetic induction in seedlings of six tropical rainforest tree species[J].
Acta Phytoecol Sin, 2003, 27(5): 617-623. 蔡志全, 曹坤芳, 郑丽. 6种热带雨林木本植物幼苗光合诱导的研究[J]. 植物生态学报, 2003, 27(5): 617-623. |
 2017, Vol. 25
2017, Vol. 25


